名校
解题方法
1 . 乙酰苯胺是一种无色有闪光的小叶状固体或白色晶性粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂。乙酰苯胺的一种制备原理为:
实验步骤:
【步骤1】如图所示,在圆底烧瓶中加入无水苯胺 、冰醋酸
、冰醋酸 、锌粉
、锌粉 ,安装仪器,加入沸石,调节加热温度,使温度计温度控制在
,安装仪器,加入沸石,调节加热温度,使温度计温度控制在 左右,反应约
左右,反应约 ,当反应基本完成时,停止加热。
,当反应基本完成时,停止加热。 水,搅拌加热至沸腾,使粗品完全溶解。
水,搅拌加热至沸腾,使粗品完全溶解。
【步骤3】稍冷后,加入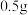 活性炭,并煮沸
活性炭,并煮沸 ,趁热抽滤除去活性炭。
,趁热抽滤除去活性炭。
【步骤4】将滤液倒入烧杯中,自然冷却,析出晶体。抽滤、洗涤、干燥得产品,称其质量。
回答下列问题:
(1)仪器a的名称_____ 。
(2)【步骤1】加热可用_____ (填“水浴”或“油浴”)。
(3)制备过程中加入锌粉的作用为_____ 。
(4)从化学平衡的角度分析,使用刺形分馏柱并控制分馏柱上端的温度在 左右的原因:
左右的原因:_____ 。
(5)乙酰苯胺粗品因含杂质而显色,【步骤3】中加入活性炭吸附有色杂质,加入活性炭需要待沸腾的溶液稍冷却后再加入,其目的是_____ 。
(6)该实验最终得到纯品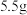 ,则乙酰苯胺的产率为
,则乙酰苯胺的产率为_____ (保留一位小数)。
(7)乙酰苯胺可以在 热溶液中发生水解,写出其反应方程式:
热溶液中发生水解,写出其反应方程式:_____ 。
(8)当制备少量乙酰苯胺时,常用图所示的微型仪器组装成实验装置制备。当观察到_____ 现象时,反应基本结束。
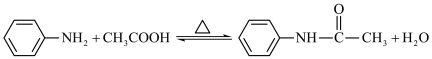
| 名称 | 相对分子质量 | 性状 | 密度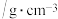 | 沸点/℃ | 溶解度 | 备注 |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚 | 易被氧化 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水,易溶于乙醇、乙醚 | |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |
【步骤1】如图所示,在圆底烧瓶中加入无水苯胺
 、冰醋酸
、冰醋酸 、锌粉
、锌粉 ,安装仪器,加入沸石,调节加热温度,使温度计温度控制在
,安装仪器,加入沸石,调节加热温度,使温度计温度控制在 左右,反应约
左右,反应约 ,当反应基本完成时,停止加热。
,当反应基本完成时,停止加热。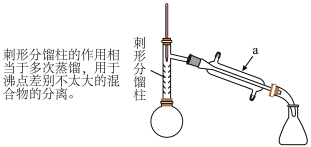
 水,搅拌加热至沸腾,使粗品完全溶解。
水,搅拌加热至沸腾,使粗品完全溶解。【步骤3】稍冷后,加入
 活性炭,并煮沸
活性炭,并煮沸 ,趁热抽滤除去活性炭。
,趁热抽滤除去活性炭。【步骤4】将滤液倒入烧杯中,自然冷却,析出晶体。抽滤、洗涤、干燥得产品,称其质量。
回答下列问题:
(1)仪器a的名称
(2)【步骤1】加热可用
(3)制备过程中加入锌粉的作用为
(4)从化学平衡的角度分析,使用刺形分馏柱并控制分馏柱上端的温度在
 左右的原因:
左右的原因:(5)乙酰苯胺粗品因含杂质而显色,【步骤3】中加入活性炭吸附有色杂质,加入活性炭需要待沸腾的溶液稍冷却后再加入,其目的是
(6)该实验最终得到纯品
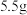 ,则乙酰苯胺的产率为
,则乙酰苯胺的产率为(7)乙酰苯胺可以在
 热溶液中发生水解,写出其反应方程式:
热溶液中发生水解,写出其反应方程式:(8)当制备少量乙酰苯胺时,常用图所示的微型仪器组装成实验装置制备。当观察到

您最近一年使用:0次
2 . 氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。乙醇与水催化重整制氢发生以下反应:
反应Ⅰ: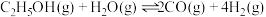
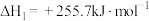
反应Ⅱ: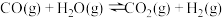
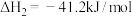
已知相关键能数据如下表:
(1)
_____  ,反应Ⅰ自发进行的条件是
,反应Ⅰ自发进行的条件是_____ (填序号)。
A.高压 B.低压 C.高温 D.低温
(2)向某恒容密闭容器中充入 和
和 ,起始压强为
,起始压强为 ,若仅发生上述反应,平衡时
,若仅发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的变化曲线如图所示[已知:
的选择性、乙醇的转化率随温度的变化曲线如图所示[已知: 的选择性
的选择性 ]。
]。 的选择性的是曲线
的选择性的是曲线_____ (填“a”或“b”或“c”)。
②反应Ⅱ的平衡常数:
_____  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
③下列能提高平衡时乙醇转化率的措施有_____ (填序号)。
A.适当减小压强 B.选用高效催化剂 C.增大 的投料 D.适当升高温度
的投料 D.适当升高温度
④设 为相对压力平衡常数,即在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,即在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以 。
。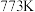 时,反应Ⅰ的相对压力平衡常数为
时,反应Ⅰ的相对压力平衡常数为
_____ (保留到小数点后一位)。
(3)研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。_____ 。
②电池工作时正极区溶液的
_____ (填“增大”“减小”或“不变”,忽略溶液的体积变化)。
③外电路通过 电子,体系中水增多
电子,体系中水增多_____  。
。
反应Ⅰ:
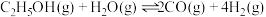
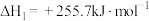
反应Ⅱ:
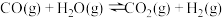
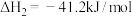
已知相关键能数据如下表:
| 化学键 |  |  |  |  |
键能/ | 436 | 464.4 | a | 1072 |
(1)

 ,反应Ⅰ自发进行的条件是
,反应Ⅰ自发进行的条件是A.高压 B.低压 C.高温 D.低温
(2)向某恒容密闭容器中充入
 和
和 ,起始压强为
,起始压强为 ,若仅发生上述反应,平衡时
,若仅发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的变化曲线如图所示[已知:
的选择性、乙醇的转化率随温度的变化曲线如图所示[已知: 的选择性
的选择性 ]。
]。
 的选择性的是曲线
的选择性的是曲线②反应Ⅱ的平衡常数:

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。③下列能提高平衡时乙醇转化率的措施有
A.适当减小压强 B.选用高效催化剂 C.增大
 的投料 D.适当升高温度
的投料 D.适当升高温度④设
 为相对压力平衡常数,即在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,即在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以 。
。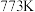 时,反应Ⅰ的相对压力平衡常数为
时,反应Ⅰ的相对压力平衡常数为
(3)研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。

②电池工作时正极区溶液的

③外电路通过
 电子,体系中水增多
电子,体系中水增多 。
。
您最近一年使用:0次
名校
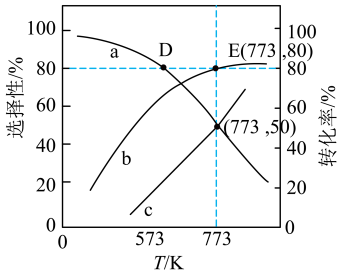
3 . 我国力争在2060年前实现碳中和。研究二氧化碳的回收对这一宏伟目标的实现具有现实意义。
Ⅰ.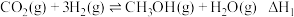
Ⅱ.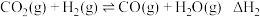
回答下列问题:
(1)298K时,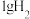 燃烧生成
燃烧生成 放热121kJ,
放热121kJ,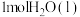 蒸发吸热44kJ表示
蒸发吸热44kJ表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ ;
(2)同一容器中,反应Ⅰ、Ⅱ的lnK(K为化学平衡常数)随 的变化如图,下列说法正确的是_______;
的变化如图,下列说法正确的是_______;
(3)在 ,将
,将 和
和 按照1∶3的比例混合在密闭容器中,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内
按照1∶3的比例混合在密闭容器中,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内 的选择性和产率随温度的变化如图。
的选择性和产率随温度的变化如图。 的选择性
的选择性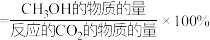
①在上述条件下合成甲醇的工业条件是_______ ;
A.210℃ B.230℃ C.催化CZT D.催化剂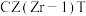
②在230℃以上,升高温度 的转化率增大,但甲醇的产率降低,原因是
的转化率增大,但甲醇的产率降低,原因是_______ ;
③若为恒温体系,达平衡时,二氧化碳、甲醇、一氧化碳的体积分数相同,反应Ⅱ的平衡常数
_______ ;
(4)2020年,我国学者利用电化学装置常温下将 高效转化为
高效转化为 ,其中隔膜为阴离子交换膜,其原理如图所示:
,其中隔膜为阴离子交换膜,其原理如图所示:_______ 。
②当有 参与反应时,阴极溶液质量的变化为
参与反应时,阴极溶液质量的变化为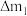 ,阳极溶液质量的变化为
,阳极溶液质量的变化为 ,则溶液质量变化绝对值之差
,则溶液质量变化绝对值之差
_______ g。
Ⅰ.
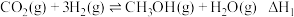
Ⅱ.
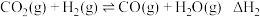
回答下列问题:
(1)298K时,
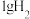 燃烧生成
燃烧生成 放热121kJ,
放热121kJ,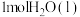 蒸发吸热44kJ表示
蒸发吸热44kJ表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)同一容器中,反应Ⅰ、Ⅱ的lnK(K为化学平衡常数)随
 的变化如图,下列说法正确的是_______;
的变化如图,下列说法正确的是_______;
A.反应Ⅲ 的活化能 的活化能 |
| B.当容器内的压强不再变化时说明两个反应均达到平衡 |
| C.当反应体系内气体的平均相对分子质量不变化时说明两个反应均达到平衡 |
| D.恒温恒容下充入氦气,反应Ⅰ的平衡向正反应方向移动 |
(3)在
 ,将
,将 和
和 按照1∶3的比例混合在密闭容器中,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内
按照1∶3的比例混合在密闭容器中,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内 的选择性和产率随温度的变化如图。
的选择性和产率随温度的变化如图。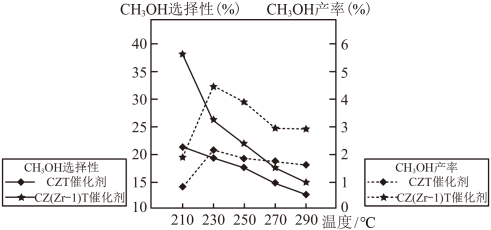
 的选择性
的选择性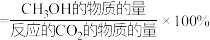
①在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.催化CZT D.催化剂
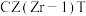
②在230℃以上,升高温度
 的转化率增大,但甲醇的产率降低,原因是
的转化率增大,但甲醇的产率降低,原因是③若为恒温体系,达平衡时,二氧化碳、甲醇、一氧化碳的体积分数相同,反应Ⅱ的平衡常数

(4)2020年,我国学者利用电化学装置常温下将
 高效转化为
高效转化为 ,其中隔膜为阴离子交换膜,其原理如图所示:
,其中隔膜为阴离子交换膜,其原理如图所示: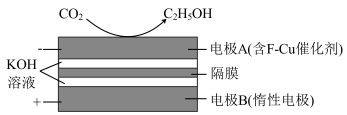
②当有
 参与反应时,阴极溶液质量的变化为
参与反应时,阴极溶液质量的变化为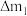 ,阳极溶液质量的变化为
,阳极溶液质量的变化为 ,则溶液质量变化绝对值之差
,则溶液质量变化绝对值之差
您最近一年使用:0次
名校
4 . 乙醇被广泛应用于能源、化工、食品等领域,工业上可用以下两种方法制备乙醇。
Ⅰ. 。一定条件下,在一密闭容器中充入
。一定条件下,在一密闭容器中充入 和
和 发生该反应,如图表示不同压强下
发生该反应,如图表示不同压强下 的平衡转化率与温度的关系。回答下列问题。
的平衡转化率与温度的关系。回答下列问题。
___________ 0(填“>”或“<”),
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)若在恒容绝热的容器中发生该反应,下列情况下反应一定达到平衡状态的是___________(填序号)。
Ⅱ.乙酸甲酯( )催化加氢制取乙醇。包括以下主要反应:
)催化加氢制取乙醇。包括以下主要反应:
①

②
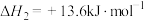
(3)已知 、
、 、
、 、
、 的燃烧热分别为
的燃烧热分别为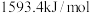 ,
,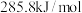 ,
,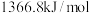 ,
,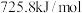 ,
,
___________ 。
(4)其他条件相同,将乙酸甲酯与氢气按一定流速通过固体催化剂表面,乙酸甲酯的转化率随氢酯比(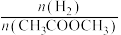 )的关系如图所示。已知固体催化剂作用下的反应速率与催化剂表面各反应物的吸附率有关。
)的关系如图所示。已知固体催化剂作用下的反应速率与催化剂表面各反应物的吸附率有关。___________ 。
(5)T℃时在1L密闭容器内通入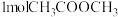 和
和 ,初始压强为100MPa,发生反应①和②,达到平衡时体系压强变成90MPa且
,初始压强为100MPa,发生反应①和②,达到平衡时体系压强变成90MPa且 的分压为
的分压为 分压的5倍,反应①的平衡常数
分压的5倍,反应①的平衡常数
___________  。
。
(6)研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,工作原理如图。___________ 。
②当向正极通入 且全部被消耗时,理论上正负极溶液质量的变化差为
且全部被消耗时,理论上正负极溶液质量的变化差为___________ g(保留两位小数)。
Ⅰ.
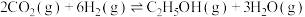 。一定条件下,在一密闭容器中充入
。一定条件下,在一密闭容器中充入 和
和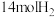 发生该反应,如图表示不同压强下
发生该反应,如图表示不同压强下 的平衡转化率与温度的关系。回答下列问题。
的平衡转化率与温度的关系。回答下列问题。


 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)若在恒容绝热的容器中发生该反应,下列情况下反应一定达到平衡状态的是___________(填序号)。
A.容器内 和 和 体积比不再改变 体积比不再改变 | B.容器内气体密度不再改变 |
| C.容器内温度不再发生改变 | D.断开 键与断开 键与断开 键的数目之比为2:3 键的数目之比为2:3 |
Ⅱ.乙酸甲酯(
 )催化加氢制取乙醇。包括以下主要反应:
)催化加氢制取乙醇。包括以下主要反应:①


②

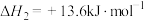
(3)已知
 、
、 、
、 、
、 的燃烧热分别为
的燃烧热分别为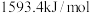 ,
,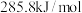 ,
,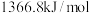 ,
,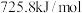 ,
,
(4)其他条件相同,将乙酸甲酯与氢气按一定流速通过固体催化剂表面,乙酸甲酯的转化率随氢酯比(
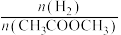 )的关系如图所示。已知固体催化剂作用下的反应速率与催化剂表面各反应物的吸附率有关。
)的关系如图所示。已知固体催化剂作用下的反应速率与催化剂表面各反应物的吸附率有关。
(5)T℃时在1L密闭容器内通入
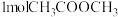 和
和 ,初始压强为100MPa,发生反应①和②,达到平衡时体系压强变成90MPa且
,初始压强为100MPa,发生反应①和②,达到平衡时体系压强变成90MPa且 的分压为
的分压为 分压的5倍,反应①的平衡常数
分压的5倍,反应①的平衡常数
 。
。(6)研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,工作原理如图。

②当向正极通入
 且全部被消耗时,理论上正负极溶液质量的变化差为
且全部被消耗时,理论上正负极溶液质量的变化差为
您最近一年使用:0次
名校
5 . 一碳化学的研究对象是分子中只含一个碳原子的化合物,如 、
、 等。
等。
(1)用 可以去除
可以去除 ,反应的机理和相对能量变化如下图所示(TS表示过渡态)。
,反应的机理和相对能量变化如下图所示(TS表示过渡态)。

最大活化能
___________  ,该反应的总反应的热化学方程式为
,该反应的总反应的热化学方程式为___________ 。
(2)一定条件下, 与
与 可发生如下反应,有利于控制温室效应,其反应方程式为:
可发生如下反应,有利于控制温室效应,其反应方程式为:
I:
Ⅱ:
在密闭容器中充入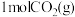 和
和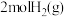 发生上述两个反应,测得
发生上述两个反应,测得 平衡转化率与温度(T)和压强(
平衡转化率与温度(T)和压强( )的关系如图。
)的关系如图。

①压强 由大到小的顺序为
由大到小的顺序为___________ 。
②温度升高, 的转化率受压强的影响越来越小的原因是
的转化率受压强的影响越来越小的原因是___________ 。
③在A点测得 的物质的量为
的物质的量为 ,则该温度下反应I的平衡常数
,则该温度下反应I的平衡常数
___________ 。(用含a的式子表示)
(3)我国科学家设计出下图所示的电池利用 (
( 为氧化还原介质)。
为氧化还原介质)。

①电势较高的一极是___________ (填“X”或“Y”)。
②负极的电极反应式为___________ 。
③当 电极减轻
电极减轻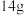 时,理论上能固定
时,理论上能固定 的质量为
的质量为___________ g。
 、
、 等。
等。(1)用
 可以去除
可以去除 ,反应的机理和相对能量变化如下图所示(TS表示过渡态)。
,反应的机理和相对能量变化如下图所示(TS表示过渡态)。
最大活化能

 ,该反应的总反应的热化学方程式为
,该反应的总反应的热化学方程式为(2)一定条件下,
 与
与 可发生如下反应,有利于控制温室效应,其反应方程式为:
可发生如下反应,有利于控制温室效应,其反应方程式为:I:

Ⅱ:

在密闭容器中充入
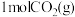 和
和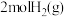 发生上述两个反应,测得
发生上述两个反应,测得 平衡转化率与温度(T)和压强(
平衡转化率与温度(T)和压强( )的关系如图。
)的关系如图。
①压强
 由大到小的顺序为
由大到小的顺序为②温度升高,
 的转化率受压强的影响越来越小的原因是
的转化率受压强的影响越来越小的原因是③在A点测得
 的物质的量为
的物质的量为 ,则该温度下反应I的平衡常数
,则该温度下反应I的平衡常数
(3)我国科学家设计出下图所示的电池利用
 (
( 为氧化还原介质)。
为氧化还原介质)。
①电势较高的一极是
②负极的电极反应式为
③当
 电极减轻
电极减轻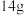 时,理论上能固定
时,理论上能固定 的质量为
的质量为
您最近一年使用:0次
名校
6 . 在“碳达峰”“碳中和”的发展背景下, 催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生下列反应:
催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生下列反应:
反应Ⅰ:

反应Ⅱ:

回答下列问题:
(1)CO和 反应生成气态甲醇的热化学方程式为
反应生成气态甲醇的热化学方程式为___________ 。
(2)将 和
和 加入密闭容器中只发生反应Ⅰ,不同催化剂a和b作用下反应速率常数k与温度的关系如图所示。已知:速率常数与温度的关系式为
加入密闭容器中只发生反应Ⅰ,不同催化剂a和b作用下反应速率常数k与温度的关系如图所示。已知:速率常数与温度的关系式为 (
( 为活化能,R为常数)。在其他条件相同时,催化效果更好的是
为活化能,R为常数)。在其他条件相同时,催化效果更好的是___________ (填“a”或“b”)。理由是___________ 。

(3)反应Ⅱ的速率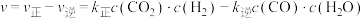 ,其中
,其中 和
和 分别为正、逆反应速率常数。升高温度时
分别为正、逆反应速率常数。升高温度时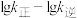
___________ (填“增大”“减小”或“不变”)
(4)保持压强为100kPa,向密闭容器中加入2mol 和6mol
和6mol ,在恒温下发生上述反应Ⅰ和Ⅱ。10s后反应达到平衡,此时容器内
,在恒温下发生上述反应Ⅰ和Ⅱ。10s后反应达到平衡,此时容器内 的物质的量为1mol,CO为0.2mol。
的物质的量为1mol,CO为0.2mol。
①前10s内的平均反应速率
___________  。
。
②已知:分压=总压×该组分物质的量分数,对于反应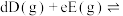

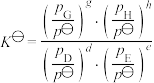 ,其中
,其中 ,
, 、
、 、
、 、
、 为各组分的平衡分压,则反应Ⅱ的
为各组分的平衡分压,则反应Ⅱ的
___________ (保留3位有效数字)。
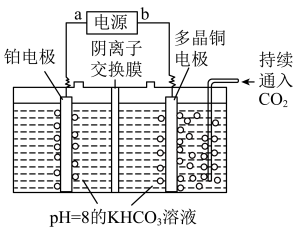
(5)如图所示的电解装置可实现低电位下高效催化 制取甲醇,持续通入
制取甲醇,持续通入 ,电解过程中阴极区
,电解过程中阴极区 物质的量基本不变。阴极的电极反应式为
物质的量基本不变。阴极的电极反应式为___________ 。
 催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生下列反应:
催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生下列反应:反应Ⅰ:


反应Ⅱ:


回答下列问题:
(1)CO和
 反应生成气态甲醇的热化学方程式为
反应生成气态甲醇的热化学方程式为(2)将
 和
和 加入密闭容器中只发生反应Ⅰ,不同催化剂a和b作用下反应速率常数k与温度的关系如图所示。已知:速率常数与温度的关系式为
加入密闭容器中只发生反应Ⅰ,不同催化剂a和b作用下反应速率常数k与温度的关系如图所示。已知:速率常数与温度的关系式为 (
( 为活化能,R为常数)。在其他条件相同时,催化效果更好的是
为活化能,R为常数)。在其他条件相同时,催化效果更好的是
(3)反应Ⅱ的速率
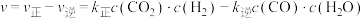 ,其中
,其中 和
和 分别为正、逆反应速率常数。升高温度时
分别为正、逆反应速率常数。升高温度时
(4)保持压强为100kPa,向密闭容器中加入2mol
 和6mol
和6mol ,在恒温下发生上述反应Ⅰ和Ⅱ。10s后反应达到平衡,此时容器内
,在恒温下发生上述反应Ⅰ和Ⅱ。10s后反应达到平衡,此时容器内 的物质的量为1mol,CO为0.2mol。
的物质的量为1mol,CO为0.2mol。①前10s内的平均反应速率

 。
。②已知:分压=总压×该组分物质的量分数,对于反应
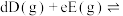

 ,其中
,其中 ,
, 、
、 、
、 、
、 为各组分的平衡分压,则反应Ⅱ的
为各组分的平衡分压,则反应Ⅱ的
(5)如图所示的电解装置可实现低电位下高效催化
 制取甲醇,持续通入
制取甲醇,持续通入 ,电解过程中阴极区
,电解过程中阴极区 物质的量基本不变。阴极的电极反应式为
物质的量基本不变。阴极的电极反应式为
您最近一年使用:0次
名校
解题方法
7 .  可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 、
、 ,
, )和黄铁矿(
)和黄铁矿( )为原料制备
)为原料制备 ,其流程如图所示。
,其流程如图所示。

已知:
回答下列问题:
(1)“酸浸”过程中,滤渣1的主要成分为 、
、______ (填化学式)。
(2)“酸浸”过程中 、
、 的质量浓度、
的质量浓度、 的浸出率与时间的关系如图所示。
的浸出率与时间的关系如图所示。

20~80min,浸出 元素的主要离子方程式为
元素的主要离子方程式为______ 。
80~100min时, 浓度上升的原因可能是
浓度上升的原因可能是______ 。
(3)“沉铁”过程中依次加入的试剂X、Y为______ (填字母)。
A.NH3•H2O、H2O2 B.H2O2、CaCO3 C.SO2、MnCO3
(4)“滤液”萃取前调 ,若有机萃取剂用
,若有机萃取剂用 表示,则发生萃取的反应可表示为
表示,则发生萃取的反应可表示为 。若
。若 ,多次萃取后水相中
,多次萃取后水相中 为1.028mol/L,则铜的萃取率为
为1.028mol/L,则铜的萃取率为______ (结果保留小数点后一位,溶液体积变化忽略不计)。
(5)利用 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。
。
①写出上述反应的离子方程式:______ 。
②随着反应温度的升高,产物 的质量分数如图所示,变化的原因是
的质量分数如图所示,变化的原因是______ 。

(6)研究者用如图装置提取 中的锰元素。图中“
中的锰元素。图中“ ”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的
”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的 先增大后减小,减小的原因可能是
先增大后减小,减小的原因可能是______ 。

 可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 、
、 ,
, )和黄铁矿(
)和黄铁矿( )为原料制备
)为原料制备 ,其流程如图所示。
,其流程如图所示。
已知:
|
|
|
| |
完全沉淀时的 | 3.7 | 9.7 | 7.4 | 9.8 |
(1)“酸浸”过程中,滤渣1的主要成分为
 、
、(2)“酸浸”过程中
 、
、 的质量浓度、
的质量浓度、 的浸出率与时间的关系如图所示。
的浸出率与时间的关系如图所示。
20~80min,浸出
 元素的主要离子方程式为
元素的主要离子方程式为80~100min时,
 浓度上升的原因可能是
浓度上升的原因可能是(3)“沉铁”过程中依次加入的试剂X、Y为
A.NH3•H2O、H2O2 B.H2O2、CaCO3 C.SO2、MnCO3
(4)“滤液”萃取前调
 ,若有机萃取剂用
,若有机萃取剂用 表示,则发生萃取的反应可表示为
表示,则发生萃取的反应可表示为 。若
。若 ,多次萃取后水相中
,多次萃取后水相中 为1.028mol/L,则铜的萃取率为
为1.028mol/L,则铜的萃取率为(5)利用
 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。
。①写出上述反应的离子方程式:
②随着反应温度的升高,产物
 的质量分数如图所示,变化的原因是
的质量分数如图所示,变化的原因是
(6)研究者用如图装置提取
 中的锰元素。图中“
中的锰元素。图中“ ”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的
”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的 先增大后减小,减小的原因可能是
先增大后减小,减小的原因可能是
您最近一年使用:0次
解题方法
8 . 原理综合题
汽车尾气中含有 、
、 、
、 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:
Ⅰ.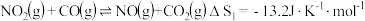
Ⅱ.
Ⅲ.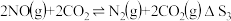
(1)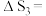
______  忽略
忽略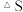 受温度的影响
受温度的影响 。
。
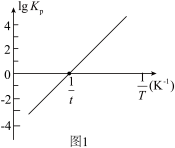
(2)反应Ⅰ的平衡常数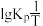 的关系如图
的关系如图 所示,则反应Ⅰ为
所示,则反应Ⅰ为______  填“吸热”或“放热”
填“吸热”或“放热” 反应。温度为
反应。温度为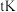 时,
时,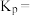
______ ,向恒容密闭容器中加入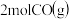 和
和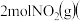 若只发生反应Ⅰ
若只发生反应Ⅰ ,测得起始压强为
,测得起始压强为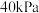 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为______ , 的平衡分压为
的平衡分压为______ 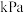 。
。
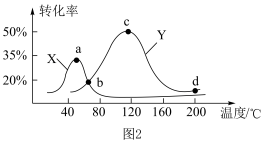
(3)将等物质的量的 和
和 分别充入盛有催化剂
分别充入盛有催化剂 和
和 的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中
的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中 的含量,从而确定
的含量,从而确定 的转化率,结果如图
的转化率,结果如图 所示。试判断图像中
所示。试判断图像中 点是否一定处于平衡状态并分析原因:
点是否一定处于平衡状态并分析原因:______ 。
(4)间接电解法可对大气污染物 进行无害化处理,工作原理如图
进行无害化处理,工作原理如图 所示,质子膜允许
所示,质子膜允许 和
和 通过。
通过。
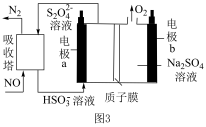
①电极 的电极反应式为
的电极反应式为______ 。
②工作时有 通过质子膜时,理论上可处理标准状况下
通过质子膜时,理论上可处理标准状况下 的体积为
的体积为______  。
。
汽车尾气中含有
 、
、 、
、 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:Ⅰ.
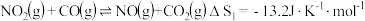
Ⅱ.

Ⅲ.
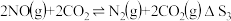
(1)
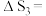
 忽略
忽略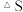 受温度的影响
受温度的影响 。
。(2)反应Ⅰ的平衡常数
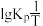 的关系如图
的关系如图 所示,则反应Ⅰ为
所示,则反应Ⅰ为 填“吸热”或“放热”
填“吸热”或“放热” 反应。温度为
反应。温度为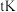 时,
时,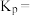
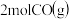 和
和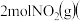 若只发生反应Ⅰ
若只发生反应Ⅰ ,测得起始压强为
,测得起始压强为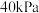 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为 的平衡分压为
的平衡分压为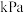 。
。
(3)将等物质的量的
 和
和 分别充入盛有催化剂
分别充入盛有催化剂 和
和 的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中
的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中 的含量,从而确定
的含量,从而确定 的转化率,结果如图
的转化率,结果如图 所示。试判断图像中
所示。试判断图像中 点是否一定处于平衡状态并分析原因:
点是否一定处于平衡状态并分析原因:
(4)间接电解法可对大气污染物
 进行无害化处理,工作原理如图
进行无害化处理,工作原理如图 所示,质子膜允许
所示,质子膜允许 和
和 通过。
通过。
①电极
 的电极反应式为
的电极反应式为②工作时有
 通过质子膜时,理论上可处理标准状况下
通过质子膜时,理论上可处理标准状况下 的体积为
的体积为 。
。
您最近一年使用:0次
2024-03-19更新
|
33次组卷
|
2卷引用:重庆市云阳盘石中学校2023-2024学年高三上学期12月月考化学试题
9 . 近日,科学家开发新型催化剂实现一氧化二氮对C4馏分中2-丁烯的气相选择性氧化,反应原理如下:
反应l:CH3CH=CHCH3(g)+N2O(g)⇌CH3CH2COCH3(g)+N2(g) △H1
反应2:CH3CH=CHCH3(g)+2N2O(g)⇌2CH3CHO(g)+2N2(g) △H2<0
(1)几种共价键的键能数据如下表所示。
共价键 | C-H | C-C | C=C | C=O | N≡N | N=O | N=N |
键能/kJ·mol-1 | 413 | 347 | 614 | 745 | 945 | 607 | 418 |
已知N2O的结构与CO2相似,可表示为N=N=O。根据键能估算:△H1=
(2)某温度下,向恒压密闭容器中充入CH3CH=CHCH3(g)和N2O(g),发生上述反应1和反应2,测得平衡体系中N2的体积分数与起始投料比[
 ]的关系如图1所示,那么在M、N、Q三点中,CH3CH=CHCH3(g)的转化率由小到大排序为
]的关系如图1所示,那么在M、N、Q三点中,CH3CH=CHCH3(g)的转化率由小到大排序为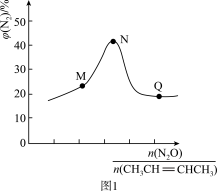
(3)已知:阿伦尼乌斯经验公式为Rlnk=-
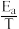 +C(R、C为常数,T为热力学温度,k为速率常数,Ea为活化能)。测得反应1在不同催化剂Cat1、Cat2作用下,Rlnk与温度的倒数关系如图2所示,以此判断催化效果较高的催化剂是
+C(R、C为常数,T为热力学温度,k为速率常数,Ea为活化能)。测得反应1在不同催化剂Cat1、Cat2作用下,Rlnk与温度的倒数关系如图2所示,以此判断催化效果较高的催化剂是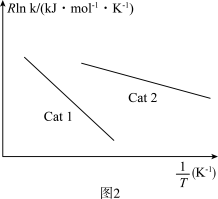
(4)在反应器中充入1mol2-丁烯和2molN2O(g),发生上述反应,测得2-丁烯的平衡转化率与温度、压强的关系如图3所示,X点时丁酮(CH3CH2COCH3)的选择性为
 。
。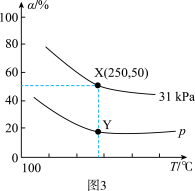
已知:[CH3CH2COCH3的选择性= ]
]
①其他条件不变,升高温度,2-丁烯的平衡转化率降低的原因是
②p
③Y点反应1的压强平衡常数Kp为
(5)以熔融碳酸盐(如K2CO3)为电解质,丁烯(C4H8/空气燃料电池的能量转化率较高。电池总反应为C4H8+6O2=4CO2+4H2O,则负极的电极方程式为
您最近一年使用:0次
名校
10 . 某小组同学研究合成氨反应及氨水的性质如下:
(1)已知:N2(g)+3H2(g)=2NH3(g) ΔH =-92.4 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ/mol
则氨气完全燃烧生成氮气和水蒸气的热化学方程式________ 。
(2)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是________ 。
a.气体的密度不再发生改变 b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化 d.反应停止,正、逆反应的速率都等于零
(3)工业合成氨的反应温度选择500℃左右的原因是_______ 。
(4)如图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是_______ (填“温度”或“压强”),判断L1、L2的大小关系:L1______ L2(填“<”或“>”)。

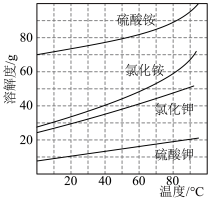
(5)在70℃-80℃时,配制饱和的(NH4)2SO4和KCl溶液后混合。经过________ 、_______ 、干燥就可以得到K2SO4晶体。
(1)已知:N2(g)+3H2(g)=2NH3(g) ΔH =-92.4 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ/mol
则氨气完全燃烧生成氮气和水蒸气的热化学方程式
(2)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是
a.气体的密度不再发生改变 b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化 d.反应停止,正、逆反应的速率都等于零
(3)工业合成氨的反应温度选择500℃左右的原因是
(4)如图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是

(5)在70℃-80℃时,配制饱和的(NH4)2SO4和KCl溶液后混合。经过

您最近一年使用:0次





