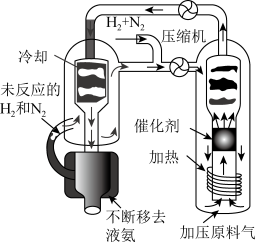
1 . (一)合成氨工艺(流程如图所示)是人工固氮最重要的途径。
2018年是合成氨工业先驱哈伯(P•Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) NH3(g)∆H(298K)=-46.2KJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g)∆H(298K)=-46.2KJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H* NH*;
NH*; ;NH2*+H*
;NH2*+H* NH3*
NH3*
脱附:NH3* NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。请回答:
(1)利于提高合成氨平衡产率的条件有__________ 。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)标准平衡常数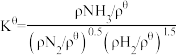 ,其中
,其中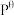 为标准压强(1X105Pa),pNH3、pN2和pH2为各组分的平衡分压,如pNH3=xNH3p,p为平衡总压,xNH3为平衡系统中NH3的物质的量分数。
为标准压强(1X105Pa),pNH3、pN2和pH2为各组分的平衡分压,如pNH3=xNH3p,p为平衡总压,xNH3为平衡系统中NH3的物质的量分数。
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则 =
=_____________ (用含w的最简式表示)
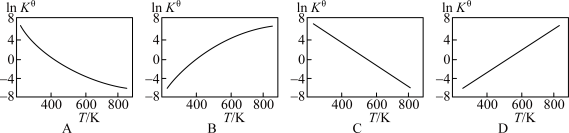
②下图中可以示意标准平衡常数 随温度T变化趋势的是
随温度T变化趋势的是_______ 。
(3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由________________________ 。
②关于合成氨工艺的下列理解,正确的是_______ 。
A.合成氨反应在不同温度下的∆H和∆S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(二)高铁酸钾(K2FeO4)可用作水处理剂。某同学通过“化学-电解法”探究的合成,其原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。
(1)请写出“化学法”得到FeO42-的离子方程式___________________________ 。
(2)请写出阳极的电极反应式(含FeO42-)___________________________________ 。
2018年是合成氨工业先驱哈伯(P•Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g)
 NH3(g)∆H(298K)=-46.2KJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g)∆H(298K)=-46.2KJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H*
 NH*;
NH*; ;NH2*+H*
;NH2*+H* NH3*
NH3*脱附:NH3*
 NH3(g)
NH3(g)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。请回答:
(1)利于提高合成氨平衡产率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)标准平衡常数
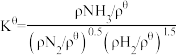 ,其中
,其中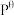 为标准压强(1X105Pa),pNH3、pN2和pH2为各组分的平衡分压,如pNH3=xNH3p,p为平衡总压,xNH3为平衡系统中NH3的物质的量分数。
为标准压强(1X105Pa),pNH3、pN2和pH2为各组分的平衡分压,如pNH3=xNH3p,p为平衡总压,xNH3为平衡系统中NH3的物质的量分数。①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则
 =
=②下图中可以示意标准平衡常数
 随温度T变化趋势的是
随温度T变化趋势的是
(3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由
②关于合成氨工艺的下列理解,正确的是
A.合成氨反应在不同温度下的∆H和∆S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(二)高铁酸钾(K2FeO4)可用作水处理剂。某同学通过“化学-电解法”探究的合成,其原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。

(1)请写出“化学法”得到FeO42-的离子方程式
(2)请写出阳极的电极反应式(含FeO42-)
您最近一年使用:0次
2018-11-07更新
|
4878次组卷
|
5卷引用:辽宁省沈阳市东北育才学校2019届高三上学期第三次模拟化学试题
名校
2 . 钒元素用途广泛,如图是一种钒的化合物催化某反应的反应机理。下列叙述错误的是
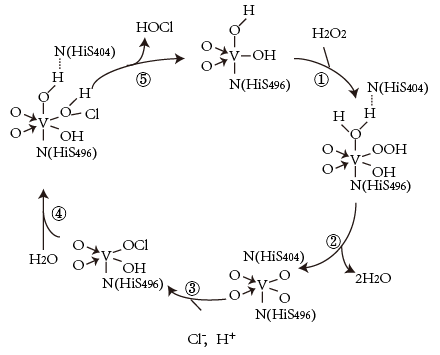

| A.H2O参与了该催化反应 |
| B.过程①中反应的原子利用率为100% |
| C.该催化循环过程中有氢氧键的断裂和形成 |
| D.每次循环的净反应为H2O2+2C1-=2HOCl+2e- |
您最近一年使用:0次
2021-04-24更新
|
1619次组卷
|
16卷引用:2022年辽宁省高考真题变式题(16-19)
(已下线)2022年辽宁省高考真题变式题(16-19)(已下线)2022年辽宁高考真题化学试题变式题(选择题6-10)安徽省皖南八校2021届高三4月第三次联考理综化学试题(已下线)押山东卷第13题 陌生反应机理选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)2021年高考化学押题预测卷(山东卷)03(含考试版、答题卡、参考答案、全解全析)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2022年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷B(已下线)考点01 物质的组成、分类及转化-备战2022年高考化学学霸纠错(全国通用)新疆石河子第一中学2021-2022学年高三上学期8月月考(A卷)化学试题(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)江西省宜春市上高二中2021-2022学年高三下学期第十次月考(5月)理综化学试题(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)考点01 物质的分类和转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省南昌十九中2023-2024学年高三上学期第一次月考化学试卷
解题方法
3 . 近年来,我国大力加强温室气体 氢化合成甲醇技术的工业化量产研究,实现可持续发展。在合适的催化剂作用下,二氧化碳可催化加氢制甲醇。
氢化合成甲醇技术的工业化量产研究,实现可持续发展。在合适的催化剂作用下,二氧化碳可催化加氢制甲醇。
(1)已知:①


②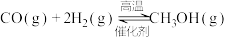


则反应③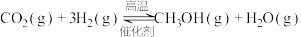

_______  。
。
(2)若将物质的量之比为1∶3的 (g)和
(g)和 (g)充入容积为1.0 L的恒容密闭容器中发生反应③,不同压强下
(g)充入容积为1.0 L的恒容密闭容器中发生反应③,不同压强下 转化率随温度的变化关系如图所示。
转化率随温度的变化关系如图所示。
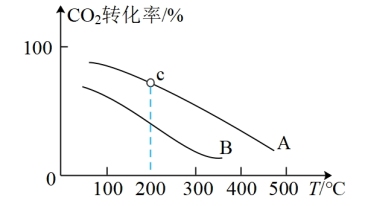
a.A、B两条曲线的压强分别为 、
、 ,则
,则
_______ (填“>”、“<”或“=”) ;
;
b.在曲线A的条件下,起始充入 (g)和
(g)和 (g)的物质的量分别为1 mol、3 mol,且c点时K=300,则c点对应
(g)的物质的量分别为1 mol、3 mol,且c点时K=300,则c点对应 转化率为
转化率为_______ 。
(3)在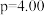 MPa、原料气
MPa、原料气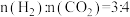 、合适催化剂的条件下发生反应,温度对
、合适催化剂的条件下发生反应,温度对 转化率、
转化率、 产率、
产率、 选择性的影响如图所示。已知:
选择性的影响如图所示。已知: 选择性
选择性 。
。

a. 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是_______ ;
b. 选择性随温度升高而减小的原因可能是
选择性随温度升高而减小的原因可能是_______ ;
c.写出240℃时反应①的平衡常数的表达式:_______ 。
(4)除调控合适的温度外,使 选择性增大的方法有
选择性增大的方法有_______ 。
 氢化合成甲醇技术的工业化量产研究,实现可持续发展。在合适的催化剂作用下,二氧化碳可催化加氢制甲醇。
氢化合成甲醇技术的工业化量产研究,实现可持续发展。在合适的催化剂作用下,二氧化碳可催化加氢制甲醇。(1)已知:①



②
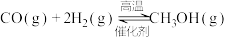


则反应③
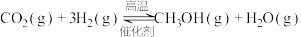

 。
。(2)若将物质的量之比为1∶3的
 (g)和
(g)和 (g)充入容积为1.0 L的恒容密闭容器中发生反应③,不同压强下
(g)充入容积为1.0 L的恒容密闭容器中发生反应③,不同压强下 转化率随温度的变化关系如图所示。
转化率随温度的变化关系如图所示。
a.A、B两条曲线的压强分别为
 、
、 ,则
,则
 ;
;b.在曲线A的条件下,起始充入
 (g)和
(g)和 (g)的物质的量分别为1 mol、3 mol,且c点时K=300,则c点对应
(g)的物质的量分别为1 mol、3 mol,且c点时K=300,则c点对应 转化率为
转化率为(3)在
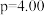 MPa、原料气
MPa、原料气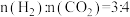 、合适催化剂的条件下发生反应,温度对
、合适催化剂的条件下发生反应,温度对 转化率、
转化率、 产率、
产率、 选择性的影响如图所示。已知:
选择性的影响如图所示。已知: 选择性
选择性 。
。
a.
 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是b.
 选择性随温度升高而减小的原因可能是
选择性随温度升高而减小的原因可能是c.写出240℃时反应①的平衡常数的表达式:
(4)除调控合适的温度外,使
 选择性增大的方法有
选择性增大的方法有
您最近一年使用:0次
2022-05-21更新
|
492次组卷
|
3卷引用:辽宁省县级重点高中协作体2022届高三模拟考试化学试题
名校
解题方法
4 . 有关工业合成氨的说法错误 的是
| A.不断移去液氨,有利于反应正向进行 | B.400~500℃时,原料的平衡转化率最大 |
| C.增大压强,氨的分解速率增加 | D.原料气须经过净化处理,以防止催化剂中毒 |
您最近一年使用:0次
2023-04-05更新
|
473次组卷
|
4卷引用:辽宁省凤城市第一中学2023-2024学年高二上学期10月月考化学试题
2022·辽宁·模拟预测
名校
5 . 科学家研究N2在催化剂表面与水能生成NH3:2N2(g)+6H2O(l) 4NH3(g)+3O2(g),下表是同一时间段(2h)NH3生成量与温度的关系,下列说法正确的是
4NH3(g)+3O2(g),下表是同一时间段(2h)NH3生成量与温度的关系,下列说法正确的是
 4NH3(g)+3O2(g),下表是同一时间段(2h)NH3生成量与温度的关系,下列说法正确的是
4NH3(g)+3O2(g),下表是同一时间段(2h)NH3生成量与温度的关系,下列说法正确的是 | T/K | 313 | 323 | 333 | 383 |
| NH3生成量/(mol) | 4.5 | 5.2 | 6.0 | 2.0 |
| A.该反应为吸热反应 |
| B.可通过适当增大压强来提高该反应速率 |
| C.323K时,该反应已经达到平衡状态 |
| D.333K时,该反应的平均反应速率为v(NH3)=6.0mol•h-1 |
您最近一年使用:0次
6 .  重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
主反应:

副反应:
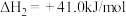
回答下列问题:
(1)已知 、
、 和
和 的燃烧热
的燃烧热 分别为
分别为 、
、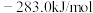 和
和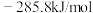 ,该催化重整主反应的
,该催化重整主反应的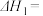
___________  。有利于提高
。有利于提高 平衡转化率的条件是
平衡转化率的条件是___________ (填标号)。
A. 高温高压 B. 高温低压 C. 低温高压 D. 低温低压
(2)在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。
分别等于1.0、1.5、2.0,且反应达到平衡状态。
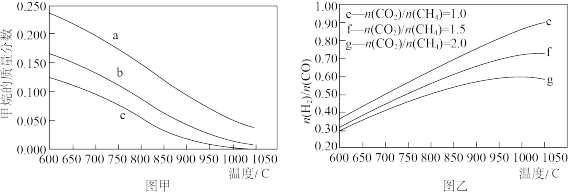
①甲烷的质量分数随温度变化的关系如图甲所示,曲线 对应的
对应的
___________ ;
②反应体系中,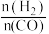 随温度变化的关系如图乙所示,随着进料比
随温度变化的关系如图乙所示,随着进料比 的增加,
的增加,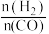 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
(3)在 、
、 时,按投料比
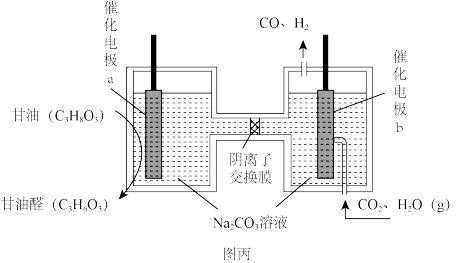
时,按投料比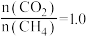 加入刚性密闭容器中,达平衡时甲烷的转化率为
加入刚性密闭容器中,达平衡时甲烷的转化率为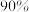 ,二氧化碳的转化率为
,二氧化碳的转化率为 ,则副反应的压强平衡常数
,则副反应的压强平衡常数
___________ (计算结果保留3位有效数字)。
(4)我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气 和
和 ,同时获得甘油醛。则催化电极
,同时获得甘油醛。则催化电极 为
为___________ 极,催化电极 产生
产生 的电极反应式为
的电极反应式为___________ 。
 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。主反应:


副反应:

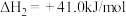
回答下列问题:
(1)已知
 、
、 和
和 的燃烧热
的燃烧热 分别为
分别为 、
、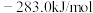 和
和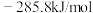 ,该催化重整主反应的
,该催化重整主反应的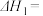
 。有利于提高
。有利于提高 平衡转化率的条件是
平衡转化率的条件是A. 高温高压 B. 高温低压 C. 低温高压 D. 低温低压
(2)在刚性密闭容器中,进料比
 分别等于1.0、1.5、2.0,且反应达到平衡状态。
分别等于1.0、1.5、2.0,且反应达到平衡状态。
①甲烷的质量分数随温度变化的关系如图甲所示,曲线
 对应的
对应的
②反应体系中,
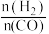 随温度变化的关系如图乙所示,随着进料比
随温度变化的关系如图乙所示,随着进料比 的增加,
的增加,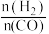 的值
的值(3)在
 、
、 时,按投料比
时,按投料比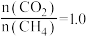 加入刚性密闭容器中,达平衡时甲烷的转化率为
加入刚性密闭容器中,达平衡时甲烷的转化率为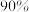 ,二氧化碳的转化率为
,二氧化碳的转化率为 ,则副反应的压强平衡常数
,则副反应的压强平衡常数
(4)我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气
 和
和 ,同时获得甘油醛。则催化电极
,同时获得甘油醛。则催化电极 为
为 产生
产生 的电极反应式为
的电极反应式为
您最近一年使用:0次
2021-04-24更新
|
857次组卷
|
6卷引用:辽宁省葫芦岛市2022届高三一模化学试题
名校
解题方法
7 . 化学反应的调控对于工业生产具有积极意义,下列关于调控措施的说法错误的是
| A.硫酸工业中,在高温高压、催化剂作用下,可提高生产效益 |
B.硫酸工业中,为提高 的转化率,可通入稍过量的空气 的转化率,可通入稍过量的空气 |
C.工业合成氨,考虑催化剂的活性,选择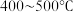 的反应温度 的反应温度 |
| D.工业合成氨,迅速冷却、液化氨气是为了使化学平衡向生成氨气的方向移动 |
您最近一年使用:0次
2022-10-13更新
|
336次组卷
|
2卷引用:辽宁省协作校2022-2023学年高二上学期第一次考试化学试题
8 . CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的电子式为________ 。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_______ 。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为_____ ,通入b气体的电极反应式________ (质子交换膜只允许H+通过)。
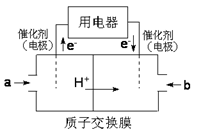
(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在_____ 左右。
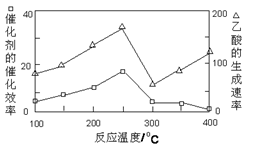
②CH4与CO2可直接转化成乙酸的原子利用率为_____ 。
(5)碳正离子(例如: 、
、 、(CH3)3C+等)是有机反应中间体,
、(CH3)3C+等)是有机反应中间体, 碳正离子是由CH4在“超强酸”中获得一个H+而得到,而
碳正离子是由CH4在“超强酸”中获得一个H+而得到,而 失去H2可得
失去H2可得 。(CH3)3C+去掉H+后生成电中性有机分子,该分子的结构简式为
。(CH3)3C+去掉H+后生成电中性有机分子,该分子的结构简式为________ 。
(6)CH4与Cl2在光照条件下可发生反应。
①实验室中用如图所示的装置进行实验。
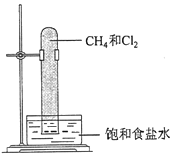
在光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是______
A.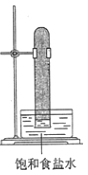 B.
B. 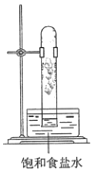 C.
C.  D.
D. 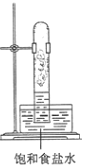
②CH4与Cl2生成CH3Cl的反应过程,中间态物质的能量关系见图。有关说法不正确的是_____ (填序号)
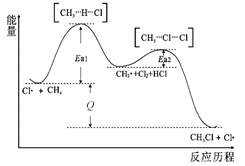
A.Cl·是Cl2在光照下化学键断裂生成的,该过程可表示为:
B.反应过程一定无CH3CH3生成
C.图示过程放出热量
D.CH4转化为CH3Cl,C-H键发生了断裂
(1)甲烷的电子式为
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为

(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在

②CH4与CO2可直接转化成乙酸的原子利用率为
(5)碳正离子(例如:
 、
、 、(CH3)3C+等)是有机反应中间体,
、(CH3)3C+等)是有机反应中间体, 碳正离子是由CH4在“超强酸”中获得一个H+而得到,而
碳正离子是由CH4在“超强酸”中获得一个H+而得到,而 失去H2可得
失去H2可得 。(CH3)3C+去掉H+后生成电中性有机分子,该分子的结构简式为
。(CH3)3C+去掉H+后生成电中性有机分子,该分子的结构简式为(6)CH4与Cl2在光照条件下可发生反应。
①实验室中用如图所示的装置进行实验。

在光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是
A.
 B.
B.  C.
C.  D.
D. 
②CH4与Cl2生成CH3Cl的反应过程,中间态物质的能量关系见图。有关说法不正确的是

A.Cl·是Cl2在光照下化学键断裂生成的,该过程可表示为:

B.反应过程一定无CH3CH3生成
C.图示过程放出热量
D.CH4转化为CH3Cl,C-H键发生了断裂
您最近一年使用:0次
2020-08-12更新
|
1236次组卷
|
4卷引用:辽宁省东北育才学校2019-2020学年高一下学期期末考试化学试题
9 . 央视报道《王者归“铼”》:我国利用新技术发现并提纯了超级金属“铼”,其熔点高、耐磨、耐腐蚀,可用来制造航空发动机核心部件,有塑打破美国垄断。工业上用富铼渣(含 )制得铼粉,其工艺流程如图1所示:
)制得铼粉,其工艺流程如图1所示:
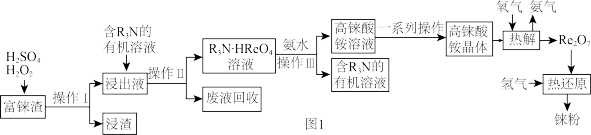
回答下列问题:
(1)铼( )被称为类锰元素,与锰的价层电子结构相同,写出
)被称为类锰元素,与锰的价层电子结构相同,写出 的价层电子排布式:
的价层电子排布式:_______ ,已知元素锰与徕为同族元素,研究发现锰的熔点明显高于铼的熔点,其原因可能是_______ 。
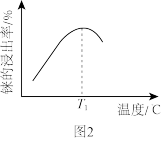
(2)酸浸相同时间,测得徕的浸出率与温度关系如图2所示,分析 时铼的浸出率最高的原因是
时铼的浸出率最高的原因是_______ ;浸出反应中 转化为两种强酸,请写出铼浸出反应的离子方程式
转化为两种强酸,请写出铼浸出反应的离子方程式_______ 。
(3)图3表示萃取液流速与铼吸附率关系。结合实际工业生产效益,萃取液流速宜选用的范围是_______  。
。

(4)已知高铼酸铵微溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是_______ 。
(5) 是酸性氧化物,与
是酸性氧化物,与 溶液反应的化学方程式为
溶液反应的化学方程式为_______ 。
(6)整个工艺流程中可循环利用的物质有 、
、_______ 。
 )制得铼粉,其工艺流程如图1所示:
)制得铼粉,其工艺流程如图1所示:
回答下列问题:
(1)铼(
 )被称为类锰元素,与锰的价层电子结构相同,写出
)被称为类锰元素,与锰的价层电子结构相同,写出 的价层电子排布式:
的价层电子排布式:(2)酸浸相同时间,测得徕的浸出率与温度关系如图2所示,分析
 时铼的浸出率最高的原因是
时铼的浸出率最高的原因是 转化为两种强酸,请写出铼浸出反应的离子方程式
转化为两种强酸,请写出铼浸出反应的离子方程式
(3)图3表示萃取液流速与铼吸附率关系。结合实际工业生产效益,萃取液流速宜选用的范围是
 。
。
(4)已知高铼酸铵微溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是
(5)
 是酸性氧化物,与
是酸性氧化物,与 溶液反应的化学方程式为
溶液反应的化学方程式为(6)整个工艺流程中可循环利用的物质有
 、
、
您最近一年使用:0次
2022-05-25更新
|
377次组卷
|
2卷引用:辽宁省辽南协作体2022届高三第三次模拟考试化学试题
名校
10 . 苯乙烯与溴苯在一定条件下发生Heck反应:

根据上表数据,下列说法正确的是

溴苯用量(mmol) | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
催化剂用量(mmol) | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
反应温度(℃) | 100 | 100 | 100 | 100 | 120 | 140 | 160 |
反应时间(h) | 10 | 12 | 14 | 16 | 14 | 14 | 14 |
产率(%) | 81.2 | 84.4 | 86.6 | 86.2 | 93.5 | 96.6 | 89.0 |
| A.最佳反应温度为100 ℃ | B.最佳反应时间为16h |
| C.温度过高时催化剂活性可能降低 | D.反应产物是顺式结构 |
您最近一年使用:0次
2021-01-25更新
|
1124次组卷
|
6卷引用:辽宁省2021年普通高中学业水平选择考适应性测试化学试题
辽宁省2021年普通高中学业水平选择考适应性测试化学试题(已下线)难点4 化学反应速率与化学平衡图表分析-2021年高考化学【热点·重点·难点】专练(新高考)湖北省武汉市蔡甸区汉阳一中2020-2021学年高一下学期5月月考化学试题(已下线)专题七 化学反应速率与化学平衡 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)黑龙江省哈尔滨师范大学青冈实验中学校2023-2024学年高三上学期12月份考试化学试题



