1 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:

已知:最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)水浸渣中主要有SiO2和___________ 。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________ 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________ ;pH>9时,会导致___________ 。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________ 。

已知:最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有SiO2和
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
2023-06-10更新
|
18935次组卷
|
18卷引用:2023年高考新课标理综化学真题
2023年高考新课标理综化学真题(已下线)T26-工业流程题(已下线)2023年高考化学真题完全解读(新课标卷:适用安徽、云南、山西、吉林、黑龙江五省)(PPT+Word)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省滨州市2023-2024学年高三上学期11月期中考试化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
真题
解题方法
2 . 某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应: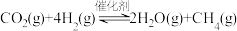
回答问题:
(1)已知:电解液态水制备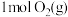 ,电解反应的
,电解反应的 。由此计算
。由此计算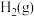 的燃烧热(焓)
的燃烧热(焓)
_______  。
。
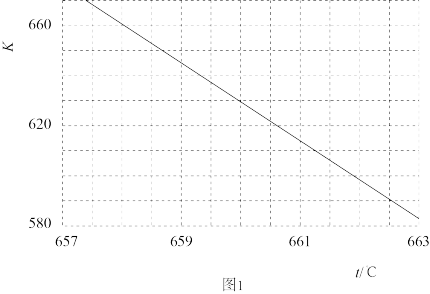
(2)已知: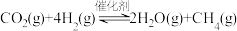 的平衡常数(K)与反应温度(t)之间的关系如图1所示。
的平衡常数(K)与反应温度(t)之间的关系如图1所示。
①若反应为基元反应,且反应的 与活化能(Ea)的关系为
与活化能(Ea)的关系为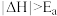 。补充完成该反应过程的能量变化示意图(图2)
。补充完成该反应过程的能量变化示意图(图2)_______ 。
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入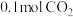 和
和 ,反应平衡后测得容器中
,反应平衡后测得容器中 。则
。则 的转化率为
的转化率为_______ ,反应温度t约为_______ ℃。
(3)在相同条件下, 与
与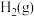 还会发生不利于氧循环的副反应:
还会发生不利于氧循环的副反应: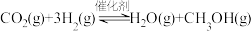 ,在反应器中按
,在反应器中按 通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中
通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中 、
、 浓度(
浓度(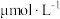 )如下表所示。
)如下表所示。
在选择使用催化剂Ⅰ和350℃条件下反应,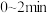 生成
生成 的平均反应速率为
的平均反应速率为_______ 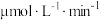 ;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是_______ 。
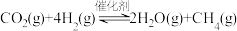
回答问题:
(1)已知:电解液态水制备
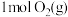 ,电解反应的
,电解反应的 。由此计算
。由此计算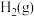 的燃烧热(焓)
的燃烧热(焓)
 。
。(2)已知:
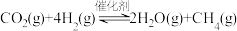 的平衡常数(K)与反应温度(t)之间的关系如图1所示。
的平衡常数(K)与反应温度(t)之间的关系如图1所示。
①若反应为基元反应,且反应的
 与活化能(Ea)的关系为
与活化能(Ea)的关系为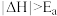 。补充完成该反应过程的能量变化示意图(图2)
。补充完成该反应过程的能量变化示意图(图2)
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入
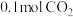 和
和 ,反应平衡后测得容器中
,反应平衡后测得容器中 。则
。则 的转化率为
的转化率为(3)在相同条件下,
 与
与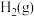 还会发生不利于氧循环的副反应:
还会发生不利于氧循环的副反应: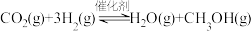 ,在反应器中按
,在反应器中按 通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中
通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中 、
、 浓度(
浓度(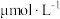 )如下表所示。
)如下表所示。| 催化剂 | t=350℃ | t=400℃ | ||
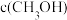 |  | 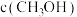 | 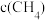 | |
| 催化剂Ⅰ | 10.8 | 12722 | 345.2 | 42780 |
| 催化剂Ⅱ | 9.2 | 10775 | 34 | 38932 |
 生成
生成 的平均反应速率为
的平均反应速率为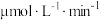 ;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是
您最近一年使用:0次
2022-07-04更新
|
8035次组卷
|
10卷引用:2022年海南省高考真题化学试题
2022年海南省高考真题化学试题(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)2022年海南省高考真题变式题15-19(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十二 原理应用中的新概念(已下线)第一部分 二轮专题突破 大题突破1 化学反应原理综合题题型研究(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)章末检测卷(二) 化学反应速率与化学平衡
2022·河北·高考真题
3 . 恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为① ;②
;② 。反应①的速率
。反应①的速率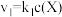 ,反应②的速率
,反应②的速率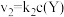 ,式中
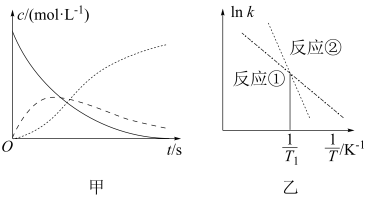
,式中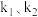 为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的
为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的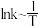 曲线。下列说法错误的是
曲线。下列说法错误的是
 ;②
;② 。反应①的速率
。反应①的速率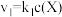 ,反应②的速率
,反应②的速率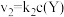 ,式中
,式中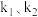 为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的
为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的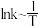 曲线。下列说法错误的是
曲线。下列说法错误的是
A.随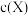 的减小,反应①、②的速率均降低 的减小,反应①、②的速率均降低 |
B.体系中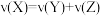 |
| C.欲提高Y的产率,需提高反应温度且控制反应时间 |
D.温度低于 时,总反应速率由反应②决定 时,总反应速率由反应②决定 |
您最近一年使用:0次
2022-07-01更新
|
8753次组卷
|
21卷引用:2022年新高考河北省高考真题化学试题(部分试题)
(已下线)2022年新高考河北省高考真题化学试题(部分试题)2022年河北省高考真题化学试题(已下线)专题09 化学反应速率、化学平衡-2022年高考真题模拟题分项汇编(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第18讲 化学反应速率(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题七 化学反应速率与平衡(已下线)2022年河北省高考真题变式题(10-13)(已下线)专题09 化学反应速率与化学平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)素养卷04 化学反应速率与平衡图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点08 聚焦热、速率、平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)考点21 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点1 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型04 化学反应速率与平衡图像分析-2024年高考化学答题技巧与模板构建山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题河北省衡水阳光中学2022-2023学年高二上学期第一次阶段考试化学试题山东省临沂市郯城第一中学2022-2023学年高二上学期期末线上考试化学试题第二章 化学反应速率与化学平衡 第一节 化学反应速率 第1课时 化学反应速率(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
真题
解题方法
4 . 工业上以氟磷灰石[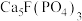 ,含
,含 等杂质]为原料生产磷酸和石膏,工艺流程如下:
等杂质]为原料生产磷酸和石膏,工艺流程如下:
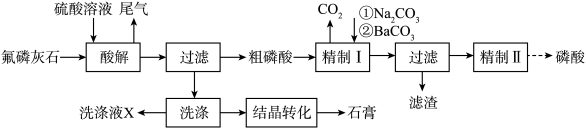
回答下列问题:
(1)酸解时有 产生。氢氟酸与
产生。氢氟酸与 反应生成二元强酸
反应生成二元强酸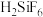 ,离子方程式为
,离子方程式为_______ 。
(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,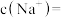
_______  ;再分批加入一定量的
;再分批加入一定量的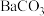 ,首先转化为沉淀的离子是
,首先转化为沉淀的离子是_______ 。
(3) 浓度(以
浓度(以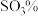 计)在一定范围时,石膏存在形式与温度、
计)在一定范围时,石膏存在形式与温度、 浓度(以
浓度(以 计)的关系如图甲所示。酸解后,在所得
计)的关系如图甲所示。酸解后,在所得 、
、 为45的混合体系中,石膏存在形式为
为45的混合体系中,石膏存在形式为_______ (填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是_______ ,回收利用洗涤液X的操作单元是_______ ;一定温度下,石膏存在形式与溶液中 和
和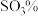 的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是_______ (填标号)。
A. 、
、 、
、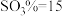 B.
B. 、
、 、
、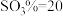
C.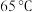 、
、 、
、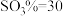 D.
D. 、
、 、
、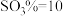
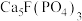 ,含
,含 等杂质]为原料生产磷酸和石膏,工艺流程如下:
等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)酸解时有
 产生。氢氟酸与
产生。氢氟酸与 反应生成二元强酸
反应生成二元强酸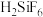 ,离子方程式为
,离子方程式为(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比
 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,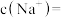
 ;再分批加入一定量的
;再分批加入一定量的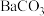 ,首先转化为沉淀的离子是
,首先转化为沉淀的离子是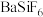 | 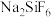 |  | 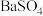 | |
 |  |  |  | 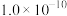 |
 浓度(以
浓度(以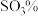 计)在一定范围时,石膏存在形式与温度、
计)在一定范围时,石膏存在形式与温度、 浓度(以
浓度(以 计)的关系如图甲所示。酸解后,在所得
计)的关系如图甲所示。酸解后,在所得 、
、 为45的混合体系中,石膏存在形式为
为45的混合体系中,石膏存在形式为 和
和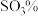 的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
A.
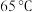 、
、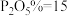 、
、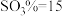 B.
B. 、
、 、
、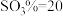
C.
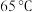 、
、 、
、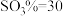 D.
D. 、
、 、
、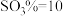
您最近一年使用:0次
2022-06-23更新
|
12033次组卷
|
9卷引用:2022年新高考山东化学高考真题
2022年新高考山东化学高考真题(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编(已下线)2022年山东省高考真题变式题(非选择题)(已下线)易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题河北省部分学校2022-2023学年高三上学期10月期中考试化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
5 . NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择性[
 100%]与温度的关系如图所示。
100%]与温度的关系如图所示。

 100%]与温度的关系如图所示。
100%]与温度的关系如图所示。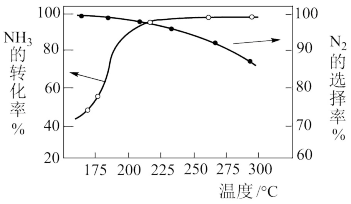
| A.其他条件不变,升高温度,NH3的平衡转化率增大 |
| B.其他条件不变,在175~300 ℃范围,随温度的升高,出口处N2和氮氧化物的量均不断增大 |
| C.催化氧化除去尾气中的NH3应选择反应温度高于250 ℃ |
| D.高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂 |
您最近一年使用:0次
2021-11-18更新
|
8395次组卷
|
21卷引用:2021年新高考江苏化学高考真题
2021年新高考江苏化学高考真题江苏省镇江市2021-2022学年高三上学期期中考试化学试题(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)(已下线)押江苏卷第14题 反应机理、化学反应速率与平衡 -备战2022年高考化学临考题号押题(江苏卷)湖南省郴州市第一中学2022届高三下学期期中考试化学试题北京市西城区第一六一中学2022届高三考前热身测试化学试题北京市和平街第一中学2021-2022学年高三下学期保温化学试题江苏省平潮高级中学等五校联盟2022届高三高考临门一脚化学试题(已下线)微专题30 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2023年高考化学一轮复习考点微专题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)微专题38 新情景下的综合图象与突破-备战2023年高考化学一轮复习考点微专题(已下线)易错点11 氮元素及其化合物-备战2023年高考化学考试易错题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)第28讲化化学平衡的移动及反应进行的方向(已下线)题型12 化学平衡图表分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)江苏省江阴长泾中学2021-2022学年高二下学期3月份阶段性检测学试题广东省深圳市红岭中学2022-2023学年高二上学期期中考试化学试题湖南省株洲市第四中学2022-2023学年高二上学期期中考试化学试题2024新东方高一上期末考化学01
6 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
(1)则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为________ 。
(2)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:
①CO2(g)=CO2(aq)
②CO2(aq)+H2O(l)=H+(aq)+HCO (aq)
(aq)
25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1,当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为________ mol•L-1(写出表达式,考虑水的电离,忽略HCO 的电离)
的电离)
(3)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s)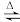 M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。
M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。
保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于________ kPa。
(4)我国科学家研究Li—CO2电池,取得了重大科研成果,回答下列问题:
①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在___ (填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2O Ⅱ.C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ.__________ Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
Ⅰ.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_________ 。
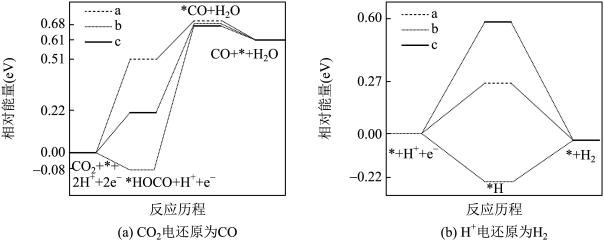
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图.由此判断,CO2电还原为CO从易到难的顺序为_______ (用a、b、c字母排序)。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃烧热△H(kJ•mol-1) | -285.8 | -393.5 | -3267.5 |
(2)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:
①CO2(g)=CO2(aq)
②CO2(aq)+H2O(l)=H+(aq)+HCO
 (aq)
(aq)25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1,当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为
 的电离)
的电离)(3)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s)
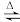 M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。
M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于
(4)我国科学家研究Li—CO2电池,取得了重大科研成果,回答下列问题:
①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在
Ⅰ.2CO2+2e-=C2O
 Ⅱ.C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ.
 +2Li+=Li2CO3
+2Li+=Li2CO3②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
Ⅰ.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图.由此判断,CO2电还原为CO从易到难的顺序为

您最近一年使用:0次
2021-06-09更新
|
10517次组卷
|
12卷引用:2021年新高考河北化学高考真题
2021年新高考河北化学高考真题(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)2021年河北省高考化学试卷变式题10-18题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷17题 化学反应原理综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题17 原理综合题(已下线)专题17 原理综合题福建省龙岩第一中学2021-2022学年高二上学期第二次月考化学试题(实验班)
7 . CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。
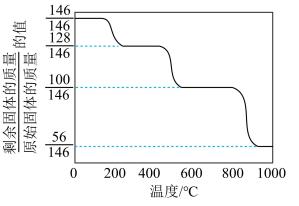
①写出400~600 ℃范围内分解反应的化学方程式:________ 。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________ 。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO−的电极反应式:________ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________ 。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
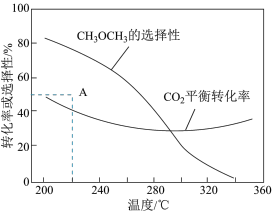
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:
CH3OCH3的选择性=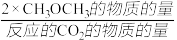 ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________ 。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________ 。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。

①写出400~600 ℃范围内分解反应的化学方程式:
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO−的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
CO(g)+H2O(g) ΔH =41.2 kJ·mol−1反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=
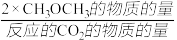 ×100%
×100%①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
您最近一年使用:0次
2019-06-10更新
|
6307次组卷
|
7卷引用:2019年江苏省高考化学试题
2019年江苏省高考化学试题北京市朝阳区第八十中学2020届高三模拟化学试题湖北省石首一中2020-2021学年高三上学期11月月考化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)原理综合题鲁科版(2019)选择性必修1 模块复习备考攻略人教版(2019)高二选择性必修第一册 模块复习备考攻略
8 . N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH− 2
2 +H2O
+H2O
2NO2+2OH−
 +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和 ,其离子方程式为
,其离子方程式为________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________ 。

(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH−
 2
2 +H2O
+H2O2NO2+2OH−

 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。①在酸性NaClO溶液中,HClO氧化NO生成Cl−和
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是

您最近一年使用:0次
2019-06-10更新
|
7456次组卷
|
32卷引用:2019年江苏省高考化学试题
2019年江苏省高考化学试题湖南省长沙市第一中学2020届高三第一次月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——氮及其氧化物的性质(提升练)专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升第2章 化学键化学反应规律 模拟高考——C挑战区 夯实基础(鲁科版(2019)第二册)第2章 化学键 化学反应与能量 模拟高考——C挑战区 夯实基础(鲁科版必修2)江苏省苏州新草桥中学2020届高三上学期10月月考化学试题(已下线)2020年高考化学押题预测卷01(新课标Ⅰ卷)--《2020年高考押题预测卷》(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升江苏省启东中学2021届高三上学期期初考试化学试题(已下线)第12讲 氮及其化合物(练) — 2022年高考化学一轮复习讲练测(新教材新高考)海南省海南枫叶国际学校2021-2022学年高三上学期第三次月考(1月)化学试题(已下线)专题17 原理综合题(已下线)常见无机物的性质2019-2020学年新人教版必修2第5章第2节《氮及其化合物》作业专题4 化学科学与人类文明——C挑战区 模拟高考(苏教版必修2)江苏省扬州市江都区大桥高级中学2019-2020学年高二下学期期中考试化学试题鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关专题7 第三单元综合拔高练-高中化学必修第二册苏教版2019人教版2019必修第二册 第五章 第二~三节综合拔高练江苏省苏州市工业园区星海实验中学高一下学期3月月考化学试题(已下线)【苏州新东方】04 吴县中学重庆市凤鸣山中学2020-2021学年高一下学期期中考试化学试题湖北省广水市普通中学2020-2021学年高一下学期5月月考化学试题广东省潮州市饶平县第二中学2021-2022学年高一下学期月考(一)化学试题黑龙江省大庆市第四中学2018-2019学年高二下学期第三次月考化学试题江苏省镇江市句容市南京人民中学等三市四校联考2022-2023学年高一下学期4月月考化学试题湖北省黄石市第二中学2023-2024学年高二上学期第三次统测化学试题江苏省常州市联盟校2023-2024学年高一下学期3月阶段调研化学试题江苏省南京市金陵中学2023-2024学年高一下学期3月月考化学试题
9 . 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________ H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________ (填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
标注。
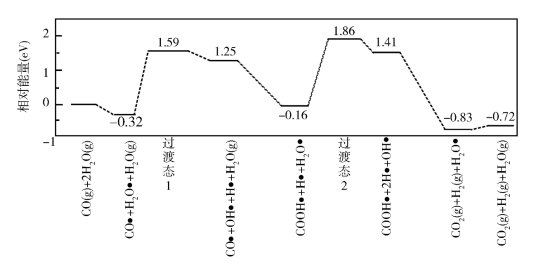
可知水煤气变换的ΔH________ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________ eV,写出该步骤的化学方程式_______________________ 。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
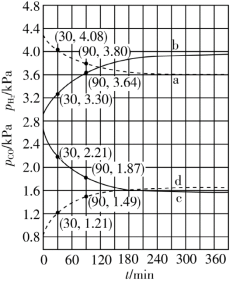
计算曲线a的反应在30~90 min内的平均速率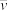 (a)=
(a)=___________ kPa·min−1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________ 、___________ 。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________ 、___________ 。
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用
 标注。
标注。
可知水煤气变换的ΔH
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。

计算曲线a的反应在30~90 min内的平均速率
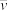 (a)=
(a)=
您最近一年使用:0次
2019-06-09更新
|
19263次组卷
|
20卷引用:2019年全国统一考试化学试题(新课标Ⅰ)
2019年全国统一考试化学试题(新课标Ⅰ)(已下线)专题09 反应速率、化学平衡——2019年高考真题和模拟题化学分项汇编安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题(已下线)专题7.1 化学反应速率(讲)-《2020年高考一轮复习讲练测》(已下线)专题7.1 化学反应速率(练)-《2020年高考一轮复习讲练测》湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题专题2.2 化学反应速率和化学平衡(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题17 原理综合题(已下线)T28-原理综合题福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2章 综合检测高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二章素养检测人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考江苏省盱眙中学2021-2022学年高二上学期第三次学情调研化学试题2018-2019学年度耀华实验学校第二学期高二实验化学期末试卷
10 . 以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
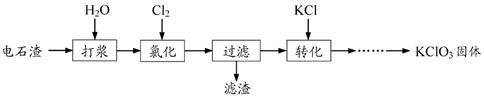
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为________ 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________ (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O。氯化完成后过滤。
①滤渣的主要成分为____ (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2]_____ 1∶5(填“>”、“<”或“=”)。
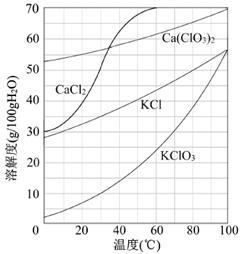
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g▪L-1,从该溶液中尽可能多地析出KClO3固体的方法是____ 。

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O。氯化完成后过滤。

①滤渣的主要成分为
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2]
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g▪L-1,从该溶液中尽可能多地析出KClO3固体的方法是
您最近一年使用:0次
2019-03-05更新
|
1127次组卷
|
8卷引用:2016年全国普通高等学校招生统一考试化学(江苏卷精编版)



