解题方法
1 . 乙醇因其含氢量高、毒性低、价格低廉且来源广泛,成为理想的液态储氢载体之一。乙醇―水催化重整可获得 ,其主要反应为:
,其主要反应为:
Ⅰ.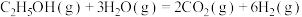

Ⅱ.

回答下列问题:
(1)已知:298K时,相关物质的相对能量如下表:
则a=___________ 。
(2)在恒温恒容条件下,投入1mol 和3mol
和3mol 发生反应
发生反应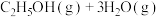
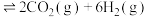 ,下列情况表明该反应达到平衡状态的是___________(填标号)。
,下列情况表明该反应达到平衡状态的是___________(填标号)。
(3)科学家研究了Grubbs催化剂作用于乙醇水溶液重整产氢的反应,测得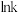 (k为速率常数)与反应温度倒数(
(k为速率常数)与反应温度倒数( )的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系:
)的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系:___________ 。 下,
下,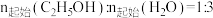 时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时
时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时 和CO的选择性及
和CO的选择性及 的产率随温度的变化如图2所示。
的产率随温度的变化如图2所示。 的选择性
的选择性
①图中表示 产率随温度变化的曲线是
产率随温度变化的曲线是___________ (填字母),判断依据是___________ 。
②一定温度下,加入 可以提高平衡时
可以提高平衡时 的产率,其原因是
的产率,其原因是___________ 。
(5)向一容积为2L的恒容密闭容器中通入2mol 和6mol
和6mol ,一定温度下发生反应
,一定温度下发生反应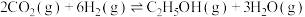 。若起始时气体的总压为p Pa,20min时达到平衡状态,测得
。若起始时气体的总压为p Pa,20min时达到平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。
①平衡时气体的总压为___________ Pa(用含p的分数表示,需化简)。
②0~20min内,用 浓度的变化表示的平均反应速率
浓度的变化表示的平均反应速率
___________ ;该温度下,上述反应的平衡常数
___________ 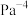 (用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 ,其主要反应为:
,其主要反应为:Ⅰ.
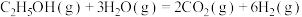

Ⅱ.


回答下列问题:
(1)已知:298K时,相关物质的相对能量如下表:
| 物质 |  |  |  |  |  |
相对能量/( ) ) | ―242 | ―393 | 0 | ―110 | a |
(2)在恒温恒容条件下,投入1mol
 和3mol
和3mol 发生反应
发生反应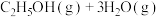
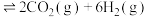 ,下列情况表明该反应达到平衡状态的是___________(填标号)。
,下列情况表明该反应达到平衡状态的是___________(填标号)。| A.混合气体的密度保持不变 | B.混合气体的总压强保持不变 |
| C.混合气体的平均摩尔质量保持不变 | D.产物的浓度之比保持不变 |
(3)科学家研究了Grubbs催化剂作用于乙醇水溶液重整产氢的反应,测得
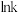 (k为速率常数)与反应温度倒数(
(k为速率常数)与反应温度倒数( )的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系:
)的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系: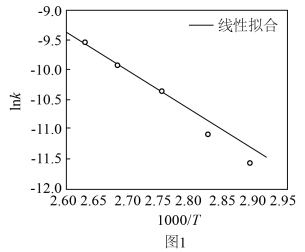
 下,
下,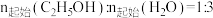 时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时
时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时 和CO的选择性及
和CO的选择性及 的产率随温度的变化如图2所示。
的产率随温度的变化如图2所示。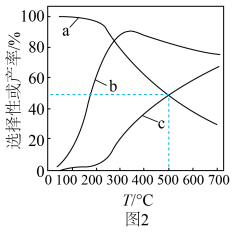
 的选择性
的选择性
①图中表示
 产率随温度变化的曲线是
产率随温度变化的曲线是②一定温度下,加入
 可以提高平衡时
可以提高平衡时 的产率,其原因是
的产率,其原因是(5)向一容积为2L的恒容密闭容器中通入2mol
 和6mol
和6mol ,一定温度下发生反应
,一定温度下发生反应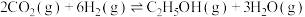 。若起始时气体的总压为p Pa,20min时达到平衡状态,测得
。若起始时气体的总压为p Pa,20min时达到平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。①平衡时气体的总压为
②0~20min内,用
 浓度的变化表示的平均反应速率
浓度的变化表示的平均反应速率

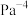 (用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近一年使用:0次
解题方法
2 . 煤的气化与液化是实现煤清洁利用的基本途径; 的资源化利用有利于碳中和目标的实现。回答下列问题:
的资源化利用有利于碳中和目标的实现。回答下列问题:
(1)煤制备乙烯的途径之一如下:

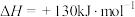 ;
;

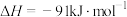 ;
;
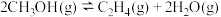
 。
。
已知:①
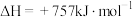 ;
;
②
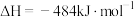 。
。
则
___________ ,反应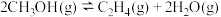 的自发性与温度的关系是
的自发性与温度的关系是___________ 。
(2) 催化加氢可得到甲烷:
催化加氢可得到甲烷:

 ,从速率与平衡移动两方面考虑,反应温度不宜过低或过高,理由是
,从速率与平衡移动两方面考虑,反应温度不宜过低或过高,理由是___________ 。
(3)向某密闭容器中充入一定量的 和
和 ,在
,在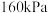 条件下发生反应:
条件下发生反应: 。当充入量
。当充入量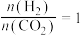 时
时 的平衡转化率~
的平衡转化率~ 的关系与
的关系与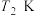 时
时 的平衡转化率~
的平衡转化率~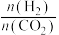 的关系如图所示:
的关系如图所示: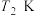 时
时 平衡转化率~
平衡转化率~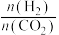 的关系是
的关系是___________ (填“Ⅰ”或“Ⅱ”)。
②当充入量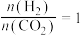 、温度为
、温度为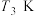 时,反应开始后经过
时,反应开始后经过 达到平衡状态,若最初充人
达到平衡状态,若最初充人 ,则
,则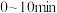 内
内
___________ 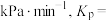
___________ 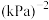 ;实际生产中从反应炉出来的气体中
;实际生产中从反应炉出来的气体中 的转化率总是低于图中表示的相应值,最可能的原因是
的转化率总是低于图中表示的相应值,最可能的原因是___________ 。
③下列事实不能说明在一定温度下该反应已经达到平衡状态的是___________ (填选项字母)。
A.容器中气体总体积保持不变
B.混合气体的平均相对分子质量保持不变
C.相同时间内 键与
键与 键断裂的数目相等
键断裂的数目相等
D.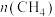 与
与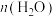 比值保持不变
比值保持不变
 的资源化利用有利于碳中和目标的实现。回答下列问题:
的资源化利用有利于碳中和目标的实现。回答下列问题:(1)煤制备乙烯的途径之一如下:

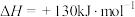 ;
;
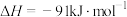 ;
;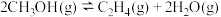
 。
。已知:①

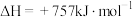 ;
;②

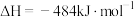 。
。则

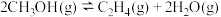 的自发性与温度的关系是
的自发性与温度的关系是(2)
 催化加氢可得到甲烷:
催化加氢可得到甲烷:

 ,从速率与平衡移动两方面考虑,反应温度不宜过低或过高,理由是
,从速率与平衡移动两方面考虑,反应温度不宜过低或过高,理由是(3)向某密闭容器中充入一定量的
 和
和 ,在
,在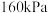 条件下发生反应:
条件下发生反应: 。当充入量
。当充入量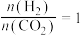 时
时 的平衡转化率~
的平衡转化率~ 的关系与
的关系与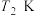 时
时 的平衡转化率~
的平衡转化率~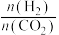 的关系如图所示:
的关系如图所示:
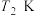 时
时 平衡转化率~
平衡转化率~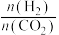 的关系是
的关系是②当充入量
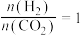 、温度为
、温度为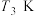 时,反应开始后经过
时,反应开始后经过 达到平衡状态,若最初充人
达到平衡状态,若最初充人 ,则
,则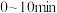 内
内
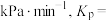
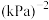 ;实际生产中从反应炉出来的气体中
;实际生产中从反应炉出来的气体中 的转化率总是低于图中表示的相应值,最可能的原因是
的转化率总是低于图中表示的相应值,最可能的原因是③下列事实不能说明在一定温度下该反应已经达到平衡状态的是
A.容器中气体总体积保持不变
B.混合气体的平均相对分子质量保持不变
C.相同时间内
 键与
键与 键断裂的数目相等
键断裂的数目相等 D.
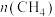 与
与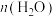 比值保持不变
比值保持不变
您最近一年使用:0次
名校
解题方法
3 . 二甲醚( )既是一种有机燃料,又是一种重要的有机化工原料。利用
)既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:
Ⅰ.

Ⅱ.

Ⅲ.

下表是几种物质的标准生成热(由对应稳定单质生成1mol某种物质的焓变叫做该物质的标准生成热)。
回答下列问题:
(1)
___________ ;反应Ⅱ的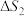
___________ (填“>”“=”或“<”)0。
(2) ℃下,向1L刚性密闭容器中投入2mol
℃下,向1L刚性密闭容器中投入2mol  ,只发生反应Ⅲ,t s时达到平衡,此时
,只发生反应Ⅲ,t s时达到平衡,此时 的转化率为
的转化率为 。
。
①下列叙述能说明反应Ⅲ已经达到平衡的是___________ (填选项字母)。
a.混合气体密度不再发生变化 b.容器内压强不再发生变化
c. 的消耗速率等于
的消耗速率等于 的消耗速率 d.
的消耗速率 d. 的体积分数不再发生变化
的体积分数不再发生变化
②若向该容器中再加入2mol ,重新达到平衡时所需时间
,重新达到平衡时所需时间___________ (填“>”“=”或“<”)t s,此时 的体积分数为
的体积分数为___________ (用含 的代数式表示)。
的代数式表示)。
③在催化剂条件下反应Ⅲ的反应过程如下图所示,“*”表示吸附在催化剂上。___________ (填“第一步”或“第二步”),判断的理由是__________________ 。
(3) ℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入
℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入 和
和 发生上述反应,平衡时
发生上述反应,平衡时 的转化率为60%,
的转化率为60%, (g)的体积分数为25%。则平衡时
(g)的体积分数为25%。则平衡时 的体积分数为
的体积分数为___________ (保留3位有效数字);该温度下反应Ⅰ的压强平衡常数
___________ (用含p的代数式表示) 。
。
 )既是一种有机燃料,又是一种重要的有机化工原料。利用
)既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:Ⅰ.


Ⅱ.


Ⅲ.


下表是几种物质的标准生成热(由对应稳定单质生成1mol某种物质的焓变叫做该物质的标准生成热)。
| 物质 |  (g) (g) |  (g) (g) |  (g) (g) |  (g) (g) |
标准生成热/( ) ) | 0 | -201.3 | -241.3 | -184.3 |
(1)

(2)
 ℃下,向1L刚性密闭容器中投入2mol
℃下,向1L刚性密闭容器中投入2mol  ,只发生反应Ⅲ,t s时达到平衡,此时
,只发生反应Ⅲ,t s时达到平衡,此时 的转化率为
的转化率为 。
。①下列叙述能说明反应Ⅲ已经达到平衡的是
a.混合气体密度不再发生变化 b.容器内压强不再发生变化
c.
 的消耗速率等于
的消耗速率等于 的消耗速率 d.
的消耗速率 d. 的体积分数不再发生变化
的体积分数不再发生变化②若向该容器中再加入2mol
 ,重新达到平衡时所需时间
,重新达到平衡时所需时间 的体积分数为
的体积分数为 的代数式表示)。
的代数式表示)。③在催化剂条件下反应Ⅲ的反应过程如下图所示,“*”表示吸附在催化剂上。
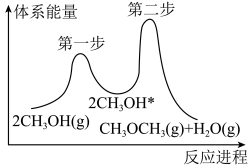
(3)
 ℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入
℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入 和
和 发生上述反应,平衡时
发生上述反应,平衡时 的转化率为60%,
的转化率为60%, (g)的体积分数为25%。则平衡时
(g)的体积分数为25%。则平衡时 的体积分数为
的体积分数为
 。
。
您最近一年使用:0次
2024-04-19更新
|
218次组卷
|
3卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
解题方法
4 . 深入研究含碳、氮元素物质的转化有着重要的实际意义。
Ⅰ.合成尿素:如图所示是合成尿素反应的机理及能量变化(单位: ),
), 表示过渡态。
表示过渡态。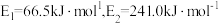 ,则总反应
,则总反应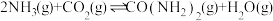

___________  。
。
(2)若向某恒温恒容的密闭容器中加入等物质的量的 和
和 发生上述反应。结合以上机理,下列叙述能说明反应已经达到平衡状态的是
发生上述反应。结合以上机理,下列叙述能说明反应已经达到平衡状态的是___________ (填标号)。
a. 的体积分数不再变化 b.平衡常数K不再变化
的体积分数不再变化 b.平衡常数K不再变化
c. d.断裂
d.断裂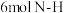 键的同时断裂
键的同时断裂 键
键
(3)图为使用不同催化剂①、②、③时,反应至相同时间,容器中尿素的物质的量随温度变化的曲线,A点___________ (填“是”或“不是”)平衡状态, 以上
以上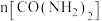 下降的原因可能是
下降的原因可能是___________ (答出一点即可,不考虑物质的稳定性)。 处理大气污染物
处理大气污染物
(4)① 、
、 在催化剂
在催化剂 的表面进行两步反应转化为无毒的气体,第一步为
的表面进行两步反应转化为无毒的气体,第一步为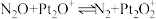 ;则第二步为
;则第二步为___________ 。
②已知: 的速率方程为
的速率方程为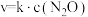 ,k为速率常数,只与温度有关。为提高反应速率,可采取的措施是
,k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________ (填标号)。
A.升温 B.恒容时,再充入 C.恒容时,再充入
C.恒容时,再充入 D.恒压时,再充入
D.恒压时,再充入
(5)在总压为 的恒容密闭容器中,充入一定量的
的恒容密闭容器中,充入一定量的 和
和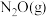 发生上述反应,在不同条件下达到平衡时,温度
发生上述反应,在不同条件下达到平衡时,温度 时
时 的转化率随
的转化率随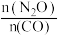 变化的曲线,以及在
变化的曲线,以及在 时
时 的转化率随
的转化率随 变化的曲线如图所示:
变化的曲线如图所示: 的转化率随
的转化率随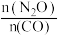 变化的曲线为
变化的曲线为___________ 曲线(填“Ⅰ”或“Ⅱ”);上述反应的
___________ 0(填“>”或“<”)。
②在 时,用平衡分压代替其平衡浓度表示的化学平衡常数
时,用平衡分压代替其平衡浓度表示的化学平衡常数
___________ (结果保留两位小数)[已知:气体分压( )=气体总压(
)=气体总压( )×该气体的物质的量分数]。
)×该气体的物质的量分数]。
Ⅰ.合成尿素:如图所示是合成尿素反应的机理及能量变化(单位:
 ),
), 表示过渡态。
表示过渡态。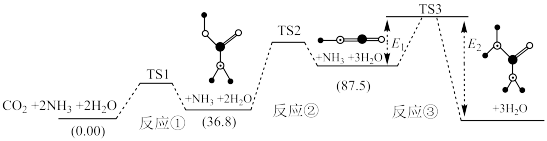
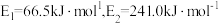 ,则总反应
,则总反应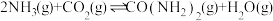

 。
。(2)若向某恒温恒容的密闭容器中加入等物质的量的
 和
和 发生上述反应。结合以上机理,下列叙述能说明反应已经达到平衡状态的是
发生上述反应。结合以上机理,下列叙述能说明反应已经达到平衡状态的是a.
 的体积分数不再变化 b.平衡常数K不再变化
的体积分数不再变化 b.平衡常数K不再变化c.
 d.断裂
d.断裂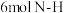 键的同时断裂
键的同时断裂 键
键(3)图为使用不同催化剂①、②、③时,反应至相同时间,容器中尿素的物质的量随温度变化的曲线,A点
 以上
以上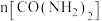 下降的原因可能是
下降的原因可能是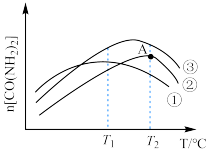
 处理大气污染物
处理大气污染物
(4)①
 、
、 在催化剂
在催化剂 的表面进行两步反应转化为无毒的气体,第一步为
的表面进行两步反应转化为无毒的气体,第一步为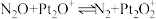 ;则第二步为
;则第二步为②已知:
 的速率方程为
的速率方程为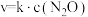 ,k为速率常数,只与温度有关。为提高反应速率,可采取的措施是
,k为速率常数,只与温度有关。为提高反应速率,可采取的措施是A.升温 B.恒容时,再充入
 C.恒容时,再充入
C.恒容时,再充入 D.恒压时,再充入
D.恒压时,再充入
(5)在总压为
 的恒容密闭容器中,充入一定量的
的恒容密闭容器中,充入一定量的 和
和 发生上述反应,在不同条件下达到平衡时,温度
发生上述反应,在不同条件下达到平衡时,温度 时
时 的转化率随
的转化率随 变化的曲线,以及在
变化的曲线,以及在 时
时 的转化率随
的转化率随 变化的曲线如图所示:
变化的曲线如图所示: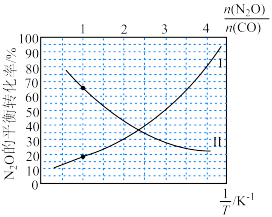
 的转化率随
的转化率随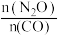 变化的曲线为
变化的曲线为
②在
 时,用平衡分压代替其平衡浓度表示的化学平衡常数
时,用平衡分压代替其平衡浓度表示的化学平衡常数
 )=气体总压(
)=气体总压( )×该气体的物质的量分数]。
)×该气体的物质的量分数]。
您最近一年使用:0次
名校
解题方法
5 . 为了实现“碳达峰”和“碳中和”的目标,将 催化加氢合成低碳烯烃是解决温室效应和化工原料问题的有效途径。已知部分反应的热化学方程式如下:
催化加氢合成低碳烯烃是解决温室效应和化工原料问题的有效途径。已知部分反应的热化学方程式如下:
I.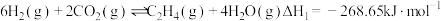
Ⅱ.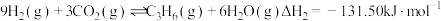
Ⅲ.
回答下列问题:
(1)反应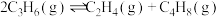 的
的
_______  。
。
(2)120℃和有催化剂存在的条件下,恒容密闭容器中,反应Ⅱ达到平衡状态的标志是_____(填标号)。
(3)用碳化钼催化 和
和 重整制氢的反应原理如图所示。
重整制氢的反应原理如图所示。 发生的反应为
发生的反应为 ,则
,则 发生的反应为
发生的反应为_______ 。
②将 和
和 充入恒容密闭容器中发生反应:
充入恒容密闭容器中发生反应: ,在
,在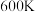 时,气体混合物中
时,气体混合物中 的物质的量分数
的物质的量分数 与反应时间
与反应时间 的关系如下表所示:
的关系如下表所示:
该反应中,正反应速率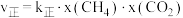 ,逆反应速率
,逆反应速率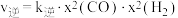 ,其中
,其中
 为速率常数,则
为速率常数,则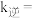
_______ (用 和
和 表示,其中
表示,其中 为用物质的量分数表示的平衡常数)。
为用物质的量分数表示的平衡常数)。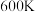 时,该反应的
时,该反应的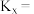
_______ (保留1位小数)。
(4)在总压强恒定为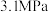 和
和 时,在容器体积可变的密闭容器中当只发生反应I时,平衡时各物质的物质的量百分数
时,在容器体积可变的密闭容器中当只发生反应I时,平衡时各物质的物质的量百分数 与温度
与温度 的关系如图所示。
的关系如图所示。 点时,
点时, 的平衡转化率为
的平衡转化率为_______ ;乙烯的分压为_______  。B点对应温度下反应I的压强平衡常数
。B点对应温度下反应I的压强平衡常数
_______  (保留1位小数)。
(保留1位小数)。
 催化加氢合成低碳烯烃是解决温室效应和化工原料问题的有效途径。已知部分反应的热化学方程式如下:
催化加氢合成低碳烯烃是解决温室效应和化工原料问题的有效途径。已知部分反应的热化学方程式如下:I.
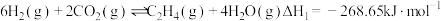
Ⅱ.
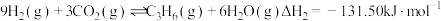
Ⅲ.

回答下列问题:
(1)反应
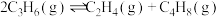 的
的
 。
。(2)120℃和有催化剂存在的条件下,恒容密闭容器中,反应Ⅱ达到平衡状态的标志是_____(填标号)。
A.单位时间内消耗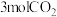 ,同时生成 ,同时生成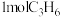 |
| B.混合气体的密度不再改变 |
C.反应速率 |
| D.混合气体的平均相对分子质量不再改变 |
(3)用碳化钼催化
 和
和 重整制氢的反应原理如图所示。
重整制氢的反应原理如图所示。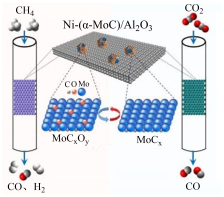
 发生的反应为
发生的反应为 ,则
,则 发生的反应为
发生的反应为②将
 和
和 充入恒容密闭容器中发生反应:
充入恒容密闭容器中发生反应: ,在
,在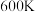 时,气体混合物中
时,气体混合物中 的物质的量分数
的物质的量分数 与反应时间
与反应时间 的关系如下表所示:
的关系如下表所示: | 0 | 10 | 20 | 30 | 40 | 50 |
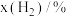 | 0 | 11 | 20 | 26 | 30 | 30 |
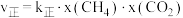 ,逆反应速率
,逆反应速率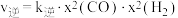 ,其中
,其中
 为速率常数,则
为速率常数,则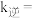
 和
和 表示,其中
表示,其中 为用物质的量分数表示的平衡常数)。
为用物质的量分数表示的平衡常数)。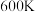 时,该反应的
时,该反应的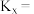
(4)在总压强恒定为
 和
和 时,在容器体积可变的密闭容器中当只发生反应I时,平衡时各物质的物质的量百分数
时,在容器体积可变的密闭容器中当只发生反应I时,平衡时各物质的物质的量百分数 与温度
与温度 的关系如图所示。
的关系如图所示。 点时,
点时, 的平衡转化率为
的平衡转化率为 。B点对应温度下反应I的压强平衡常数
。B点对应温度下反应I的压强平衡常数
 (保留1位小数)。
(保留1位小数)。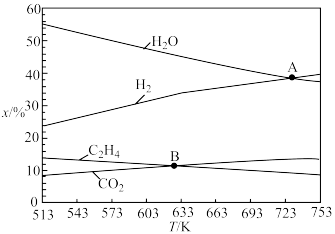
您最近一年使用:0次
2024-03-03更新
|
189次组卷
|
3卷引用:2024届山西省朔州市怀仁市第一中学校等校高三下学期三模理综试题-高中化学
6 . 回答下列问题。
I.2021年1月7日,我国首个探明储量超千亿方的深层页岩气田-中国石化西南石油局威荣页岩气田一期项目全面建成,对促进成渝地区双城经济圈建设具有重要意义。回答下列问题:
(1)页岩气主要成分是甲烷。已知25℃, 时甲烷的燃烧热
时甲烷的燃烧热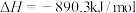 。请写出表示甲烷燃烧热的热化学方程式:
。请写出表示甲烷燃烧热的热化学方程式:___________ 。
(2)用甲烷可以合成乙烯: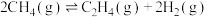
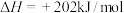 ,该反应在
,该反应在___________ 下自发进行(填“高温”、“低温”或“任何温度”)。
Ⅱ.在催化剂作用下由CO2和H2可直接合成乙烯: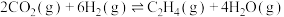 △H
△H
(3)关于该反应,下列叙述正确的是___________ (填字母序号)。
a.恒容下达平衡状态时,再充入少量氨气,正、逆反应速率不变
b.当混合气体的平均摩尔质量不再发生变化时,反应达平衡状态
c.当反应达平衡状态时,
d.恒温下缩小容器体积,反应物的活化分子百分数增大
e.若断裂4molC=O,同时生成6molH-H,说明反应达到平衡状态
f.单位时间内生成2nmolH2O的同时生成nmolC2H4,说明反应达到平衡状态
g.恒容绝热容器中,容器内的温度不再变化,说明反应达到平衡状态
(4)在体积为2L的恒容密闭容器中,加入4molCO2和12molH2,在催化剂作用下发生直接合成乙烯的反应,测得温度对CO2的平衡转化率影响如图所示。
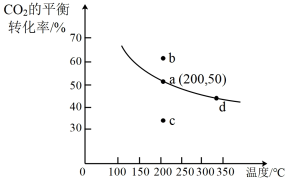
①200℃时,该反应的化学平衡常数K=___________ (精确到小数点后两位)。
②该反应的△H___________ 0(填“<”、“>”或“=”),请结合平衡移动原理简述理由___________ 。
③若不使用催化剂,则200℃时CO2的平衡转化率位于图中___________ 点(填“a”、“b”、“c”或“d”)。
I.2021年1月7日,我国首个探明储量超千亿方的深层页岩气田-中国石化西南石油局威荣页岩气田一期项目全面建成,对促进成渝地区双城经济圈建设具有重要意义。回答下列问题:
(1)页岩气主要成分是甲烷。已知25℃,
 时甲烷的燃烧热
时甲烷的燃烧热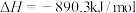 。请写出表示甲烷燃烧热的热化学方程式:
。请写出表示甲烷燃烧热的热化学方程式:(2)用甲烷可以合成乙烯:
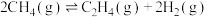
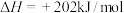 ,该反应在
,该反应在Ⅱ.在催化剂作用下由CO2和H2可直接合成乙烯:
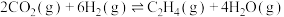 △H
△H(3)关于该反应,下列叙述正确的是
a.恒容下达平衡状态时,再充入少量氨气,正、逆反应速率不变
b.当混合气体的平均摩尔质量不再发生变化时,反应达平衡状态
c.当反应达平衡状态时,

d.恒温下缩小容器体积,反应物的活化分子百分数增大
e.若断裂4molC=O,同时生成6molH-H,说明反应达到平衡状态
f.单位时间内生成2nmolH2O的同时生成nmolC2H4,说明反应达到平衡状态
g.恒容绝热容器中,容器内的温度不再变化,说明反应达到平衡状态
(4)在体积为2L的恒容密闭容器中,加入4molCO2和12molH2,在催化剂作用下发生直接合成乙烯的反应,测得温度对CO2的平衡转化率影响如图所示。

①200℃时,该反应的化学平衡常数K=
②该反应的△H
③若不使用催化剂,则200℃时CO2的平衡转化率位于图中
您最近一年使用:0次
解题方法
7 . 利用太阳能等可再生能源,通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇,发生的主要反应是:CO2(g)+3H2(g)  CH3OH(g) + H2O(g),若上述反应在恒温、恒容条件下,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是
CH3OH(g) + H2O(g),若上述反应在恒温、恒容条件下,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是
 CH3OH(g) + H2O(g),若上述反应在恒温、恒容条件下,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是
CH3OH(g) + H2O(g),若上述反应在恒温、恒容条件下,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是A. | B.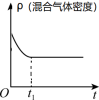 |
C. | D. |
您最近一年使用:0次
名校
解题方法
8 . 一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)⇌CO(g)+H2(g)。下列叙述中不能说明该反应已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成n molCO的同时生成n molH2 |
| D.1mol H-H键断裂的同时断裂2mol H-O键 |
您最近一年使用:0次
2024-01-19更新
|
257次组卷
|
64卷引用:山西省大同市天镇一中2019-2020学年高二上学期期中考试化学试题
山西省大同市天镇一中2019-2020学年高二上学期期中考试化学试题山西省运城市临猗县临晋中学2019-2020学年高一下学期开学复课摸底考试化学试题(已下线)2012届山东省济宁市邹城二中高三第二次月考化学试卷(已下线)2011-2012学年湖北武汉部分重点中学高一下学期期末考试化学题(已下线)2014秋河北省成安一中、临漳一中、永年二中高二上学期期中联考化学试卷2015-2016学年辽宁省沈阳市东北育才学校高二上化学试卷2015-2016学年四川省香港马会第五中学高二上10月月考化学试卷2015-2016学年山东省淄博市淄川一中高二上第一次阶段测化学试卷2015-2016学年湖南省株洲十八中高二上学期期末理化学试卷2015-2016学年新疆生产建设兵团二中高一下期中化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷四川省资阳中学2016-2017学年高一下学期期中化学试题福建省师范大学附属中学2016-2017学年高一下学期期末考试化学试题贵州省遵义航天高级中学2017-2018学年高二上学期第三次月考理综(理)化学试题江西省吉安县第三中学2017-2018学年高二1月月考化学试题2017-2018学年高一化学人教版必修2:第二章检测题山东省师范大学附属中学2017-2018学年高一下学期第三次学分认定考试(期中)化学试题山东师范大学附属中学2017-2018学年高一下学期期中考试化学试题【全国市级联考】山东省德州市2017-2018学年高一下学期期末考试化学试题【全国市级联考】广东省潮州市2017-2018学年高一下学期期末考试化学试题(已下线)2018年9月30日 《每日一题》一轮复习-每周一测福建省漳州市东山县第二中学2019届高三上学期第三次月考化学试题步步为赢 高二化学暑假作业:作业九 化学反应速率和化学平衡河北省邢台市第二中学2018-2019学年下学期高一第四次月考化学试题浙江省台州市书生中学2019-2020学年高二年级上学期第一次月考化学试题云南省河口县高级中学2019-2020学年高二上学期期末考试化学试题贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高二上学期期末考试化学试题6.2.2 化学反应的限度化学反应条件的控制——2020年春高一新人教版第二册化学一课一练湖南省双峰县第一中学2019-2020学年高一下学期入学考试化学试题2020年春高一化学新人教版第二册课后同步:6.2.2 化学反应的限度化学反应条件的控制黑龙江省大庆中学2019-2020学年高一下学期期中考试化学试题安徽省亳州市涡阳县第九中学2018-2019学年高一下学期第三次月考化学试题吉林省白城市第一中学2019-2020学年高一下学期期末考试化学试题广东省汕头市金山中学2019-2020学年高一下学期期中考试化学试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)2.3.1化学平衡状态(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题安徽省合肥市第一中学2019—2020学年高一下学期期末考试化学试题河北省保定市高碑店市高碑店一中2019---2020学年高一下学期第二次月考化学试题(已下线)6.2.2 化学反应的限度(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)【浙江新东方】双师155高一下.四川省成都市蒲江县蒲江中学2020-2021学年高二上学期10月月考化学试题吉林省白城市第一中学2020-2021学年高一下学期期中考试化学试题吉林省长春外国语学校2021-2022学年高二上学期期初考试化学试题安徽省亳州市第二中学2021-2022学年高二上学期第一次月考化学试题辽宁省朝阳育英高考补习学校2021-2022学年高二10月月考化学试题贵州省平塘民族中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高二上学期10月阶段性总结化学试题吉林省四平市普通高中2021-2022学年高二上学期期中考试化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题福建省福州第四中学2021-2022学年高一下学期3月月考化学试题重庆市青木关中学校2021-2022学年高二上学期期中考试化学试题(已下线)6.2.1 化学平衡(第1课时 可逆反应和化学平衡状态)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)浙江省杭州市源清中学2021-2022学年高一下学期期中考试化学试题吉林省延边第二中学2022-2023学年高三上学期第三次阶段测试化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题甘肃省徽县第一中学2021-2022学年高二上学期11月月考化学试题吉林省洮南市第一中学2021-2022学年高一下学期第一次月考化学试题甘肃省天水市秦安县第一中学2022-2023学年高一下学期4月期中化学试题河南省商丘市宁陵县高级中学2023-2024学年高二上学期第一次考试化学试题新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题上海市民办新虹桥中学2023-2024学年高二上学期期中考试化学试卷 山东省临沂市平邑县第一中学西校区2023-2024学年高二上学期第一次月考化学试题 安徽省淮北市国泰中学2023-2024学年高二上学期期末考试化学试题
名校
9 . 一定温度下,某恒压密闭容器中加入足量的碳酸钙,发生反应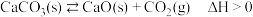 达到平衡,下列说法不正确的是
达到平衡,下列说法不正确的是
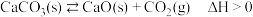 达到平衡,下列说法不正确的是
达到平衡,下列说法不正确的是A.将体积缩小为原来的一半,当体系再次达到平衡时, 的浓度不变 的浓度不变 |
| B.若温度升高,平衡正向移动,平衡常数增大 |
| C.该反应为吸热反应,高温可自发进行 |
| D.混合气体密度不变,能说明反应达到化学平衡状态 |
您最近一年使用:0次
名校
解题方法
10 . 直接以 为原料生产
为原料生产 是目前的研究热点,我国科学家用
是目前的研究热点,我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为
转化为 。回答下列问题:
。回答下列问题:
(1)已知:Ⅰ.

Ⅱ.
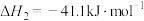 :
:
Ⅲ.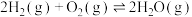
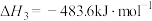 :
:
Ⅳ.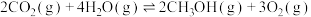
 。
。
①反应①的自发条件是___________ (填“高温自发”“低温自发”或“任何温度下都自发”)。
②反应Ⅳ的 =
=___________ 。
(2)以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.
Ⅱ. 。
。
①研究表明,在 催化剂存在下,
催化剂存在下, 和
和 只发生反应Ⅰ和Ⅱ,密闭容器保持恒温恒容,下列条件能表明该反应达到平衡状态的是
只发生反应Ⅰ和Ⅱ,密闭容器保持恒温恒容,下列条件能表明该反应达到平衡状态的是___________ (填字母)。
A.当2个 键断裂,同时断裂一个
键断裂,同时断裂一个 键
键
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.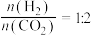
E. 体积分数保持不变
体积分数保持不变
②一定条件下,向体积为VL的恒容密闭容器中通入1mol 和3mol
和3mol  ,发生上述反应,达到平衡时,容器中
,发生上述反应,达到平衡时,容器中 为amol,
为amol, 为bmol,此时
为bmol,此时 的浓度为
的浓度为___________  (用含a、b、V的代数式表示,下同),反应Ⅱ的平衡常数为
(用含a、b、V的代数式表示,下同),反应Ⅱ的平衡常数为___________ 。
(3)甲醇燃料电池以甲醇为燃料,其工作原理如图所示:
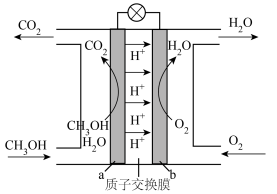
b电极是___________ (填“正极”或“负极”),写出a极的电极反应式:___________ 。
 为原料生产
为原料生产 是目前的研究热点,我国科学家用
是目前的研究热点,我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为
转化为 。回答下列问题:
。回答下列问题:(1)已知:Ⅰ.


Ⅱ.

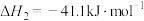 :
:Ⅲ.
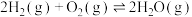
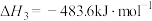 :
:Ⅳ.
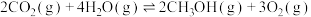
 。
。①反应①的自发条件是
②反应Ⅳ的
 =
=(2)以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.

Ⅱ.
 。
。①研究表明,在
 催化剂存在下,
催化剂存在下, 和
和 只发生反应Ⅰ和Ⅱ,密闭容器保持恒温恒容,下列条件能表明该反应达到平衡状态的是
只发生反应Ⅰ和Ⅱ,密闭容器保持恒温恒容,下列条件能表明该反应达到平衡状态的是A.当2个
 键断裂,同时断裂一个
键断裂,同时断裂一个 键
键B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.
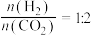
E.
 体积分数保持不变
体积分数保持不变②一定条件下,向体积为VL的恒容密闭容器中通入1mol
 和3mol
和3mol  ,发生上述反应,达到平衡时,容器中
,发生上述反应,达到平衡时,容器中 为amol,
为amol, 为bmol,此时
为bmol,此时 的浓度为
的浓度为 (用含a、b、V的代数式表示,下同),反应Ⅱ的平衡常数为
(用含a、b、V的代数式表示,下同),反应Ⅱ的平衡常数为(3)甲醇燃料电池以甲醇为燃料,其工作原理如图所示:

b电极是
您最近一年使用:0次
2023-12-26更新
|
327次组卷
|
2卷引用:山西省吕梁市孝义市2023-2024学年高二上学期12月月考化学试题



