1 . 碳和碳的化合物在生产、生活中有重要作用,乙烯、甲醇、甲酸等都是重要的能源物质。
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
在相同条件下,起始反应最快的是_____ (填序号)。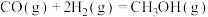 的
的
_____ 。
(2)甲醇水蒸气重整,总反应为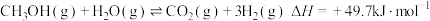 。
。
①若工业生产中在恒压容器中进行该反应,下列措施可提高CH3OH的平衡转化率的是_____ (填字母)。
a.原料气中掺入一定量惰性气体
b.升高温度
c.使用催化效率更高的催化剂
d.使用分子筛及时移走产生的氢气
②该过程中同时发生两个反应:
I.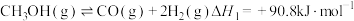
Ⅱ.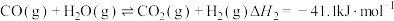
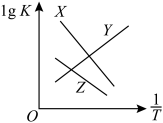
总反应、反应Ⅰ、反应Ⅱ的平衡常数对数lgK与 变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是_____ ,理由是_____ 。
③在恒容密闭容器中,充入一定量CH3OH(g)和H2O(g),同时发生反应Ⅰ、反应Ⅱ,实验测得不同温度下,平衡体系中H2的体积分数如图所示:
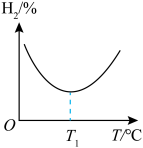
T1°C之后平衡体系中H2体积分数增大的原因是_____ 。
(3)CO2催化还原可以制备 和HCOOH:
和HCOOH:
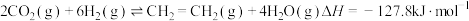 ;
;
 。
。
在一定温度下,在容积为1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),同时发生了乙烯化和甲酸化反应,达到平衡时C2H4的选择性为40%,体系压强减小了22.5%。则CO2总转化率为_____ ,该温度下,甲酸化的平衡常数K=_____ (结果保留2位小数)。提示: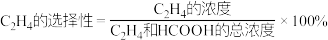
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
| 序号 | 化学反应 | E1/(kJ·mol-¹) | E2/(kJ·mol-¹) |
| ① | 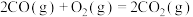 | 1954 | 2519 |
| ② | 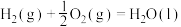 | 685 | 970 |
| ③ | 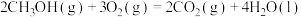 | 3526 | 4978 |
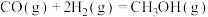 的
的
(2)甲醇水蒸气重整,总反应为
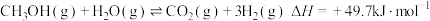 。
。①若工业生产中在恒压容器中进行该反应,下列措施可提高CH3OH的平衡转化率的是
a.原料气中掺入一定量惰性气体
b.升高温度
c.使用催化效率更高的催化剂
d.使用分子筛及时移走产生的氢气
②该过程中同时发生两个反应:
I.
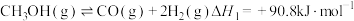
Ⅱ.
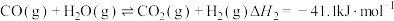
总反应、反应Ⅰ、反应Ⅱ的平衡常数对数lgK与
 变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
③在恒容密闭容器中,充入一定量CH3OH(g)和H2O(g),同时发生反应Ⅰ、反应Ⅱ,实验测得不同温度下,平衡体系中H2的体积分数如图所示:

T1°C之后平衡体系中H2体积分数增大的原因是
(3)CO2催化还原可以制备
 和HCOOH:
和HCOOH: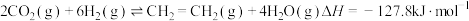 ;
; 。
。在一定温度下,在容积为1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),同时发生了乙烯化和甲酸化反应,达到平衡时C2H4的选择性为40%,体系压强减小了22.5%。则CO2总转化率为
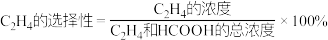
您最近一年使用:0次
2 . 下列事实不能用勒夏特列原理解释的是
| A.采用排饱和食盐水的方法收集氯气 |
B.红棕色的 ,加压后颜色先变深后变浅 ,加压后颜色先变深后变浅 |
| C.高压更有利于合成氨 |
D.盛有 溶液与稀硫酸混合液的试管浸入热水时迅速变浑浊 溶液与稀硫酸混合液的试管浸入热水时迅速变浑浊 |
您最近一年使用:0次
2023-05-01更新
|
270次组卷
|
7卷引用:甘肃省张掖市高台县第一中学2023-2024学年高二上学期10月月考化学试题
10-11高二下·浙江杭州·期中
3 . 对已经达到化学平衡的反应: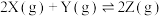 ,减小压强时,对反应产生的影响是
,减小压强时,对反应产生的影响是
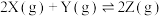 ,减小压强时,对反应产生的影响是
,减小压强时,对反应产生的影响是| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
您最近一年使用:0次
2022-11-02更新
|
741次组卷
|
97卷引用:2016-2017学年甘肃省民乐一中高二上10月月考化学试卷
2016-2017学年甘肃省民乐一中高二上10月月考化学试卷甘肃省岷县一中2018-2019学年高二上学期第一次月考化学试题甘肃省镇原县孟坝中学2018-2019学年高二上学期期中考试化学试题甘肃省张掖市山丹县第一中学2019-2020学年上学期9月月考--高二化学(已下线)2014-2015学年河南周口市沈丘县县直高级中学高二上第一次月考化学2016-2017学年河北省博野中学高二上学期第二次月考化学试卷2016-2017学年宁夏育才中学高二上第一次月考化学卷2016-2017学年贵州省贵阳六中高二上10月月考化学卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷2016-2017学年湖南省浏阳市第一中学高二上阶段性测试化学试卷2016-2017学年山东省桓台二中高二12月检测化学试卷甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高二上学期第一次月考化学试题甘肃省高台县第一中学2018-2019学年高二上学期期中考试化学试题甘肃省宁县二中2018-2019学年高二上学期期中考试化学试题河北省承德市第一中学2018-2019学年高二上学期第三次月考化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二10月月考化学试题湖南省永州市东安县第一中学2019-2020学年高二上学期第一次月考化学试题河北省鹿泉第一中学2019-2020学年高二9月月考化学试题河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题黑龙江省海林市朝鲜族中学2020-2021学年高二上学期第一次月考化学试题海南省海口市第四中学2020-2021学年高二上学期第一次月考化学试题河北省张家口宣化一中2020-2021学年高二上学期12月月考化学试题华中师范大学海南附属中学2019-2020学年高二上学期第三次月考化学试题湖南省长沙宁乡市第十高级中学2020-2021学年高二上学期10月月考化学试题山东省山大附中卧龙学校2021-2022学年高二上学期第一次月考化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期期中考试化学(理)试题四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题广东省揭阳市惠来县第一中学2021-2022学年高二上学期第二次阶段考试化学试题湖北省随州市洛平许济四市联盟2022-2023学年高三上学期第一次质量检测化学试题湖北省黄州中学2022--2023学年高二上学期10月月考化学试题河南省灵宝市第五高级中学2021-2022学年高二下学期第一次月考化学试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(B卷)试题(已下线)2010—2011学年浙江省杭州学军中学高二下学期期中考试化学试卷(已下线)2010—2011学年内蒙古赤峰二中高一下学期期末考试化学试卷(已下线)2011-2012学年山东省鲁北中学高二上学期期中考试化学试卷(已下线)2011-2012学年山东省济宁市邹城二中高二上学期期中质量检测化学试卷(已下线)2011-2012学年云南省玉溪一中高二下学期期中考试化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2012-2013学年江苏省南京三中高二下学期期中考试化学试卷(已下线)2012-2013学年黑龙江省鹤岗一中高一下学期期末考试化学试卷(已下线)2013-2014学年河南省漯河市高二上学期期中考试化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷(已下线)2014秋安徽省淮北师范大学附属实验中学高二上学期期中化学试卷2015-2016学年陕西省西安第七十中学高二上学期期中测试化学试卷2015-2016学年宁夏育才中学高二上学期期中测试化学试卷2015-2016学年青海西宁第十四中学高二上期中考试化学卷2015-2016学年陕西省澄城县寺前中学高一下学期期中考试化学试卷(已下线)同步君 人教版 选修4 第2章 第3节 化学平衡状态2016-2017学年湖北省襄阳五中高二上开学考试化学试卷辽宁省辽源市金鼎高级中学2016-2017学年高二上学期期末考试化学试卷云南省德宏州芒市第一中学2017-2018学年高二上学期期中考试化学试题山东省济南第一中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第二课时(化学平衡状态)【全国省级联考】广东省蓝精灵中学2017-2018 学年度高二上学期期末联考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期中考试化学试题【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期中考试化学试题黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题四川省宜宾市第四中学2018-2019学年高二上学期期中考试理科综合化学试题高二人教版选修4 第二章 第三节 化学平衡新疆维吾尔自治区沙雅县第二中学2018-2019学年高二上学期期中考试化学试题河南省永城市实验高级中学2018-2019学年高二上学期期中考试化学试题辽宁省大连渤海高级中学2018-2019学年高二下学期期中考试化学试题上海市华东师范大学附属天山学校2018-2019学年高一第二学期期中考试化学试题江西省宜春九中(外国语学校)2019-2020学年高二上学期期中考试化学试题吉林省蛟河市朝鲜族中学校2019-2020学年高二上学期期中考试化学试题新疆沙雅县第二中学2019-2020学年高二上学期期中考试化学试题贵州省毕节市实验高级中学2018-2019学年高二上学期期末考试化学试题湖南省邵阳市洞口县第四中学2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第三十二中学2019-2020学年高二上学期期末考试化学试题黑龙江桦南二中2019-2020学年高二上学期期中考试化学试题广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题陕西省延安市吴起高级中学2019-2020学年高一下学期第四次质量检测(期末)化学试题吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素河北省唐山市河北唐山外国语学校2020-2021学年高二上学期期中考试(理科)化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试题黑龙江漠河市高级中学2020-2021学年高二上学期期末考试化学试题湖北省十堰市2020-2021学年高二上学期期末考试化学试题广东省惠州市2020-2021学年高二上学期期末考试化学试题福建省莆田第十五中学2018-2019学年高二上学期期末考试化学试题广东省惠州市2020-2021学年高二上学期期末质量监测化学试题吉林长春市榆树高级中学2019-2020学年高二下学期期末考试化学试题河南省开封市五县2020-2021学年高二上学期期末考试化学试题选择性必修1(SJ)专题2第三单元 化学平衡的移动新疆乌鲁木齐市第三十一中学2021-2022学年高二上学期期中考试化学试题内蒙古乌兰察布市部分学校2021-2022学年高二上学期期中联考化学试题青海省西宁市大通回族土族自治县2021-2022学年高二上学期期末考试化学试题(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)福建省南安市柳城中学2021-2022学年高二上学期期中考试化学试题辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题广东省阳江市高新区2022-2023学年高二上学期1月期末考试化学试题作业(十二) 压强对化学平衡的影响 勒·夏特列原理
名校
4 . 温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
下列说法正确的是
 PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A.反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1 |
| B.保持其他条件不变,若升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0 |
| C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) |
| D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的物质的量大于0.4 mol |
您最近一年使用:0次
2021-11-01更新
|
385次组卷
|
4卷引用:甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(实验班)化学试题
甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(实验班)化学试题(已下线)2021年6月浙江高考化学试题变式题11-20山东省威海乳山市第一中学2022-2023学年高二下学期开学考试化学试题(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(选择题11-16)
12-13高二上·内蒙古巴彦淖尔·阶段练习
名校
5 . 一定量混合气体在一体积可变的密闭容器中发生反应:xA(g)+yB(g) zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1.在恒温下将密闭容器的体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1.在恒温下将密闭容器的体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
 zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1.在恒温下将密闭容器的体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1.在恒温下将密闭容器的体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是| A.平衡向正反应方向移动 | B.x+y<z |
| C.B的转化率升高 | D.C的体积分数降低 |
您最近一年使用:0次
2021-11-01更新
|
200次组卷
|
15卷引用:2016-2017学年甘肃省民乐一中高二上10月月考化学试卷
2016-2017学年甘肃省民乐一中高二上10月月考化学试卷甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(实验班)化学试题(已下线)2012-2013学年内蒙古巴彦淖尔市一中高二9月月考化学试卷2016-2017学年河北省定州二中高二上学期第一次月考化学试卷山西大学附属中学2017-2018学年高二上学期10月模块诊断化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题河南省周口市文昌中学2023-2024学年高三上学期12月月考化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期第三次月考化学试题高二人教版选修4 第二章 第三节 化学平衡安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题云南省景谷一中2018-2019学年高二下学期期末考试化学试题福建省三明市三地三校2020-2021学年高二上学期期中联考化学试题广东省江门市新会第一中学2022-2023学年高二上学期期中考试化学试题(已下线)第七章 化学反应速率与化学平衡 第43练 化学平衡移动原理及应用吉林省吉林市普通高中友好学校2022-2023学年高二上学期期末考试化学试题
6 . 下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
③实验室常用排饱和食盐水的方法收集氯气
④棕红色NO2加压后颜色先变深后变浅
⑤加入催化剂有利于合成氨的反应
⑥向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
③实验室常用排饱和食盐水的方法收集氯气
④棕红色NO2加压后颜色先变深后变浅
⑤加入催化剂有利于合成氨的反应
⑥向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
| A.②⑤ | B.①③⑤ | C.①②⑥ | D.②③④ |
您最近一年使用:0次
7 . 在一定条件下,向2 L恒容密闭容器中加入2 mol X、1 mol Y。发生如下反应:2X(g)+Y 3Z(g);ΔH=-a kJ·mol-1(a>0)。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法错误的是( )
3Z(g);ΔH=-a kJ·mol-1(a>0)。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法错误的是( )
 3Z(g);ΔH=-a kJ·mol-1(a>0)。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法错误的是( )
3Z(g);ΔH=-a kJ·mol-1(a>0)。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法错误的是( )| A.用Z表示的化学反应速率为1.2 mol·L-1·min-1 |
| B.若再充入1 mol Z,重新达到平衡时,X的体积分数不变,则Y为气态 |
| C.达平衡后,实际放出的热量为b kJ,则b=a |
| D.若Y为气态,则使容器体积变为1 L,Z的物质的量不会增大 |
您最近一年使用:0次
2020-10-31更新
|
113次组卷
|
2卷引用:甘肃省庄浪县第一中学2020-2021学年高二上学期第二学段考试化学试题
名校
8 . 如图所示,把NO2和N2O4的混合气体盛在两个连通的烧瓶里,调节左、右两边注射器内活塞,使其高度相等,关闭弹簧夹;同时把一个烧瓶放在热水里,另一个放在冰水里。下列对实验现象的描述错误的是( )。


| A.左边注射器内的活塞高度比右边注射器内的活塞高度要高 |
| B.左边注射器内的活塞与右边注射器内的活塞移动的方向和高度都相同 |
| C.左边烧瓶内的颜色比右边烧瓶内的颜色深 |
| D.两烧瓶内的化学平衡都发生了移动 |
您最近一年使用:0次
10-11高二上·湖北黄冈·期中
名校
9 . 对封闭体系已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥可能使用了正催化剂
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥可能使用了正催化剂
| A.②⑤ | B.①② | C.③⑤ | D.⑤⑥ |
您最近一年使用:0次
2020-10-11更新
|
173次组卷
|
24卷引用:甘肃省武威市河西成功学校2018-2019学年高二上学期第一次测试化学试题
甘肃省武威市河西成功学校2018-2019学年高二上学期第一次测试化学试题(已下线)2013-2014湖北省沙市中学高二上学期第七次周练化学试卷2015-2016学年广东湛江第一中学高二上第二次考试化学卷2016-2017学年四川省成都开发区实验中学高二10月月考化学卷黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题山西省实验中学2017-2018学年高二上学期10月月考化学试题黑龙江省哈尔滨市第三中学2018届高三上学期(10月)第二次验收考试化学试题山西大学附属中学2019-2020学年高二10月月考化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高二10月月考化学试题黑龙江哈尔滨师范大学附属中学中2020-2021学年高二上学期第一次月考化学试题山东省莱州市第一中学2020-2021学年高二上学期10月月考化学试题山西省阳泉市盂县第三中学2021届高三上学期第一次月考化学试题陕西省西安市长安区第一中学2020-2021学年高二上学期第一次教学质量检测化学试题山东省滕州市第五中学2021-2022学年高二上学期第一次单元测试化学试题福建省宁德第一中学2022-2023学年高二上学期第二次月考化学试题(已下线)2010年湖北省黄冈中学高二上学期期中考试试题化学(已下线)2011-2012年学福建省永安一中高二上学期期中考试化学试卷(已下线)2012-2013学年黑龙江省哈三中高二上学期期中考试化学试卷(已下线)2015届黑龙江省牡丹江第一高中高二上学期期中考试化学(理)试卷辽宁省大连渤海高级中学2018-2019学年高二下学期期中考试化学试题福建省建瓯市芝华中学2019-2020学年高二上学期期中考试化学(1-2班)试题河南省郑州市第一中学2019-2020学年高二上学期入学测试化学试题河南省林州市第一中学2020-2021学年高二上学期开学考试化学试题安徽省蚌埠市田家炳中学、五中2019-2020学年高二上学期期中考试化学试题
名校
解题方法
10 . 丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+ O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___ 。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___ ;该反应的平衡常数Kp=___ Pa。若提高C3H8的平衡转化率,可采取的措施有___ (填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
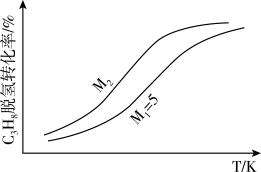
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___ 5(填“>”或“<”)。
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___ 。反应气中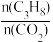 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时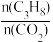 的配比是
的配比是___ 。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+
 O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/molH2(g)+
 O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2

(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是
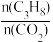 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时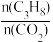 的配比是
的配比是 | C3H8转化率(%) | C3H6选择性(%) | C3H6收率(%) |
| 1:1.3 | 14.8 | 85.1 | 12.6 |
| 1:2.4 | 23.2 | 82.8 | |
| 1:3.6 | 22.8 | 83.5 | |
| 1:6.8 | 18.0 | 60.3 | 10.9 |
您最近一年使用:0次
2020-06-17更新
|
354次组卷
|
2卷引用:甘肃省武威第六中学2020届高三下学期第六次诊断考试化学试题



