1 . 黑火药是我国四大发明之一,它爆炸时发生多种化学反应,其中主要的化学反应方程式为:
(1)反应物中被称为“中国盐”的化学式是_______ 。生成物中属于非电解质的电子式是_______ 。收集黑火药爆炸后的烟尘与酸性高锰酸钾溶液反应,能使溶液紫红色褪去,烟尘中能使酸性高锰酸钾溶液褪色的物质名称是_______ 。
(2)反应中,还原剂是_______ ,被还原的元素是_______ 。每生成 氧化产物,转移的电子数是
氧化产物,转移的电子数是_______  ,消耗
,消耗 的质量为
的质量为_______ g(保留1位小数)。
(3)有人提出将 通过管道输送到海底,可减缓空气中
通过管道输送到海底,可减缓空气中 浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。结合必要的化学用语,简要分析海水酸性增强的原因
浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。结合必要的化学用语,简要分析海水酸性增强的原因_______ 。

(1)反应物中被称为“中国盐”的化学式是
(2)反应中,还原剂是
 氧化产物,转移的电子数是
氧化产物,转移的电子数是 ,消耗
,消耗 的质量为
的质量为(3)有人提出将
 通过管道输送到海底,可减缓空气中
通过管道输送到海底,可减缓空气中 浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。结合必要的化学用语,简要分析海水酸性增强的原因
浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。结合必要的化学用语,简要分析海水酸性增强的原因
您最近一年使用:0次
2 . 在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6kJ·mol-1,下表列出了不同温度和压强下,反应达到平衡时SO2的转化率
2SO3(g) ΔH=-196.6kJ·mol-1,下表列出了不同温度和压强下,反应达到平衡时SO2的转化率
(1)在生产中常用过量的空气是为了___________
(2)在实际生产中,操作温度选定400—500℃,是因为___________
(3)硫酸工业选定压强通常采用常压,做出这种选择的依据是___________
 2SO3(g) ΔH=-196.6kJ·mol-1,下表列出了不同温度和压强下,反应达到平衡时SO2的转化率
2SO3(g) ΔH=-196.6kJ·mol-1,下表列出了不同温度和压强下,反应达到平衡时SO2的转化率| 温度\压强 | 1×105Pa | 5×105Pa | 1×106Pa | 1×107Pa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
(2)在实际生产中,操作温度选定400—500℃,是因为
(3)硫酸工业选定压强通常采用常压,做出这种选择的依据是
您最近一年使用:0次
2021-11-21更新
|
359次组卷
|
3卷引用:浙江省温州新力量联盟2021-2022学年高二上学期期中联考化学试题
解题方法
3 . 大气、水体常见污染元素主要有氮、硫。含氮废气、废液处理是化学学科重要研究课题。
(1)在含 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是___ 。
(2)用NaClO可以将氨氮(NH3、NH )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式___ 。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。
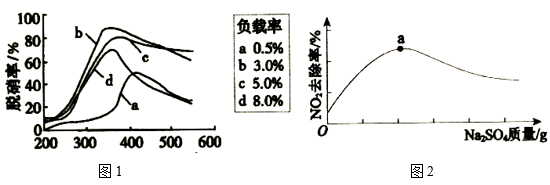
为达到最佳的脱硝效果,应采取的反应条件为___ (填温度和负载率数值)。
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+ (aq)
(aq) CaSO4(s)+
CaSO4(s)+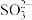 (aq)
(aq)
Ⅱ.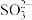 (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq)
浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是___ 。
(1)在含
 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是(2)用NaClO可以将氨氮(NH3、NH
 )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。

为达到最佳的脱硝效果,应采取的反应条件为
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+
 (aq)
(aq) CaSO4(s)+
CaSO4(s)+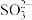 (aq)
(aq)Ⅱ.
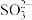 (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq) 浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是
您最近一年使用:0次
2021-06-30更新
|
141次组卷
|
2卷引用:江苏省宿迁市2020-2021学年高二下学期期末考试化学试题
20-21高三下·浙江·阶段练习
4 . 硫酸在国民经济中占有极其重要的地位,工业上常用黄铁矿为原料接触法制硫酸。
(1)写出黄铁矿(FeS2)在沸腾炉中与氧气发生反应的化学方程式_______ 。
(2)硫酸的生产中,下列说法不正确的是_______ 。
A.把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高原料的利用率
B.气体在进接触室前要先净化,可防止催化剂中毒
C.接触室中反应采用400-500°C,主要是因为提高原料的平衡转化率
D.吸收塔中操作采取逆的形式,SO3从下而上,水从上而喷下
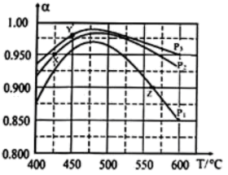
(3)分别将1mol的SO2(g)、1.45mol的O2(g)通入p1、p2和p3恒压容器中发生反应: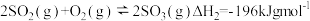 ,相同时间内测得SO2的转化率α随温度的变化如图所示。(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp如p(B)=px(B),p为平衡总压强,x(B为平衡系统中B的物质的量分数)。
,相同时间内测得SO2的转化率α随温度的变化如图所示。(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp如p(B)=px(B),p为平衡总压强,x(B为平衡系统中B的物质的量分数)。
请回答:
①据图判断p1、p2、p3的大小关系_______ 。
②判断X、Y、Z中属于平衡点的是_______ (填“X”、 “Y”、 “Z”),并计算该温度下平衡的Kp=_______ 。(用含p1或p2或p3的式子表示)。
(4)为减少SO2的排放,工业上常将SO2转化为CaSO4固定,但存在CO又会同时发生以下两个反应:
①恒容、恒温(T1)条件下,反应体系中c(SO2)随时间t变化的总趋势如图。结合已知信息分析c(SO2)浓度随时间t变化的原因_______ 。
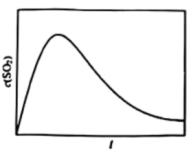
②恒容、恒温(T2,T2>T1)条件下,请在图中画出T2条件下c(SO2)浓度随时间t变化图_______ 。
(1)写出黄铁矿(FeS2)在沸腾炉中与氧气发生反应的化学方程式
(2)硫酸的生产中,下列说法不正确的是
A.把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高原料的利用率
B.气体在进接触室前要先净化,可防止催化剂中毒
C.接触室中反应采用400-500°C,主要是因为提高原料的平衡转化率
D.吸收塔中操作采取逆的形式,SO3从下而上,水从上而喷下
(3)分别将1mol的SO2(g)、1.45mol的O2(g)通入p1、p2和p3恒压容器中发生反应:
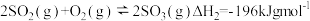 ,相同时间内测得SO2的转化率α随温度的变化如图所示。(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp如p(B)=px(B),p为平衡总压强,x(B为平衡系统中B的物质的量分数)。
,相同时间内测得SO2的转化率α随温度的变化如图所示。(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp如p(B)=px(B),p为平衡总压强,x(B为平衡系统中B的物质的量分数)。
请回答:
①据图判断p1、p2、p3的大小关系
②判断X、Y、Z中属于平衡点的是
(4)为减少SO2的排放,工业上常将SO2转化为CaSO4固定,但存在CO又会同时发生以下两个反应:
| 反应 | 活化能 | 平衡常数 | |
| I | 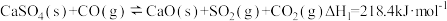 | EaI | KI |
| II | 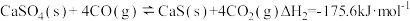 | EaII(EaII>EaI) | KII(KI>KII) |

②恒容、恒温(T2,T2>T1)条件下,请在图中画出T2条件下c(SO2)浓度随时间t变化图
您最近一年使用:0次
20-21高三下·浙江·阶段练习
解题方法
5 . (1)正戊烷和新戊烷互为同分异构体,但正戊烷的沸点(36.07℃)高于新戊烷的沸点(9.5℃)主要原因是___________
(2)工业上,钾是用钠和KCl在一定的条件下反应制取:Na+KCl=NaCl+K↑,有关数据如下:
①上述反应需要控制的温度范围是___________
②金属钠比金属钾熔沸点高的原因是___________
(2)工业上,钾是用钠和KCl在一定的条件下反应制取:Na+KCl=NaCl+K↑,有关数据如下:
| Na | K | NaCl | KCl | |
| 熔点/℃ | 97.8 | 63.7 | 801 | 770 |
| 沸点/℃ | 882.9 | 774 | 1413 | 1500(升华) |
②金属钠比金属钾熔沸点高的原因是
您最近一年使用:0次
名校
解题方法
6 . 近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)  pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成。回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成。回答下列问题:
(1)反应2 min内,vA=___________ ,vB=___________ ;
(2)反应平衡时,D为2a mol,则B的转化率为___________ ;
(3)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH___________ 0(填“>”、“<” 或“=”);
(4) 如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率___________ (填“增大”、“减小”或“不变”)
②平衡时反应物的转化率___________ (填“增大”、“减小”或“不变”)
 pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成。回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成。回答下列问题:(1)反应2 min内,vA=
(2)反应平衡时,D为2a mol,则B的转化率为
(3)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH
(4) 如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率
②平衡时反应物的转化率
您最近一年使用:0次
解题方法
7 . (1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)⇌2N2O5(g)。(不考虑NO2的分解) 若已知该反应是放热反应,则K550℃_______ K350℃(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______ ,NO2的转化率_______ 。(填“增大”“减小”或“不变”)
(2)某温度下,在容积恒定的密闭容器中充入1mol的NO2(g),发生反应2NO2(g)⇌N2O4(g),达到平衡。再次充入一定量的NO2(g),重新达到平衡后,NO2(g)的浓度_______ ,NO2(g)在混合气体中所占的体积分数_______ 。(填“增大”“减小”或“不变”)
(2)某温度下,在容积恒定的密闭容器中充入1mol的NO2(g),发生反应2NO2(g)⇌N2O4(g),达到平衡。再次充入一定量的NO2(g),重新达到平衡后,NO2(g)的浓度
您最近一年使用:0次
2021-04-25更新
|
198次组卷
|
3卷引用:第二章 第三节化学平衡(第3课时 化学平衡常数)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)
(已下线)第二章 第三节化学平衡(第3课时 化学平衡常数)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)江苏省南通市海门实验学校2020-2021学年高二上学期期中考试化学试题江苏省淮安市高中校协作体2021-2022学年高二下学期期中考试化学试题
名校
8 . 在密闭容器中发生如下反应C (s)+H2O(g ) CO(g)+H2(g)△H>0;达到平衡后,改变下列条件,判断平衡移动的方向(正反应方向、逆反应方向、不移动)
CO(g)+H2(g)△H>0;达到平衡后,改变下列条件,判断平衡移动的方向(正反应方向、逆反应方向、不移动)
(1)升高温度,平衡___________ 移动;
(2)增大压强,平衡___________ 移动;
(3)增大H2(g)浓度,平衡___________ 移动;加入C,平衡___________ 移动;
(4)加入催化剂,平衡___________ 移动。
(5)若要提高H2O(g)的转化率和化学反应速率可采取的措施___________ 。
 CO(g)+H2(g)△H>0;达到平衡后,改变下列条件,判断平衡移动的方向(正反应方向、逆反应方向、不移动)
CO(g)+H2(g)△H>0;达到平衡后,改变下列条件,判断平衡移动的方向(正反应方向、逆反应方向、不移动)(1)升高温度,平衡
(2)增大压强,平衡
(3)增大H2(g)浓度,平衡
(4)加入催化剂,平衡
(5)若要提高H2O(g)的转化率和化学反应速率可采取的措施
您最近一年使用:0次
2021-01-12更新
|
608次组卷
|
2卷引用:湖北省华中师范大学潜江附属中学2020-2021学年高一下学期5月月考化学试题
13-14高二·全国·课时练习
名校
解题方法
9 . 在一个2 L的密闭容器中,加入3 mol A和1 mol B,发生下述反应:3A(g)+B(g)  2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为________ ,此温度下的平衡常数K=_______________ 。(保留一位小数)
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向________ (填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比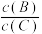 将
将________ (填“增大”、“减小”或“不变”)。
(4)当增加A的浓度,B的转化率________ ;若将C分离出来,化学平衡常数________ 。(填“增大”、“减小”或“不变”)
 2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。(1)达到平衡时,A的转化率为
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比
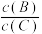 将
将(4)当增加A的浓度,B的转化率
您最近一年使用:0次
2020-10-11更新
|
600次组卷
|
8卷引用:陕西省咸阳百灵学校2020-2021学年高二下学期第一次月考化学试题
陕西省咸阳百灵学校2020-2021学年高二下学期第一次月考化学试题(已下线)期中测试卷01-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)(已下线)2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷湖北省宜昌市葛洲坝中学2017-2018学年高二9月月考化学试题四川省自贡市田家炳中学2019-2020学年高二上学期期中考试化学试题江西省赣州市赣县区第三中学2020-2021学年高二上学期强化训练(一)化学试题河北省唐山市遵化市2020-2021学年高二上学期期中考试化学试题(已下线)BBWYhjhx1104.pdf
12-13高一下·辽宁·期末
10 . 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O 2CrO42-+2H+,把重铬酸钾溶于水配成稀溶液是橙色的。
2CrO42-+2H+,把重铬酸钾溶于水配成稀溶液是橙色的。
(1)向上述溶液中加入NaOH溶液,溶液呈__________ 色,因为_________ 。
(2)向已加入NaOH溶液的1中再加入过量稀硫酸,则溶液呈__________ 色,因为__________ 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡____________________ ,溶液颜色将____________________ 。
 2CrO42-+2H+,把重铬酸钾溶于水配成稀溶液是橙色的。
2CrO42-+2H+,把重铬酸钾溶于水配成稀溶液是橙色的。(1)向上述溶液中加入NaOH溶液,溶液呈
(2)向已加入NaOH溶液的1中再加入过量稀硫酸,则溶液呈
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡
您最近一年使用:0次
2019-12-02更新
|
92次组卷
|
10卷引用:2.3.1 浓度、压强变化对化学平衡的影响(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
(已下线)2.3.1 浓度、压强变化对化学平衡的影响(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)2012-2013学年辽宁省辽河油田第二高中高一下学期期末考试化学试卷2016-2017学年甘肃省兰州一中高二上期中理化学试卷【校级联考】安徽省滁州市定远县西片区2018-2019学年高二上学期期中考试化学试题河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题海南省海南鑫源高级中学2019-2020学年高二上学期期末考试化学试题(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)作业(十一) 温度、浓度对化学平衡的影响第二章 化学反应速率与化学平衡 第二节 化学平衡 第3课时 影响化学平衡的因素



