名校
1 . 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一、
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
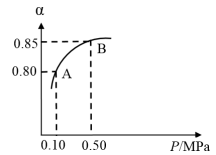
(1)写出该反应的化学平衡常数表达式:___________ 。
(2)将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于___________ 。
(3)平衡状态由A变到B时,平衡常数K(A)___________ K(B)(填“>”、“<”或“=”)。
(4)Ⅱ.用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH =-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2整个过程中转移的电子总数为___________ ,放出的热量为:___________ kJ。
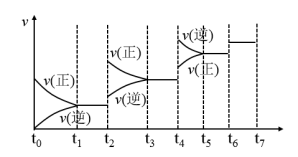
(5)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是
Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是___________ ;图中表示平衡混合物中CO的含量最高的一段时间是___________ 。
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
 2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
(1)写出该反应的化学平衡常数表达式:
(2)将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于
(3)平衡状态由A变到B时,平衡常数K(A)
(4)Ⅱ.用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH =-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2整个过程中转移的电子总数为
(5)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是
Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是
您最近一年使用:0次
2021-12-04更新
|
154次组卷
|
4卷引用:江西省九校2021-2022学年高二上学期期中联考化学试题
2 . 甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)。
(1)容器I中的反应达到平衡时所需的时间_____ (填“大于”“小于”或等于)容器III中的。
(2)a=___________
(3)下列说法中能说明该反应达到平衡状态的是___________。(填字母)
(4)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH=-mkJ·mol-1
反应②:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH=-nkJ·mol-1
则下列m与n的关系中,正确的是___________(填字母)。
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| II | 387 | 0.40 | a | b |
| III | 207 | 0.20 | 0.090 | 0.090 |
(1)容器I中的反应达到平衡时所需的时间
(2)a=
(3)下列说法中能说明该反应达到平衡状态的是___________。(填字母)
| A.容器中压强不变 |
| B.混合气体中c(CH3OCH3)不变 |
| C.混合气体的密度不变 |
| D.单位时间内生成1mol CH3OCH3同时消耗2mol CH3OH |
反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH=-mkJ·mol-1
反应②:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH=-nkJ·mol-1
则下列m与n的关系中,正确的是___________(填字母)。
| A.n﹥2m | B.m﹥2n | C.2m﹥n | D.m﹥3n |
您最近一年使用:0次
名校
3 . 二甲醚(DME)正逐渐替代化石燃料。有多种方法制备二甲醚,回答下列问题。
(1)合成气制二甲醚:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1
①已知:H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1,H2(g)的燃烧热ΔH=-285.8 kJ·mol-1,CO(g)的燃烧热ΔH=-283.0 kJ·mol-1。则二甲醚的燃烧热ΔH=________ kJ·mol-1。
②300 ℃,1 L恒容密闭容器中充入4 mol H2和2 mol CO,测得容器内压强变化如下:
反应进行到20 min时,H2的转化率为________ ,CO的平均反应速率v(CO)=________ mol·L-1·min-1。该温度下的平衡常数K=________ (mol·L)-4。
(2)CO2催化加氢制二甲醚,可以实现CO2的再利用。该过程主要发生如下反应:
Ⅰ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.7 kJ·mol-1
CO(g)+H2O(g) ΔH=+41.7 kJ·mol-1
Ⅱ.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
恒压条件下,CO2、H2起始量相等时,CO2的平衡转化率和CH3OCH3的选择性随温度变化如图。已知:CH3OCH3的选择性

①300 ℃时,通入CO2、H2各1 mol,平衡时CH3OCH3的选择性、CO2的平衡转化率都为30%,平衡时生成CH3OCH3的物质的量=________ mol。温度高于300 ℃,CO2的平衡转化率随温度升高而上升的原因是________ 。
②220 ℃时,CO2和H2反应一段时间后,测得A点CH3OCH3的选择性为48%,不改变反应时间和温度,一定能提高CH3OCH3的选择性的措施有________ 。
(1)合成气制二甲醚:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1①已知:H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1,H2(g)的燃烧热ΔH=-285.8 kJ·mol-1,CO(g)的燃烧热ΔH=-283.0 kJ·mol-1。则二甲醚的燃烧热ΔH=
②300 ℃,1 L恒容密闭容器中充入4 mol H2和2 mol CO,测得容器内压强变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
(2)CO2催化加氢制二甲醚,可以实现CO2的再利用。该过程主要发生如下反应:
Ⅰ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.7 kJ·mol-1
CO(g)+H2O(g) ΔH=+41.7 kJ·mol-1Ⅱ.2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1恒压条件下,CO2、H2起始量相等时,CO2的平衡转化率和CH3OCH3的选择性随温度变化如图。已知:CH3OCH3的选择性


①300 ℃时,通入CO2、H2各1 mol,平衡时CH3OCH3的选择性、CO2的平衡转化率都为30%,平衡时生成CH3OCH3的物质的量=
②220 ℃时,CO2和H2反应一段时间后,测得A点CH3OCH3的选择性为48%,不改变反应时间和温度,一定能提高CH3OCH3的选择性的措施有
您最近一年使用:0次
2021-07-20更新
|
721次组卷
|
4卷引用:重庆市第十一中学校2021届高三下学期4月二诊化学试题
重庆市第十一中学校2021届高三下学期4月二诊化学试题2021年河北省高考化学试卷变式题10-18题湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题(已下线)第12讲 化学反应的调控-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
解题方法
4 . I.甲醇水蒸气重整制氢(SRM)系统简单,产物中H2含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。其反应如下:
反应1(主):
反应2(副):
温度高于300C则会同时发生反应3: ,回答下列问题:
,回答下列问题:
(1)反应1能够自发进行的原因是_______ 。
(2)升温有利于提高CH3OH转化率,但也存在一个明显的缺点是_______ 。
II.甲制取低碳烯烃技术(DMTO)项目曾摘取了2014年度国家技术发明奖一等奖。DMTO主要包括煤的气化、液化、烯烃化三个阶段。回答下列问题:
(1)煤的气化。用化学方程式表示煤的气化的主要反应_______ 。
(2)煤的液化。下表中某些反应是煤的液化过程中的反应:
①反应I的平衡常数表达式K1=_______ ;
②b_______ 0(填“>”“<”或“=”),c与a、b之间的定量关系为_______ 。
③K3=_______ ,若反应Ⅲ是在500℃、容积为2L的密闭容器中进行的,测得某一时刻体系内 的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率
的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率_______ (填“>”“<”或“=”)CH3OH的消耗速率。
④对于反应III,在一容积不变的密闭容器中,下列措施可增加甲醇产率的是_______
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
(3)烯烃化阶段。图1是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比。图中I、II表示乙烯,III表示丙烯)。
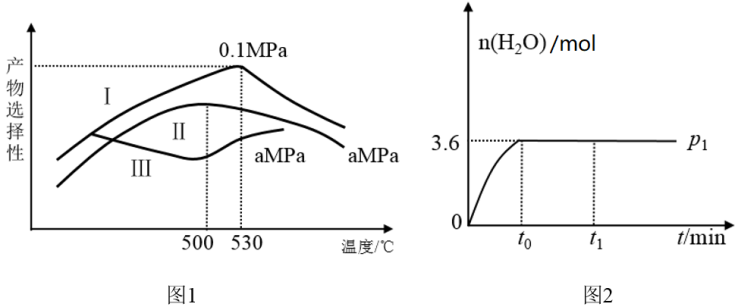
①为尽可能的获得乙烯,控制的生产条件为_______
②一定温度下某密闭容器中存在反应: 。在压强为P1时产物水的物质的量与时间的关系如图2所示,若t0时刻测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为
。在压强为P1时产物水的物质的量与时间的关系如图2所示,若t0时刻测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为_______ (保留三位有效数字)。
反应1(主):

反应2(副):

温度高于300C则会同时发生反应3:
 ,回答下列问题:
,回答下列问题:(1)反应1能够自发进行的原因是
(2)升温有利于提高CH3OH转化率,但也存在一个明显的缺点是
II.甲制取低碳烯烃技术(DMTO)项目曾摘取了2014年度国家技术发明奖一等奖。DMTO主要包括煤的气化、液化、烯烃化三个阶段。回答下列问题:
(1)煤的气化。用化学方程式表示煤的气化的主要反应
(2)煤的液化。下表中某些反应是煤的液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
I. | 2.0 | 0.2 |
II. | 1.0 | 2.3 |
III. | K3 | 4.6 |
①反应I的平衡常数表达式K1=
②b
③K3=
 的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率
的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率④对于反应III,在一容积不变的密闭容器中,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
(3)烯烃化阶段。图1是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比。图中I、II表示乙烯,III表示丙烯)。

①为尽可能的获得乙烯,控制的生产条件为
②一定温度下某密闭容器中存在反应:
 。在压强为P1时产物水的物质的量与时间的关系如图2所示,若t0时刻测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为
。在压强为P1时产物水的物质的量与时间的关系如图2所示,若t0时刻测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为
您最近一年使用:0次
5 . “碳中和”引起各国的高度重视,正成为科学家研究的主要课题,综合利用 、
、 对构建低碳社会有重要意义。
对构建低碳社会有重要意义。
(1)利用 与
与 制备合成气
制备合成气 、
、 ,可能的反应历程为:
,可能的反应历程为:
反应①:
②: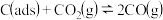
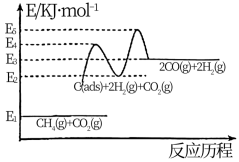
说明: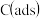 为吸附性活性炭,
为吸附性活性炭, 为对应物质的总能量
为对应物质的总能量
①利用 与
与 制备合成气
制备合成气 、
、 的总反应的热化学方程式为
的总反应的热化学方程式为_______ 。
②该反应历程中决定反应速率快慢的是(填“反应①”或“反应②”)_______ ,据图中所示,理由是_______ 。
(2)工业上用 和
和 合成甲醇:
合成甲醇: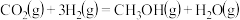
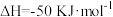 。一定条件下,向容积均为
。一定条件下,向容积均为 的恒容密闭容器中通入
的恒容密闭容器中通入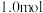
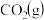 和
和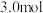
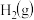 ,在不同催化剂
,在不同催化剂 、
、 的催化下发生反应。测得
的催化下发生反应。测得 时,
时, 转化率与温度的变化关系如图实线所示(虚线表示
转化率与温度的变化关系如图实线所示(虚线表示 平衡转化率)。
平衡转化率)。
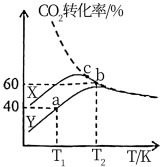
①该反应选用的适宜催化剂为_______ (填“ ”或“
”或“ ”)。
”)。
② 时,
时, 点对应容器在
点对应容器在 内的平均反应速率
内的平均反应速率
_______ 。
③ 、
、 点对应状态下反应物的有效碰撞几率
点对应状态下反应物的有效碰撞几率
_______  (填“>”“<”或“。”),
(填“>”“<”或“。”),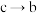 段
段 转化率减小的原因是
转化率减小的原因是_______ 。
④ 时,该反应平衡常数
时,该反应平衡常数
_______ (保留三位有效数字),保持温度不变,向容器中再充入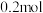
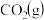 、
、
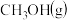 ,平衡将
,平衡将_______ 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
 、
、 对构建低碳社会有重要意义。
对构建低碳社会有重要意义。(1)利用
 与
与 制备合成气
制备合成气 、
、 ,可能的反应历程为:
,可能的反应历程为:反应①:
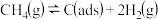
②:
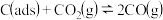

说明:
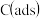 为吸附性活性炭,
为吸附性活性炭, 为对应物质的总能量
为对应物质的总能量①利用
 与
与 制备合成气
制备合成气 、
、 的总反应的热化学方程式为
的总反应的热化学方程式为②该反应历程中决定反应速率快慢的是(填“反应①”或“反应②”)
(2)工业上用
 和
和 合成甲醇:
合成甲醇: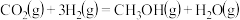
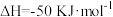 。一定条件下,向容积均为
。一定条件下,向容积均为 的恒容密闭容器中通入
的恒容密闭容器中通入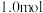
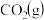 和
和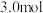
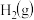 ,在不同催化剂
,在不同催化剂 、
、 的催化下发生反应。测得
的催化下发生反应。测得 时,
时, 转化率与温度的变化关系如图实线所示(虚线表示
转化率与温度的变化关系如图实线所示(虚线表示 平衡转化率)。
平衡转化率)。
①该反应选用的适宜催化剂为
 ”或“
”或“ ”)。
”)。②
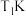 时,
时, 点对应容器在
点对应容器在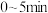 内的平均反应速率
内的平均反应速率
③
 、
、 点对应状态下反应物的有效碰撞几率
点对应状态下反应物的有效碰撞几率
 (填“>”“<”或“。”),
(填“>”“<”或“。”),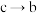 段
段 转化率减小的原因是
转化率减小的原因是④
 时,该反应平衡常数
时,该反应平衡常数
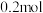
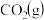 、
、
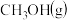 ,平衡将
,平衡将
您最近一年使用:0次
解题方法
6 . 异丁烯为重要的化工原料,工业上可采用叔丁醇(TBA)气相脱水法制备高纯异丁烯产品,主要涉及以下反应:
反应1(主反应):
反应2(副反应):
(1)副反应产物 的系统命名为
的系统命名为___________ 。
(2)标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,几种物质的标准生成焓如表,求反应1的
___________  。
。
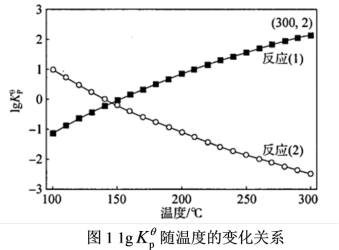
(3)根据,该脱水反应的标准平衡常数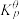 随温度的变化关系如图1所示,则反应2的
随温度的变化关系如图1所示,则反应2的
___________ 0(填“<”或“>”),向体积可变容器中充入1mol的叔丁醇,容器体积为1L,保持300℃100kPa条件,反应一段时间后达到平衡(忽略副反应),则
___________ (已知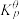 为以标准分压表示的平衡常数,各组分的标准分压
为以标准分压表示的平衡常数,各组分的标准分压 ,
,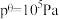 )。
)。
(4)理论计算反应条件对叔丁醇转化率的影响如图2、3所示,脱水反应温度 ℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因
℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因___________ 。根据图示该脱水反应适宜采用条件为 ℃,P=
℃,P=___________ MPa,N2/叔丁醇摩尔比=3/1。


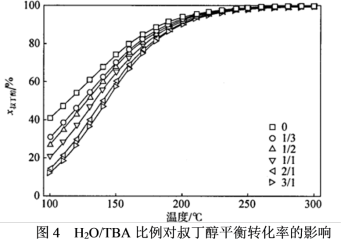
(5)已知工业原料叔丁醇中存在不同含量的水分,相同温度下不同初始原料中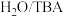 比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为
比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为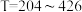 ℃,请从
℃,请从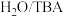 比例角度分析该条件下的优点
比例角度分析该条件下的优点___________ 。
反应1(主反应):

反应2(副反应):

(1)副反应产物
 的系统命名为
的系统命名为(2)标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,几种物质的标准生成焓如表,求反应1的

 。
。| 组分 |  | 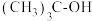 | 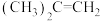 |
焓变/ | -241.83 | -339.21 | -17.1 |
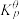 随温度的变化关系如图1所示,则反应2的
随温度的变化关系如图1所示,则反应2的

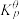 为以标准分压表示的平衡常数,各组分的标准分压
为以标准分压表示的平衡常数,各组分的标准分压 ,
,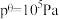 )。
)。
(4)理论计算反应条件对叔丁醇转化率的影响如图2、3所示,脱水反应温度
 ℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因
℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因 ℃,P=
℃,P=

(5)已知工业原料叔丁醇中存在不同含量的水分,相同温度下不同初始原料中
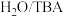 比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为
比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为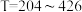 ℃,请从
℃,请从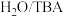 比例角度分析该条件下的优点
比例角度分析该条件下的优点
您最近一年使用:0次
解题方法
7 . 研究 、
、 等污染物的资源化利用有重要意义。
等污染物的资源化利用有重要意义。
(1)用 可以合成甲醇。已知:
可以合成甲醇。已知:
①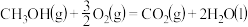
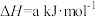
②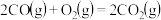
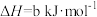
③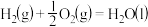
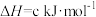
则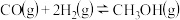

_______  。
。
(2)在一定压强下,向某密闭容器中充入
 与
与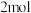
 ,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示,c时容器体积恰为
,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示,c时容器体积恰为 。
。
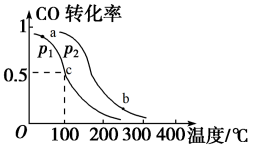
①
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②对比a和b的正反应速率,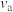
_______ 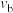 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③100℃时,该反应的化学平衡常数
_______ 。
(3)下列措施中能够增大甲醇平衡产率的是_______ (填写序号)。
A.使用高效催化剂 B.降低反应温度
C.压缩体积,增大压强 D.升高反应温度
(4)实验室用氢氧化钠吸收尾气中的二氧化硫。将过量的 通入
通入 溶液的化学方程式是
溶液的化学方程式是____ ,经测定, 溶液呈弱碱性,而
溶液呈弱碱性,而 溶液呈弱酸性,请从化学平衡的角度解释
溶液呈弱酸性,请从化学平衡的角度解释 溶液呈弱酸性的原因
溶液呈弱酸性的原因____ 。
(5)已知常温下, 、
、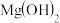 溶度积常数分别为
溶度积常数分别为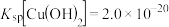 ;
;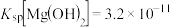 ,向浓度均为
,向浓度均为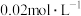 的
的 和
和 混合溶液中逐滴加入
混合溶液中逐滴加入 溶液,首先生成
溶液,首先生成_______ 沉淀(填化学式);当两种沉淀共存时,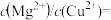
_______ 。
 、
、 等污染物的资源化利用有重要意义。
等污染物的资源化利用有重要意义。(1)用
 可以合成甲醇。已知:
可以合成甲醇。已知:①
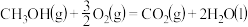
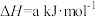
②
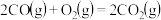
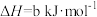
③
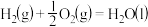
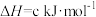
则
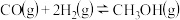

 。
。(2)在一定压强下,向某密闭容器中充入

 与
与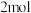
 ,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示,c时容器体积恰为
,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示,c时容器体积恰为 。
。
①

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②对比a和b的正反应速率,
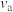
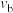 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。③100℃时,该反应的化学平衡常数

(3)下列措施中能够增大甲醇平衡产率的是
A.使用高效催化剂 B.降低反应温度
C.压缩体积,增大压强 D.升高反应温度
(4)实验室用氢氧化钠吸收尾气中的二氧化硫。将过量的
 通入
通入 溶液的化学方程式是
溶液的化学方程式是 溶液呈弱碱性,而
溶液呈弱碱性,而 溶液呈弱酸性,请从化学平衡的角度解释
溶液呈弱酸性,请从化学平衡的角度解释 溶液呈弱酸性的原因
溶液呈弱酸性的原因(5)已知常温下,
 、
、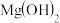 溶度积常数分别为
溶度积常数分别为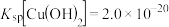 ;
;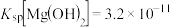 ,向浓度均为
,向浓度均为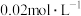 的
的 和
和 混合溶液中逐滴加入
混合溶液中逐滴加入 溶液,首先生成
溶液,首先生成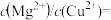
您最近一年使用:0次
解题方法
8 . Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。
I∶地康法制取氯气的反应为4HCl+O2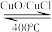 2Cl2+2H2O
2Cl2+2H2O
(1)已知400℃时反应物4molHCl(g)和1molO2 (g)总能量为akJ,生成物2molCl2 (g)和2molH2O (g)总能量为bkJ,其中a大于b。
①写出400℃时,地康法制取氯气的热化学方程式∶___________ 。
②下列有关地康法制取氯气说法正确的是___________ 。
A.使用催化剂或升高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
B.催化剂可以降低正逆反应的活化能,从而改变反应的焓变
C.选择温度为400℃,主要考虑此温度下催化剂活性高,反应速率快
D.达到化学平衡时,正反应和逆反应的速率相等且为零
(2)保持恒温恒容条件,将物质的量之和为5mol的HCl和O2以不同的氯氧比[n(HCl])/n(O2)]进行反应,平衡时某反应物的转化率与氯氧比及不同温度的关系如图所示∶

①图中纵坐标表示___________ 的转化率(填“HCl”或“O2”)。
②图中T1、 T2的关系为∶ T1___________ T2(填 “>”、“<” 或“=”)。
③若容器容积为2L,则A点的平衡常数的值为___________ 。
II∶电解法是制备氯气的常用方法,离子交换膜法电解食盐水如上图。
①请写出阳极的电极反应式∶___________ 。
②离子交换膜法所选择的是交换膜___________ (填“阳离子”或“阴离子”)。
I∶地康法制取氯气的反应为4HCl+O2
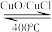 2Cl2+2H2O
2Cl2+2H2O(1)已知400℃时反应物4molHCl(g)和1molO2 (g)总能量为akJ,生成物2molCl2 (g)和2molH2O (g)总能量为bkJ,其中a大于b。
①写出400℃时,地康法制取氯气的热化学方程式∶
②下列有关地康法制取氯气说法正确的是
A.使用催化剂或升高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
B.催化剂可以降低正逆反应的活化能,从而改变反应的焓变
C.选择温度为400℃,主要考虑此温度下催化剂活性高,反应速率快
D.达到化学平衡时,正反应和逆反应的速率相等且为零
(2)保持恒温恒容条件,将物质的量之和为5mol的HCl和O2以不同的氯氧比[n(HCl])/n(O2)]进行反应,平衡时某反应物的转化率与氯氧比及不同温度的关系如图所示∶

①图中纵坐标表示
②图中T1、 T2的关系为∶ T1
③若容器容积为2L,则A点的平衡常数的值为
II∶电解法是制备氯气的常用方法,离子交换膜法电解食盐水如上图。
①请写出阳极的电极反应式∶
②离子交换膜法所选择的是交换膜
您最近一年使用:0次
解题方法
9 . 在4月22日的领导人气候峰会上,习主席表示,中国将力争2030年前实现碳达峰、2060年前实现碳中和。其中 、
、 的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:
的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:
(1)室温下, 溶液呈碱性的原因是
溶液呈碱性的原因是___________ (用离子方程式表示)。
(2)已知: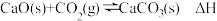
①
___________ 0(填或“<”、“=”或“<”)
②分别将20g、40g的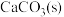 放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡(
放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡( 都未完全分解),则两容器中分解的
都未完全分解),则两容器中分解的 的物质的量关系:
的物质的量关系:
___________ 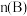 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(3)利用二氧化碳加氢合成甲醇,既能缓解环境问题,又能解决能源危机。涉及以下主要反应:
反应Ⅰ: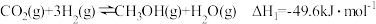
反应Ⅱ: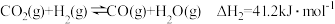
在不同压强下,按照 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示
的平衡产率随温度的变化关系如下图所示
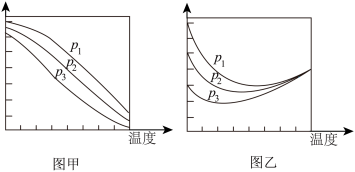
①下列说法正确的是___________
A.
B.图甲纵坐标表示 的平衡产率,图乙纵坐标表示
的平衡产率,图乙纵坐标表示 的平衡产率
的平衡产率
C.一定温度、压强下,寻找活性更高的催化剂,是提高 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向
D.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压的反应条件
的平衡产率,应选择低温、高压的反应条件
②图乙中压强一定时,曲线随温度变化先降后升的原因是:___________ ;图乙中三条曲线在某温度时交于一点的原因是:___________
③在一定温度下,控制容器体积1L保持不变,测得 平衡转化率为60%,其中甲醇的选择性为
平衡转化率为60%,其中甲醇的选择性为 ,请计算该温度下反应Ⅰ的平衡常数K=
,请计算该温度下反应Ⅰ的平衡常数K=___________
(4)二氧化碳与氢气以1:3投料比合成甲醇常采用铜基催化剂,测得 随时间变化如图所示。研究发现,采用
随时间变化如图所示。研究发现,采用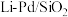 代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用
代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用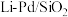 催化剂作用下,
催化剂作用下, 随时间变化的曲线
随时间变化的曲线___________ 。

 、
、 的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:
的捕集、利用与封存是我国能源研究领域的一个重要战略方向。请回答:(1)室温下,
 溶液呈碱性的原因是
溶液呈碱性的原因是(2)已知:
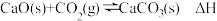
①

②分别将20g、40g的
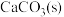 放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡(
放入相同温度相同体积的真空密闭容器A和B中,一段时间后两者均达到平衡( 都未完全分解),则两容器中分解的
都未完全分解),则两容器中分解的 的物质的量关系:
的物质的量关系:
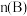 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(3)利用二氧化碳加氢合成甲醇,既能缓解环境问题,又能解决能源危机。涉及以下主要反应:
反应Ⅰ:
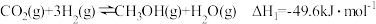
反应Ⅱ:
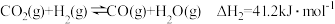
在不同压强下,按照
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示
的平衡产率随温度的变化关系如下图所示
①下列说法正确的是
A.

B.图甲纵坐标表示
 的平衡产率,图乙纵坐标表示
的平衡产率,图乙纵坐标表示 的平衡产率
的平衡产率C.一定温度、压强下,寻找活性更高的催化剂,是提高
 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向D.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压的反应条件
的平衡产率,应选择低温、高压的反应条件②图乙中压强一定时,曲线随温度变化先降后升的原因是:
③在一定温度下,控制容器体积1L保持不变,测得
 平衡转化率为60%,其中甲醇的选择性为
平衡转化率为60%,其中甲醇的选择性为 ,请计算该温度下反应Ⅰ的平衡常数K=
,请计算该温度下反应Ⅰ的平衡常数K=(4)二氧化碳与氢气以1:3投料比合成甲醇常采用铜基催化剂,测得
 随时间变化如图所示。研究发现,采用
随时间变化如图所示。研究发现,采用 代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用
代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图中画出采用 催化剂作用下,
催化剂作用下, 随时间变化的曲线
随时间变化的曲线
您最近一年使用:0次
名校
解题方法
10 . 能源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
II.2CH3OH(g) CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2
III.CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=___________ (用含△H1、△H2、△H3的代数表示)。
(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
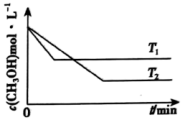
①△H___________ (填“>”“<”或“=”)0,说明理由___________ 。
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率___________ (填“增大”“减小”或“不变”)。
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g) CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为___________ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡___________ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1
III.CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为___________ mol·L-1(用含a、b、V的代数式表示,下同),反应III的平衡常数为___________ 。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1II.2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2III.CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3则3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
①△H
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)
 CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1III.CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为
您最近一年使用:0次
2021-07-02更新
|
1679次组卷
|
7卷引用:广西河池市九校2020-2021学年高二下学期第二次联考化学试题
广西河池市九校2020-2021学年高二下学期第二次联考化学试题(已下线)第2章 化学反应速率和化学平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)重庆市缙云教育联盟2021-2022学年高三10月质量检测化学试题(已下线)2.2.3 影响化学平衡的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河南宏力学校2021-2022学年高二上学期期中考试化学试题(已下线)第二章 化学反应速率与化学平衡(B卷·能力提升练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)浙江省杭师大附中2022-2023学年高二上学期期中考试 化学试题



