解题方法
1 . 下列实验目的、实验操作及现象、结论均正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 判断强酸和弱酸 |  溶液显碱性, 溶液显碱性, 溶液显酸性 溶液显酸性 | 可以确定 是弱酸,无法判断 是弱酸,无法判断 是否为弱酸 是否为弱酸 |
| B | 判断反应物的浓度对平衡的影响 | 向 溶液中加入 溶液中加入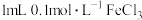 溶液,达到平衡,再加入 溶液,达到平衡,再加入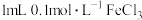 溶液,溶液红色加深 溶液,溶液红色加深 | 说明增大反应物浓度,化学平衡正向移动 |
| C | 验证 的氧化性 的氧化性 | 向黄绿色的氯水中加入 溶液,溶液黄绿色褪去 溶液,溶液黄绿色褪去 |  有强氧化性 有强氧化性 |
| D | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 下列实验目的、实验操作及现象、结论都正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 判断强酸和弱酸 | NaHCO3溶液显碱性,NaHSO3溶液显酸性 | 可以确定H2CO3是弱酸,无法判断H2SO3是否为弱酸 |
| B | 改变反应物的浓度对平衡的影响 | 向5mL0.1mol/L,KSCN溶液中加入1mL0.1mol/LFeCl3溶液,达到平衡,然后再加入1mL0.1mol/LFeCl3,溶液红色加深 | 说明增加反应物浓度,化学平衡正向移动 |
| C | 比较Ksp(AgCl)和Ksp(AgI)的大小 | 取2mL0.1mol/LAgNO3溶液于试管中,加入1mL0.1mol/LNaCl溶液,再加入1mL0.1mol/LKI溶液,产生黄色沉淀 | 说明:Ksp(AgCl)>Ksp(AgI) |
| D | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-20更新
|
366次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高三下学期月考试卷(七)化学试题
解题方法
3 . 根据实验目的,下列实验及现象、结论都正确的是
选项 | 实验目的 | 实验及现象 | 结论 |
A | 比较 和 和 的水解常数 的水解常数 | 分别测浓度均为0.1  的 的 和 和 溶液的pH,后者大于前者 溶液的pH,后者大于前者 |  |
B | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向 溶液中缓慢滴加硫酸,黄色变为橙红色 溶液中缓慢滴加硫酸,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
C | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
D | 检验某有机物中是否存在醛基 | 向3 mL 5%的 溶液滴加3~4滴2% 溶液滴加3~4滴2%  溶液,然后滴加0.5 mL 4%某有机物,加热至沸腾,未观察到红色沉淀 溶液,然后滴加0.5 mL 4%某有机物,加热至沸腾,未观察到红色沉淀 | 该溶液不含醛基 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 氯及其化合物应用广泛。氯的单质Cl2可由MnO2与浓盐酸共热得到,Cl2能氧化Br-,可从海水中提取Br2;氯的氧化物ClO2可用于自来水消毒,ClO2是一种黄绿色气体,易溶于水,与碱反应会生成ClO 与ClO
与ClO ;亚氯酸钠(NaClO2)是一种高效漂白剂和氧化剂。实验室欲由下列装置制取高浓度的HClO溶液,有关实验装置和原理能达到各自实验目的的是
;亚氯酸钠(NaClO2)是一种高效漂白剂和氧化剂。实验室欲由下列装置制取高浓度的HClO溶液,有关实验装置和原理能达到各自实验目的的是
 与ClO
与ClO ;亚氯酸钠(NaClO2)是一种高效漂白剂和氧化剂。实验室欲由下列装置制取高浓度的HClO溶液,有关实验装置和原理能达到各自实验目的的是
;亚氯酸钠(NaClO2)是一种高效漂白剂和氧化剂。实验室欲由下列装置制取高浓度的HClO溶液,有关实验装置和原理能达到各自实验目的的是A.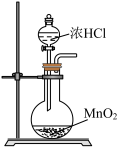 制取氯气 制取氯气 | B. 制取氯水 制取氯水 |
C. 提高HClO浓度 提高HClO浓度 | D. 分离HClO 分离HClO |
您最近一年使用:0次
解题方法
5 . 硫代硫酸钠 是重要的化工原料,易溶于水。实验室中探究
是重要的化工原料,易溶于水。实验室中探究 与某些金属阳离子的氧化还原反应情况。
与某些金属阳离子的氧化还原反应情况。
资料:i.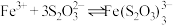 (紫黑色)
(紫黑色) 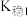 ;
;
ii. 为白色沉淀,
为白色沉淀,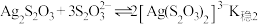 ;
;
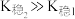 。
。
回答下列问题:
探究一
(1)根据实验①的现象,初步判断最终 被
被 还原为
还原为 ,通过
,通过_____ (填操作、试剂和现象),进一步证实生成了 。进一步实验证明
。进一步实验证明 最终被氧化为
最终被氧化为 ,该过程总反应的化学方程式为
,该过程总反应的化学方程式为_____ 。
(2)氧化性: (同浓度)。但实验②中
(同浓度)。但实验②中 未发生氧化还原反应的原因是
未发生氧化还原反应的原因是_____ 。
探究二
(3)实验③中黑色沉淀可能为 或
或 。通过
。通过_____ (填操作、试剂和现象),进一步证实生成了 。白色絮状沉淀变为黑色沉淀的化学方程式为
。白色絮状沉淀变为黑色沉淀的化学方程式为_____ 。
(4)将 溶液逐滴滴入
溶液逐滴滴入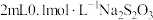 溶液中至过量,该过程可观察到的实验现象为
溶液中至过量,该过程可观察到的实验现象为_____ 。
 是重要的化工原料,易溶于水。实验室中探究
是重要的化工原料,易溶于水。实验室中探究 与某些金属阳离子的氧化还原反应情况。
与某些金属阳离子的氧化还原反应情况。资料:i.
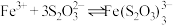 (紫黑色)
(紫黑色) 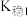 ;
;ii.
 为白色沉淀,
为白色沉淀,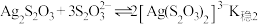 ;
;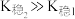 。
。回答下列问题:
探究一
| 装置 | 编号 | 试剂X | 实验现象 |
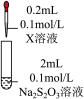 | ① | 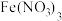 溶液 溶液 | 混合后溶液先变成紫黑色, 后溶液几乎变为无色 后溶液几乎变为无色 |
| ② |  溶液 溶液 | 一段时间后,生成白色沉淀,振荡后,沉淀溶解,得到无色溶液 |
 被
被 还原为
还原为 ,通过
,通过 。进一步实验证明
。进一步实验证明 最终被氧化为
最终被氧化为 ,该过程总反应的化学方程式为
,该过程总反应的化学方程式为(2)氧化性:
 (同浓度)。但实验②中
(同浓度)。但实验②中 未发生氧化还原反应的原因是
未发生氧化还原反应的原因是探究二
| 装置 | 编号 | 试剂X | 实验现象 |
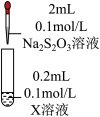 | ③ |  溶液 溶液 | 立即生成白色絮状沉淀,沉淀很快变为黑色沉淀。 |
 或
或 。通过
。通过 。白色絮状沉淀变为黑色沉淀的化学方程式为
。白色絮状沉淀变为黑色沉淀的化学方程式为(4)将
 溶液逐滴滴入
溶液逐滴滴入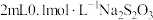 溶液中至过量,该过程可观察到的实验现象为
溶液中至过量,该过程可观察到的实验现象为
您最近一年使用:0次
解题方法
6 . 氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意:
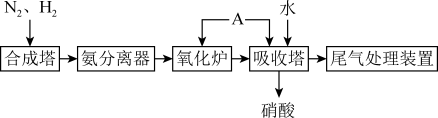
(1)合成塔中,反应开始进行时需要加热,加热的目的主要是___________ ;反应开始后停止加热,发现反应更加剧烈,由此可知该反应是___________ (填“放热”或“吸热”)反应。
(2)从合成气中分离出氨,主要利用了氨气___________ 的性质;从氨分离器中分离出的另两种气体可回到___________ (填写装置名称)中再利用。
(3)请写出氧化炉内发生反应的化学方程式,并用单线桥法标出电子转移的方向和数目___________ 。
(4)向吸收塔中通入过量A是___________ ,作用是___________ 。尾气处理装置中含有少量的NO2,可用氢氧化钠溶液吸收,该反应方程式是___________ 。
(5)硝酸可氧化绝大多数金属,而工业上盛装大量浓硝酸可用铝制容器,原因是___________ 。
(6)①可利用浓氨水检验氯气管道是否泄漏,若泄漏,可观察到的现象___________ ,该反应方程式是___________ 。
②碳酸氢铵是一种常用氮肥,但因___________ (用化学方程式表达),所以必须放置阴凉处保存。

(1)合成塔中,反应开始进行时需要加热,加热的目的主要是
(2)从合成气中分离出氨,主要利用了氨气
(3)请写出氧化炉内发生反应的化学方程式,并用单线桥法标出电子转移的方向和数目
(4)向吸收塔中通入过量A是
(5)硝酸可氧化绝大多数金属,而工业上盛装大量浓硝酸可用铝制容器,原因是
(6)①可利用浓氨水检验氯气管道是否泄漏,若泄漏,可观察到的现象
②碳酸氢铵是一种常用氮肥,但因
您最近一年使用:0次
名校
7 . 变色硅胶干燥剂含有 ,根据颜色可判断干燥剂是否已经失效。已知
,根据颜色可判断干燥剂是否已经失效。已知 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: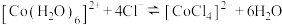
 ,将该溶液分为三份做实验,溶液的颜色变化如下:
,将该溶液分为三份做实验,溶液的颜色变化如下:
以下结论或解释正确的是
 ,根据颜色可判断干燥剂是否已经失效。已知
,根据颜色可判断干燥剂是否已经失效。已知 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: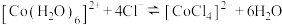
 ,将该溶液分为三份做实验,溶液的颜色变化如下:
,将该溶液分为三份做实验,溶液的颜色变化如下:| 装置 | 序号 | 操作 | 现象 |
 | ① | 将试管置于冰水浴中 | 溶液均呈粉红色 |
| ② | 加水稀释 | ||
| ③ | 加少量 固体 固体 |
A.由实验①可知: |
| B.由实验②可推知加水稀释,浓度商Q<K,平衡逆向移动 |
C.由实验③可知: 络合 络合 能力比 能力比 络合 络合 能力弱 能力弱 |
D.变色硅胶干燥剂含有 主要起干燥作用 主要起干燥作用 |
您最近一年使用:0次
2023-02-12更新
|
314次组卷
|
2卷引用:湖南省长沙市长郡中学2022-2023学年高二上学期期末考试化学试题
名校
8 . 火法有色金属冶炼烟气制酸过程中会产生大量含砷污酸,采用硫化-石膏中和法处理含砷污酸可获得达标废水,同时实现变废为宝得到多级产品,工艺流程如下:
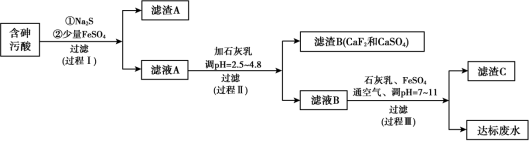
资料:
ⅰ. 常温下H2CO3的Ka1 = 4.4×10-7 ,Ka2 = 4.7×10-11;H2S的Ka1 = 1.3×10-7 ,Ka2 = 7.1×10-15;
ⅱ. 含砷污酸中砷的主要存在形式为亚砷酸(H3AsO3,弱酸),除砷外H+、Cu2+、F-、SO 含量均超标;
含量均超标;
ⅲ.室温下三价砷在水溶液中的存在形式与溶液pH的关系:
(1)工业上制备Na2S时,用NaOH溶液吸收H2S,不能以纯碱代替NaOH。结合方程式解释不能使用纯碱的原因___________ 。
(2)过程Ⅰ可除去含砷污酸中的Cu2+和部分砷,滤渣A 的主要成分为CuS和As2S3,生成As2S3的离子方程式是___________ 。
(3)过程Ⅰ会发生副反应As2S3(s)+3S2-(aq) 2AsS
2AsS (aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因
(aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因___________ 。
(4)过程Ⅲ中获得的滤渣C主要成分是FeAsO4, 该过程通入空气的作用是___________ 。
(5)利用反应AsO +2I-+2H+ =AsO
+2I-+2H+ =AsO +I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到
+I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到___________ 现象说明已到滴定终点,重复三次实验,记录用去Na2S2O3溶液体积为V mL,计算样品纯度为 ___________ (用字母表示)。
资料:2Na2S2O3+I2=Na2S4O6+2NaI;FeAsO4相对分子质量为195

资料:
ⅰ. 常温下H2CO3的Ka1 = 4.4×10-7 ,Ka2 = 4.7×10-11;H2S的Ka1 = 1.3×10-7 ,Ka2 = 7.1×10-15;
ⅱ. 含砷污酸中砷的主要存在形式为亚砷酸(H3AsO3,弱酸),除砷外H+、Cu2+、F-、SO
 含量均超标;
含量均超标;ⅲ.室温下三价砷在水溶液中的存在形式与溶液pH的关系:
| pH值 | pH<7 | pH=10~11 |
| 主要存在形式 | H3AsO3 | H2AsO |
(2)过程Ⅰ可除去含砷污酸中的Cu2+和部分砷,滤渣A 的主要成分为CuS和As2S3,生成As2S3的离子方程式是
(3)过程Ⅰ会发生副反应As2S3(s)+3S2-(aq)
 2AsS
2AsS (aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因
(aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因(4)过程Ⅲ中获得的滤渣C主要成分是FeAsO4, 该过程通入空气的作用是
(5)利用反应AsO
 +2I-+2H+ =AsO
+2I-+2H+ =AsO +I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到
+I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到资料:2Na2S2O3+I2=Na2S4O6+2NaI;FeAsO4相对分子质量为195
您最近一年使用:0次
2022-04-16更新
|
517次组卷
|
3卷引用:北京市第十二中学2022-2023学年高二下学期3月练习化学试题
北京市第十二中学2022-2023学年高二下学期3月练习化学试题北京市顺义区2021-2022学年高三下学期4月第二次统练化学试题(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)
2024·广西·模拟预测
名校
解题方法
9 . 实验室用以下装置(夹持和水浴加热装置略)制备环己酮缩乙二醇。
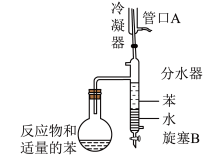

| A.以共沸体系带出水促使反应正向进行 |
| B.当观察到分水器中苯层液面高于支管口时,必须打开旋塞B将水放出 |
| C.管口A是冷凝水的进水口 |
| D.根据带出水的体积可估算反应进度 |
您最近一年使用:0次
2023-12-20更新
|
2150次组卷
|
8卷引用:辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题
辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题(已下线)化学01(14+4模式)2024年1月“九省联考”考前化学猜想卷(已下线)热点19 化学微型实验福建省泉州市永春一中、培元中学、石光中学、季延中学2023-2024学年高三下学期第二次联合考试化学试题河南省漯河市高级中学2023-2024学年高三下学期3月月考化学试题(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届湖南省长沙市第一中高三下学期高考适应性演练(一)化学试题
解题方法
10 . 宋代《千里江山图》是中国十大传世名画之一,其绿色颜料孔雀石的主要成分是碱式碳酸铜。综合利用辉铜矿和软锰矿制备碱式碳酸铜的主要工艺流程如图所示。

已知:①辉铜矿主要含有Cu2S及少量SiO2、 Fe2O3等杂质,软锰矿主要含有MnO2及少量SiO2、Fe2O3等杂质。
②S在CS2中的溶解度随温度升高而增大;CS2的沸点为46.2 °C。
③[ Cu(NH3)4]2+(aq) Cu2+ (aq) + 4NH3(aq)
Cu2+ (aq) + 4NH3(aq)
请回答下列问题:
(1)①“酸浸”时能提高浸取率的措施有________________ (任填一条)。
②研究表明矿物中溶解生成的Fe3+可作催化剂,促进Cu2S与MnO2的溶解,其过程有三个反应,反应方程式分别为:(i) Fe2O3+ 3H2SO4=Fe2(SO4)3+3H2O;(ii) Cu2S+ 2Fe2(SO4)3=2CuSO4+4FeSO4+S;写出(iii)的化学反应方程式__________ 。
(2)滤渣经CS2提取后可获得副产品硫单质。提取过程中必须控制适宜的温度,不宜过高或过低的原因是_________ 。
(3)“除铁”时,Fe3+的萃取率与pH的关系如图所示。pH>1后,Fe3+萃取率下降的原因是_______________ 。

(4)“沉锰”过程中Mn2+沉淀离子方程式为__________ 。
(5)“赶氨”时,最适宜的操作方法是_______ 。
(6)采用如图所示装置(加热装置已省略)测定产品中Cu2(OH)2CO3的纯度。量气管D及导管E中盛装的试剂为____ 。在下列实验操作中使测定结果偏低的是____ (填标号)。

A.第1次读数时,仰视
B.停止加热后,体系未恢复到室温即读数
C.第2次读数时,E管液面高于D管,未调液面即读数

已知:①辉铜矿主要含有Cu2S及少量SiO2、 Fe2O3等杂质,软锰矿主要含有MnO2及少量SiO2、Fe2O3等杂质。
②S在CS2中的溶解度随温度升高而增大;CS2的沸点为46.2 °C。
③[ Cu(NH3)4]2+(aq)
 Cu2+ (aq) + 4NH3(aq)
Cu2+ (aq) + 4NH3(aq) 请回答下列问题:
(1)①“酸浸”时能提高浸取率的措施有
②研究表明矿物中溶解生成的Fe3+可作催化剂,促进Cu2S与MnO2的溶解,其过程有三个反应,反应方程式分别为:(i) Fe2O3+ 3H2SO4=Fe2(SO4)3+3H2O;(ii) Cu2S+ 2Fe2(SO4)3=2CuSO4+4FeSO4+S;写出(iii)的化学反应方程式
(2)滤渣经CS2提取后可获得副产品硫单质。提取过程中必须控制适宜的温度,不宜过高或过低的原因是
(3)“除铁”时,Fe3+的萃取率与pH的关系如图所示。pH>1后,Fe3+萃取率下降的原因是

(4)“沉锰”过程中Mn2+沉淀离子方程式为
(5)“赶氨”时,最适宜的操作方法是
(6)采用如图所示装置(加热装置已省略)测定产品中Cu2(OH)2CO3的纯度。量气管D及导管E中盛装的试剂为

A.第1次读数时,仰视
B.停止加热后,体系未恢复到室温即读数
C.第2次读数时,E管液面高于D管,未调液面即读数
您最近一年使用:0次



