名校
1 . 某小组设计实验研究单一组分浓度对化学平衡2Fe3++2I- 2Fe2++I2的影响。
2Fe2++I2的影响。
(1)①待试管中溶液的颜色不变后再进行后续实验,其目的是___________ 。
②加入KSCN溶液的目的是___________ 。
(2)甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2.
本实验改用0.1 mol•L-1KI溶液的目的是___________ 。
(3)实验3:研究增大反应物Fe3+浓度对平衡的影响,实验方法如下:
取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和FeCl3溶液,溶液颜色加深,原因是:增大Fe3+浓度,导致Q___________ K(填“>”或“<”),平衡向___________ (填“正反应”或“逆反应”)方向移动。
(4)实验4:研究增大生成物Fe2+浓度对平衡的影响,实验方案如图所示:
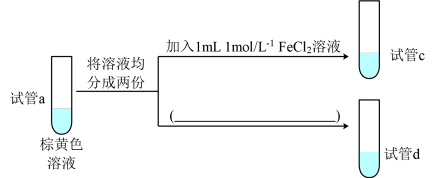
①请在图中将方案补充完整___________ 。
②能够证明增大生成物Fe2+浓度导致平衡移动的实验现象为___________ 。
 2Fe2++I2的影响。
2Fe2++I2的影响。| 实验1 | 实验步骤 | 实验现象 |
| i.取2 mL1 mol•L﹣1KI溶液,滴加0.1 mol•L-1FeCl3溶液2 mL。 | i.溶液呈棕黄色。 | |
| ii.待试管中溶液的颜色不变后向其中滴加2滴0.1 mol•L-1KSCN溶液。 | ii.溶液不显红色。 |
(1)①待试管中溶液的颜色不变后再进行后续实验,其目的是
②加入KSCN溶液的目的是
(2)甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2.
| 实验2 | 实验现象 | 实验步骤 |
| i.取2 mL0.1 mol•L﹣1KI溶液于试管a中,滴加0.1 mol•L-1FeCl3溶液2mL | i.溶液呈棕黄色 | |
| ii.待试管中溶液的颜色不变后,取少量试管a中溶液于试管b中,滴加2滴0.1 mol•L-1KSCN溶液。 | ii.溶液显红色 |
本实验改用0.1 mol•L-1KI溶液的目的是
(3)实验3:研究增大反应物Fe3+浓度对平衡的影响,实验方法如下:
取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和FeCl3溶液,溶液颜色加深,原因是:增大Fe3+浓度,导致Q
(4)实验4:研究增大生成物Fe2+浓度对平衡的影响,实验方案如图所示:

①请在图中将方案补充完整
②能够证明增大生成物Fe2+浓度导致平衡移动的实验现象为
您最近一年使用:0次
2021-12-04更新
|
143次组卷
|
2卷引用:广西玉林市博白县中学2021-2022学年高二上学期第二次段考理科综合化学试题
名校
2 . 某同学研究K2Cr2O7溶液中的化学平衡,并验证勒夏特列原理,设计如图所示实验。
已知:Cr2O (aq)(橙色)+H2O⇌2CrO
(aq)(橙色)+H2O⇌2CrO (aq)(黄色)+2H+ △H <0
(aq)(黄色)+2H+ △H <0
下列说法正确的是
已知:Cr2O
 (aq)(橙色)+H2O⇌2CrO
(aq)(橙色)+H2O⇌2CrO (aq)(黄色)+2H+ △H <0
(aq)(黄色)+2H+ △H <0| 实验过程 | 实验现象 |
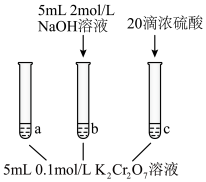 | 试管a中溶液为橙色; 试管b中溶液为黄色; 试管c中滴加浓硫酸后温度略有升高,溶液变为深橙色。 |
| A.该反应是一个氧化还原反应 |
B.b试管中只存在CrO ,不存在Cr2O ,不存在Cr2O |
| C.对比a、b可以证明减小生成物浓度,平衡正向移动 |
| D.对比a、c不可以证明升高温度,平衡正向移动 |
您最近一年使用:0次
名校
3 . 某温度下,在恒容密闭容器中加入一定量X,发生反应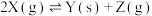
 ,一段时间后达到平衡。下列说法错误的是
,一段时间后达到平衡。下列说法错误的是
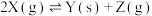
 ,一段时间后达到平衡。下列说法错误的是
,一段时间后达到平衡。下列说法错误的是A.升高温度,若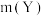 减小,则 减小,则 |
B.加入一定量Y,达新平衡后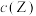 减小 减小 |
C.压缩容器, 增大 增大 |
D.恒压下充入一定量的氦气,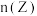 减少 减少 |
您最近一年使用:0次
2022-12-13更新
|
158次组卷
|
2卷引用:广西北海市2022-2023学年高二上学期期末考试化学试题
4 . 下列有关工业合成氨的说法不能用平衡移动原理解释的是
| A.不断补充氮气 | B.选择10MPa~30MPa的高压 |
| C.选择500℃左右同时使用铁触媒做催化剂 | D.及时液化分离氨气 |
您最近一年使用:0次
2021-04-05更新
|
168次组卷
|
2卷引用:广西钦州市第四中学2020-2021学年下学期高二3月月考化学试题
5 . 设NA是阿伏加德罗常数的值。下列说法中正确的是
| A.标准状况下,22.4L3H2所含质子数为4NA |
| B.11.0gH2C2O4·2H2O晶体中含有的离子总数为0.3NA |
| C.100mL0.1mol/LK2Cr2O7酸性溶液中,含铬元素离子的数目为0.01NA |
| D.高温时,0.3mol铁粉与足量水蒸气完全反应时转移电子数为0.8NA |
您最近一年使用:0次
名校
解题方法
6 . 人体血液中的H2CO3— ,是一对重要的缓冲物质,其在血液中存在平衡
,是一对重要的缓冲物质,其在血液中存在平衡 ,下列说法错误的是
,下列说法错误的是
 ,是一对重要的缓冲物质,其在血液中存在平衡
,是一对重要的缓冲物质,其在血液中存在平衡 ,下列说法错误的是
,下列说法错误的是| 人体血液的pH范围 | <7.2 | 7.35~7.45 | >7.5 |
| 人体情况 | 酸中毒 | 正常 | 碱中毒 |
A.当人体血液中pH升高时,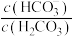 的值减小 的值减小 |
| B.长跑后血液中的c(CO2)增加,血液的pH降低 |
| C.过量饮用市售苏打水(含大量碱性物质),上述平衡向左移动 |
| D.这对缓冲物质有助于稳定人体血液的pH,使其保持在正常范围内 |
您最近一年使用:0次
名校
7 . 反应Fe3+ +SCN− Fe(SCN)2+(血红色),一定温度下达到平衡时,c(Fe3+)=0.04 mol·L−1,c(SCN−) = 0.1 mol·L−1,c[Fe(SCN)2+] = 0.68 mol·L−1.下列说法
Fe(SCN)2+(血红色),一定温度下达到平衡时,c(Fe3+)=0.04 mol·L−1,c(SCN−) = 0.1 mol·L−1,c[Fe(SCN)2+] = 0.68 mol·L−1.下列说法不正确 的是
 Fe(SCN)2+(血红色),一定温度下达到平衡时,c(Fe3+)=0.04 mol·L−1,c(SCN−) = 0.1 mol·L−1,c[Fe(SCN)2+] = 0.68 mol·L−1.下列说法
Fe(SCN)2+(血红色),一定温度下达到平衡时,c(Fe3+)=0.04 mol·L−1,c(SCN−) = 0.1 mol·L−1,c[Fe(SCN)2+] = 0.68 mol·L−1.下列说法| A.加入固体KSCN后,平衡正向移动 |
| B.加水稀释,溶液颜色变浅,据此判断平衡逆向移动 |
| C.该温度下,该反应的平衡常数K=170 |
| D.加入铁粉,平衡逆向移动 |
您最近一年使用:0次
2021-04-09更新
|
275次组卷
|
3卷引用:广西南宁二中、柳铁一中2024届高三上学期9月模拟调研测试化学试题
名校
8 . 一定温度下,在密闭容器中发生如下反应:2HI(g) H2(g)+ I2(g) △H>0,反应达到平衡时,下列说法错误的是( )
H2(g)+ I2(g) △H>0,反应达到平衡时,下列说法错误的是( )
 H2(g)+ I2(g) △H>0,反应达到平衡时,下列说法错误的是( )
H2(g)+ I2(g) △H>0,反应达到平衡时,下列说法错误的是( )| A.若体积不变,升高温度,活化分子的百分数增加,反应速率加快 |
| B.若缩小容器的体积,再次平衡时颜色变深,该现象不能用勒夏特列原理解释 |
| C.若压强不变,向容器中再加入一定量的HI时正反应速率增大,逆反应速率减小 |
| D.若体积不变,向容器中再加入一定量的HI,再次平衡时HI的转化率增大 |
您最近一年使用:0次
2020-01-17更新
|
214次组卷
|
4卷引用:广西南宁市第三中学2019-2020学年高二上学期期末考试化学试题
名校
解题方法
9 . 工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,SO2不可能100%地转化为SO3 |
| C.为了提高SO2的转化率,应适当提高O2的浓度 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
您最近一年使用:0次
2020-09-27更新
|
509次组卷
|
44卷引用:广西壮族自治区桂林市第十八中学2020-2021学年高二上学期开学考试化学试题
广西壮族自治区桂林市第十八中学2020-2021学年高二上学期开学考试化学试题广西桂林市第十八中学2020-2021学年高一下学期期中考试化学试题(已下线)09—10学年衡中高一下学期第二次调研化学试卷(已下线)09~10年锦州一中高一下学期期中考试化学卷(已下线)2011-2012学年湖北省部分中学高一下学期期中考试化学试卷(已下线)2011-2012学年云南省武定县第一中学高二5月月考化学试卷(已下线)2011-2012年吉林长春外国语学校高一下学期期中考试文科化学试卷(已下线)2011-2012学年云南省玉溪一中高一下学期期中考试化学试卷(已下线)2011-2012学年甘肃省武威五中高一下学期期末考试化学试卷(已下线)2012-2013学年湖北省孝感高级中学高一下学期期中考试化学试卷(已下线)2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(已下线)2013-2014安徽省淮南市下学期期末考试高一化学试卷2014-2015学年陕西岐山县高一下学期期末质量检测化学试卷2015-2016学年江苏省泰州中学高一下第一次月考化学试卷2015-2016学年宁夏育才中学高一下期中化学试卷2015-2016学年广东省佛山一中高一下期中化学试卷2015-2016学年河南省周口市高一下期末化学试卷(已下线)同步君 必修2 第2章 第3节 化学反应的限度河北省定州市第二中学2016-2017学年高一4月月考化学试题河南省兰考县第二高级中学2016-2017学年高一下学期期末考试化学试题云南省峨山彝族自治县第一中学2016-2017学年高二下学期期末考试化学试题高中化学人教版 必修2 第二章 化学反应与能量 第三节 化学反应的速率和限度 化学反应的限度河南省兰考县第二高级中学2017-2018学年高一下学期期末抽测调研化学试题【全国市级联考】湖北省襄阳市2017-2018学年高一下学期期末调研统一考试化学试题【全国市级联考】辽宁省大连市2017-2018学年高一下学期期末考试(文)化学试题【全国百强校】吉林省实验中学2019届高三上学期第四次模拟考试化学试题【全国百强校】天津市静海区第一中学2018-2019学年高一(合格班)下学期5月月考化学试题广东省佛山市三水区实验中学2018-2019学年高一下学期第三学段考试化学试题四川省遂宁市2018-2019学年高一下学期期末考试化学试题湖南省长郡中学2018-2019学年高一下学期期末考试化学试题广东省惠州市2018-2019学年高二上学期期末考试化学(理科)试题山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题甘肃省甘南藏族自治州合作第一中学2018-2019学年高一下学期期末考试化学试题四川省成都市成华区2019-2020学年高一下学期期末化学试题山西省孝义市第二中学校2019-2020学年高一下学期期末考试化学(B卷)试题四川省武胜烈面中学校2020-2021学年高二上学期开学考试化学试题河南省开封市2019-2020学年高一下学期期末调研考试化学试题安徽省合肥市第三中学2019-2020学年高二分班考试化学试题贵州省思南中学2020-2021学年高二上学期第一次月考化学试题四川省南充市2020-2021学年高二上期期末考试化学试题(已下线)专题2.2.3 影响化学平衡的因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)云南省玉溪第二中学2020- 2021学年高二下学期期中考试化学试题天津市红桥区2019-2020学年高二上学期期末考试化学试题山西省柳林县2019-2020学年高一下学期期末教学质量检测化学试题
10 . 氮的固定对工农业及人类生存具有重大意义。
合成氨是最重要的人工固氮:N2(g)+3H2(g) 2NH3(g) △H<0。
2NH3(g) △H<0。
(1)下列关于该反应的说法中,正确的是___________ (填正确选项字母编号)。
A.反应达到平衡状态时,N2、H2、NH3的体积比为1∶3∶2
B.加催化剂可以加快正反应速率,减慢逆反应速率
C.高温既有利于加快反应速率也有利于提高氨气的产率
D.高压既有利于加快反应速率也有利于提高氨气的产率
(2)一定温度下,在容积为1L的密闭容器中,加入lmolN2和3mol H2,反应达到平衡时H2的转化率为60%,此时反应消耗N2物质的量为___________ mol;保持容器体积不变,再向容器中加入1molN2,3mol H2,反应再次达到平衡时,氢气的转化率将___________ (填“增大”或“减小”或“不变”)。
(3)标准状况下,将22.4 mL的氨气通入100 mL 0.01 mol·L-1的盐酸中,充分反应后,溶液中各离子浓度由大到小的顺序是________________________ 。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学反应方程式为____________________ 。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递 H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如图所示,写出阴极的电极反应式____________________ 。

合成氨是最重要的人工固氮:N2(g)+3H2(g)
 2NH3(g) △H<0。
2NH3(g) △H<0。(1)下列关于该反应的说法中,正确的是
A.反应达到平衡状态时,N2、H2、NH3的体积比为1∶3∶2
B.加催化剂可以加快正反应速率,减慢逆反应速率
C.高温既有利于加快反应速率也有利于提高氨气的产率
D.高压既有利于加快反应速率也有利于提高氨气的产率
(2)一定温度下,在容积为1L的密闭容器中,加入lmolN2和3mol H2,反应达到平衡时H2的转化率为60%,此时反应消耗N2物质的量为
(3)标准状况下,将22.4 mL的氨气通入100 mL 0.01 mol·L-1的盐酸中,充分反应后,溶液中各离子浓度由大到小的顺序是
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学反应方程式为
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递 H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如图所示,写出阴极的电极反应式

您最近一年使用:0次



