名校
解题方法
1 . 铁元素及其化合物在生活生产中有广泛的用途。回答下列问题:
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN- Fe(SCN)3
Fe(SCN)3
若溶液中含有Fe3+,则加入KSCN溶液后的现象为_________ 向加入KSCN后的混合溶液中再加入少量NaOH固体,观察到的现象是_____________ ,产生该现象的原因是________________ 。
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因__________________ 。
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生______ 、________ 两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是____ 。
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为_____________ 若要验证该溶液中Fe2+未被完全氧化,则可以需要加入_____ 若出现_________ 现象,则证明Fe2+未被完全氧化。
(5)下列有关铁及其化合物的说法正确的是________
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN-
 Fe(SCN)3
Fe(SCN)3 若溶液中含有Fe3+,则加入KSCN溶液后的现象为
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为
(5)下列有关铁及其化合物的说法正确的是
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
您最近半年使用:0次
2021·浙江·模拟预测
名校
解题方法
2 . 10mL0.1mol•L-1KI溶液与5mL0.1mol•L-1FeCl3溶液发生反应:2Fe3+(aq)+2I-(aq)⇌2Fe2+(aq)+I2(aq),达到平衡。下列说法不正确的是
| A.加入少量氯化钾固体,平衡不移动 |
| B.加适量水稀释,平衡正向移动 |
| C.经过CCl4多次萃取分离后,向水溶液中滴加KSCN溶液,若溶液出现血红色,证明该反应是可逆反应 |
D.该反应的平衡常数K=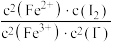 |
您最近半年使用:0次
2022-04-01更新
|
491次组卷
|
12卷引用:上海市华东师范大学第二附属中学2021-2022年高三下学期3月等级考化学试题
(已下线)上海市华东师范大学第二附属中学2021-2022年高三下学期3月等级考化学试题浙江省2021届高三下学期3月联考化学试题(已下线)浙江省“超级全能生”2021年3月高考选考科目联考化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)课时3影响化学平衡的因素随堂练习
20-21高二上·广东汕头·期末
名校
3 . 将5mL0.005mol·L-1FeCl3溶液和5mL0.015mol·L-1KSCN溶液混合,达到平衡后混合液呈红色。再将混合液分为5等份,分别进行如下实验:
下列说法不正确 的是
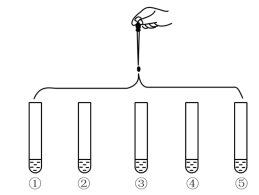 | 实验①:滴加4滴水,振荡 |
| 实验②:滴加4滴饱和FeCl3溶液,振荡 | |
| 实验③:滴加4滴1mol·L-1KCl溶液,振荡 | |
| 实验④:滴加4滴1mol·L-1KSCN溶液,振荡 | |
| 实验⑤:滴加4滴6mol·L-1NaOH溶液,振荡 |
| A.实验②中溶液颜色比实验①中深 |
| B.对比实验①和③,可证明增加反应物中某些离子的浓度,平衡发生逆向移动 |
| C.对比实验①和④,可证明增加反应物浓度,平衡发生正向移动 |
| D.对比实验①和⑤,可证明减少反应物浓度,平衡发生逆向移动 |
您最近半年使用:0次
2021-04-28更新
|
428次组卷
|
6卷引用:2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)广东省汕头市达濠华侨中学2020至2021学年高二上学期期末联考化学试题(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题
名校
4 . 硫酸亚铁晶体(FeSO4●7H2O)在医药上作补血剂。工业上用废铁生产FeSO4●7H2O的一种流程如图所示:
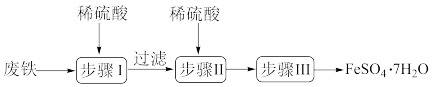
(1)步骤Ⅰ中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:___________ 。
(2)证明步骤I滤液中只含有 的方法:取样,先滴加
的方法:取样,先滴加___________ ,再滴加___________ (填试剂,名称),该过程的现象___________ 。
(3)步骤Ⅲ从硫酸亚铁溶液中获得硫酸亚铁晶体( )的实验操作为蒸发浓缩、冷却结晶、
)的实验操作为蒸发浓缩、冷却结晶、___________ 、冰水洗涤、烘干。烘干操作需在低温条件下进行,原因是:___________ 。
(4)将FeCl3和KSCN溶液混合,发生可逆反应: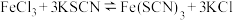 ,已知反应处于平衡状态中,现改变条件请回答下列问题:
,已知反应处于平衡状态中,现改变条件请回答下列问题:
向上述混合液中,若加入少量 固体后,混合溶液红色
固体后,混合溶液红色___________ ;若加入少量 粉后,混合溶液红色
粉后,混合溶液红色___________ ;若加入少量 固体后,混合溶液红色
固体后,混合溶液红色___________ ;若加入 溶液后,混合溶液红色
溶液后,混合溶液红色___________ 。(填“变深”、“变浅”或“不变”;注意,溶液中加入少量固体可以忽略体积变化)

(1)步骤Ⅰ中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:
(2)证明步骤I滤液中只含有
 的方法:取样,先滴加
的方法:取样,先滴加(3)步骤Ⅲ从硫酸亚铁溶液中获得硫酸亚铁晶体(
 )的实验操作为蒸发浓缩、冷却结晶、
)的实验操作为蒸发浓缩、冷却结晶、(4)将FeCl3和KSCN溶液混合,发生可逆反应:
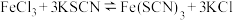 ,已知反应处于平衡状态中,现改变条件请回答下列问题:
,已知反应处于平衡状态中,现改变条件请回答下列问题:向上述混合液中,若加入少量
 固体后,混合溶液红色
固体后,混合溶液红色 粉后,混合溶液红色
粉后,混合溶液红色 固体后,混合溶液红色
固体后,混合溶液红色 溶液后,混合溶液红色
溶液后,混合溶液红色
您最近半年使用:0次
名校
5 . 现代医学证明“痛风”的病因与关节滑液中形成尿酸钠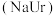 晶体有关,尤其在寒冷季节易诱发关节疼痛。主要原理为:
晶体有关,尤其在寒冷季节易诱发关节疼痛。主要原理为:
①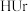 (尿酸)
(尿酸)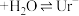 (尿酸离子)
(尿酸离子)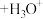
②
下列叙述错误 的是
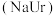 晶体有关,尤其在寒冷季节易诱发关节疼痛。主要原理为:
晶体有关,尤其在寒冷季节易诱发关节疼痛。主要原理为:①
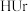 (尿酸)
(尿酸)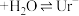 (尿酸离子)
(尿酸离子)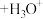
②

下列叙述
| A.①是尿酸的电离方程式 |
B.反应②的 ,因此热敷能减轻关节疼痛 ,因此热敷能减轻关节疼痛 |
| C.饮食中摄入过多食盐,容易诱发痛风 |
| D.“痛风”患者应控制摄入产生较多尿酸的食物 |
您最近半年使用:0次
2023-01-12更新
|
142次组卷
|
3卷引用:上海市七宝中学2022-2023学年高二上学期期末考试化学试题
上海市七宝中学2022-2023学年高二上学期期末考试化学试题(已下线)专题03 化学反应进行的方向和限度-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)课时3影响化学平衡的因素随堂练习
6 . 钒被称为“工业味精”,在发展现代工业、国防等方面发挥着重要的作用。V2O5有强氧化性,在实验室以V2O5为原料制备氧钒(IV)碱式碳酸铵晶体,此晶体难溶于水,其化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O,是制备热敏材料VO2的原料。过程如下:
V2O5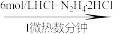 VOCl2溶液
VOCl2溶液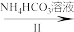 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O
已知:①氧化性:V2O5 > Cl2;②VO2+能被O2氧化。
(1)步骤I 中除生成VOCl2外,还生成绿色环保,无毒无害的产物,则反应的化学方程式为______ 。若只用浓盐酸与V2O5反应也能制备VOCl2溶液,但从环保角度分析,使用N2H4·2HCl的目的是_______ 。
(2)步骤II可在如图装置中进行:

①为了排尽装置中的空气,防止VO2+被氧化,上述装置依次连接的合理顺序为c→________ (按气流方向,用小写字母表示)。
②连接好装置,检查气密性良好后,加入试剂,开始实验,具体操作为____________________ 。
(3)实验结束时,将析出的产品过滤,用饱和NH4HCO3溶液洗涤。请从溶解平衡的角度解释,使用饱和NH4HCO3溶液洗涤晶体的原因:___________ 。证明沉淀已经洗涤干净的方法是_______ 。
(4)测定粗产品中钒的含量。实验步骤如下:
称量ag产品于锥形瓶中,用稀硫酸溶解后得到VO2+的溶液,加入0.02mol·L-1 KMnO4溶液至稍过量,加入某还原剂除去过量KMnO4溶液,最后用cmol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(VO +Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为bmL。粗产品中钒的质量分数表达式为
+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为bmL。粗产品中钒的质量分数表达式为__________________ (以VO2+计,式量为67)。若(NH4)2Fe(SO4)2标准溶液部分变质,则测定结果_______ (填“偏高”、“偏低”或“无影响”)。
V2O5
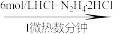 VOCl2溶液
VOCl2溶液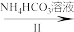 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O 已知:①氧化性:V2O5 > Cl2;②VO2+能被O2氧化。
(1)步骤I 中除生成VOCl2外,还生成绿色环保,无毒无害的产物,则反应的化学方程式为
(2)步骤II可在如图装置中进行:

①为了排尽装置中的空气,防止VO2+被氧化,上述装置依次连接的合理顺序为c→
②连接好装置,检查气密性良好后,加入试剂,开始实验,具体操作为
(3)实验结束时,将析出的产品过滤,用饱和NH4HCO3溶液洗涤。请从溶解平衡的角度解释,使用饱和NH4HCO3溶液洗涤晶体的原因:
(4)测定粗产品中钒的含量。实验步骤如下:
称量ag产品于锥形瓶中,用稀硫酸溶解后得到VO2+的溶液,加入0.02mol·L-1 KMnO4溶液至稍过量,加入某还原剂除去过量KMnO4溶液,最后用cmol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(VO
 +Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为bmL。粗产品中钒的质量分数表达式为
+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为bmL。粗产品中钒的质量分数表达式为
您最近半年使用:0次
7 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,涉及如下实验:
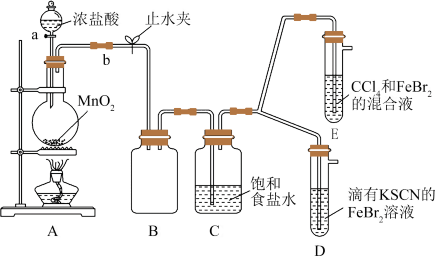
完成下列填空:
(1)装置A中发生反应的化学方程式是___ ,整套实验装置存在的一处明显不足是___ 。
(2)用改进后的装置进行实验,观察到:D中溶液变红;E中水层溶液变黄,振荡后,CCl4层无明显变化。则Cl2、Br2、Fe3+的氧化性由强到弱的顺序为___ 。
因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D中:红色慢慢褪去,E中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料如下:(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。
(3)用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因___ 。请设计简单实验证明上述解释:___ 。
(4)欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因___ 。
(5)将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为___ 。

完成下列填空:
(1)装置A中发生反应的化学方程式是
(2)用改进后的装置进行实验,观察到:D中溶液变红;E中水层溶液变黄,振荡后,CCl4层无明显变化。则Cl2、Br2、Fe3+的氧化性由强到弱的顺序为
因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D中:红色慢慢褪去,E中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料如下:(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。
(3)用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因
(4)欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因
(5)将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为
您最近半年使用:0次
名校
8 . 氢气是重要的工业原料,煤的气化是一种重要的制氢途径。反应过程如下:
①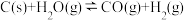 (吸热反应)
(吸热反应)
②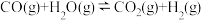 (放热反应)
(放热反应)
在一定温度下,向体积固定的密闭容器中加入足量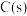 和
和 。反应平衡时,
。反应平衡时, 的物质的量为
的物质的量为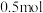 ,
, 的物质的量为
的物质的量为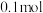 。
。
(1)下列说法错误的是___________。
(2)若要提高碳的转化率,请你再设计一种措施:___________ 。
①
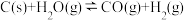 (吸热反应)
(吸热反应)②
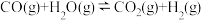 (放热反应)
(放热反应)在一定温度下,向体积固定的密闭容器中加入足量
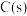 和
和 。反应平衡时,
。反应平衡时, 的物质的量为
的物质的量为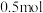 ,
, 的物质的量为
的物质的量为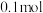 。
。(1)下列说法错误的是___________。
| A.增加炭粉,能使反应①平衡正向移动 |
| B.混合气体的密度保持不变时,说明反应体系已达到平衡 |
C.平衡时 的体积分数可能大于 的体积分数可能大于 |
D.升高温度可能增大 的转化率 的转化率 |
您最近半年使用:0次
解题方法
9 . 氯亚铂酸钾是合成绝大部分二价铂化合物的原料,广泛应用于电镀、医药中间体、催化剂前驱体等的制备。
已知:
利用Pt废料制备氯亚铂酸钾,流程如下:
(2)关于实验步骤说法错误的是___________。
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目___________ 。
(4)步骤⑦得到的溶液中含 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。
①蒸发浓缩需要控制温度75℃附近的原因___________ 。
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是___________ 。
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是___________ 。___________ 。
已知:
| 氯亚铂酸钾(K2PtCl4) | 水溶性可溶 10 g/L(20℃)、不溶于乙醇、受热分解。 |
| 氯铂酸钾(K2PtCl6) | 溶于热水、微溶于冷水、几乎不溶于乙醇、乙醚。 |
| 氯铂酸(H2PtCl6) | 110℃时部分分解,150℃开始生成金属铂。 |
| 亚硝酸钾(KNO2) | 有一定还原性,还原性:KNO2弱于K2C2O4。 |
| 亚硝酸(HNO2) | 弱酸、不稳定、易分解。 |
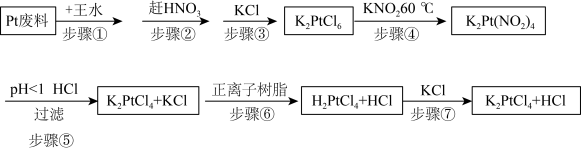
| A.步骤①中王水可以用浓硫酸代替 |
| B.步骤②利用硝酸的易挥发性,适合加强热 |
| C.步骤③加入KCl能促进K2PtCl6晶体析出 |
| D.步骤④用还原剂K2C2O4代替更好 |
(2)关于实验步骤说法错误的是___________。
| A.步骤⑤利用酸性条件下亚硝酸的不稳定性 |
B.步骤⑥用正离子树脂交换是指 和 和 的交换 的交换 |
| C.步骤⑦是氧化还原反应 |
| D.最后得到的溶液中经蒸发能除去HCl |
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目
(4)步骤⑦得到的溶液中含
 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。①蒸发浓缩需要控制温度75℃附近的原因
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是
A.  B.
B.  C.
C.  D.
D.
您最近半年使用:0次
解题方法
10 . 尿素[CO(NH2)2]是一种重要的氮肥。工业上以CO2和NH3为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272
反应Ⅱ:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=
CO(NH2)2(s)+H2O(g) ΔH2=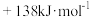
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3
(1)CO2的电子式为___________ ;1mol CO(NH2)2中含有___________ molπ键。
(2)反应Ⅰ的熵变ΔS___________  填“
填“ ”“
”“ ”或“
”或“ ”
” ,反应Ⅲ的
,反应Ⅲ的 H3=
H3=___________ 。
(3)下列关于尿素合成的说法正确的是___________。
反应Ⅰ:2NH3(g)+CO2(g)
 H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272
反应Ⅱ:H2NCOONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=
CO(NH2)2(s)+H2O(g) ΔH2=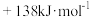
总反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3(1)CO2的电子式为
(2)反应Ⅰ的熵变ΔS
 填“
填“ ”“
”“ ”或“
”或“ ”
” ,反应Ⅲ的
,反应Ⅲ的 H3=
H3=(3)下列关于尿素合成的说法正确的是___________。
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
| D.保持压强不变,降低氨碳比[n(NH3)/n(CO2)]可提高反应Ⅰ中NH3的平衡转化率 |
您最近半年使用:0次



