10-11高二上·河北沧州·期中
名校
解题方法
1 . 现有X(g)+Y(g) 2Z(g),正反应放热,从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2~t3的曲线变化是由哪种条件引起的( )
2Z(g),正反应放热,从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2~t3的曲线变化是由哪种条件引起的( )
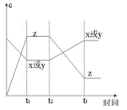
 2Z(g),正反应放热,从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2~t3的曲线变化是由哪种条件引起的( )
2Z(g),正反应放热,从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2~t3的曲线变化是由哪种条件引起的( )
| A.增大X或Y的浓度 | B.升高温度 |
| C.增大Z的浓度 | D.增大压强 |
您最近一年使用:0次
2020-10-30更新
|
75次组卷
|
15卷引用:2016-2017学年黑龙江大庆中学高二上期中化学试卷
2016-2017学年黑龙江大庆中学高二上期中化学试卷2016-2017学年黑龙江牡丹江中学高二上期中理化学卷(已下线)2010年河北省黄骅中学高二上学期期中考试化学试卷(已下线)2011-2012学年江西省南昌三中高二上学期期中考试化学试卷(已下线)2012-2013学年山西省康杰中学高二第一次月考化学试卷(已下线)2012-2013学年陕西省西安市第一中学高二上学期期末考试理科化学卷(已下线)2013-2014学年江西省赣州市十二县高二上学期期中考试化学试卷2015-2016学年河南省洛阳市伊川实验高中高二上第二次月考化学试卷2015-2016学年安徽省安庆市怀宁高河中学高二上第一次月考化学试卷河北省张家口市第一中学2016-2017学年高一(衔接班)6月月考(理)化学试题湖北省武汉市武昌区2017_2018学年高二化学上学期期中化学试题安徽省凤阳县二中2018-2019学年高二下学期开学摸底考试化学试题山东省日照市第一中学2019-2020学年高二10月月考化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期10月月考化学试题(已下线)【南昌新东方】8. 外国语 刘惠文
名校
2 . 在水溶液中,CrO 呈黄色,Cr2O
呈黄色,Cr2O 呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O
呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O +H2O
+H2O 2CrO
2CrO +2H+,下列说法正确的是
+2H+,下列说法正确的是
 呈黄色,Cr2O
呈黄色,Cr2O 呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O
呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O +H2O
+H2O 2CrO
2CrO +2H+,下列说法正确的是
+2H+,下列说法正确的是| A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色 |
| B.该反应是氧化还原反应 |
| C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大 |
| D.向体系中加入少量水,平衡逆向移动 |
您最近一年使用:0次
2020-10-28更新
|
834次组卷
|
19卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二10月月考化学试题
黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二10月月考化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素山西省长治市第二中学校2020-2021学年高二上学期第一次月考化学试题河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题山东省济南第一中学2020-2021学年高二上学期期中考试化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素(已下线)专题2.2.3 影响化学平衡的因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)福建省厦门第六中学2021-2022学年高二上学期期中考试化学试题(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)山东省聊城市第二中学2022-2023学年高二上学期开学考试化学试题(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)福建省莆田第二十五中学2022-2023学年高二上学期期中考试化学试题第二章 化学反应速率与化学平衡 第二节 化学平衡 第3课时 影响化学平衡的因素广东省清远市名校2023-2024学年高二上学期期中调研联考化学试题广东省茂名化州市第一中学2023-2024学年高二上学期10月质量检测化学试题河南省郑州中学2023-2024学年高三上学期第二次月考化学试题广东清远一中实验学校2020-2021学年高二上学期备战期中定时检测化学试卷
3 . 重铬酸钾只是溶于水,不和水反应。但水中存在电解平衡, +H2O
+H2O 2
2 +2H+,下列说法正确的是( )
+2H+,下列说法正确的是( )
 +H2O
+H2O 2
2 +2H+,下列说法正确的是( )
+2H+,下列说法正确的是( )| A.加入H+,平衡正向移动 | B.加入H+,颜色由橙色向黄色变化 |
| C.滴加氢氧根离子,平衡逆向移动 | D.滴加氢氧根离子,颜色由橙色向黄色变化 |
您最近一年使用:0次
2020-10-22更新
|
202次组卷
|
2卷引用:黑龙江省伊春市伊美区第二中学2020-2021学年高二上学期第一次月考化学试题
名校
4 . 下列叙述及解释正确的是
A. 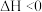 ,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 ,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 |
B. 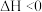 ,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 ,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
C. ,在达到平衡后,加少量 ,在达到平衡后,加少量 固体,因为平衡向逆反应方向移动,故体系颜色变浅 固体,因为平衡向逆反应方向移动,故体系颜色变浅 |
D.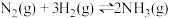 ,在达到平衡后,保持压强不变,充入 ,在达到平衡后,保持压强不变,充入 ,平衡向左移动 ,平衡向左移动 |
您最近一年使用:0次
2020-09-13更新
|
383次组卷
|
14卷引用:黑龙江省齐齐哈尔市第八中学2018-2019学年高二上学期9月月考化学试题
黑龙江省齐齐哈尔市第八中学2018-2019学年高二上学期9月月考化学试题【全国百强校】天津市静海县第一中学2018-2019学年高二上学期9月学生学业能力调研化学试题四川省成都市实验中学2018-2019学年高二上学期期中模拟考试化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期第一次月考化学试题天津市静海区第一中学2020届高三下学期第六周周末训练化学试题河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(一)化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素(已下线)2.3.2影响化学平衡状态的因素(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)湖南省衡阳市第八中学2020-2021学年高二上学期10月月考化学试题辽宁省沈阳市法库县高级中学2020-2021学年高二9月月考化学试题河南省洛阳市第三中学东城校区2020-2021学年高二9月月考化学试题山东省山大附中卧龙学校2021-2022学年高二上学期第一次月考化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题
名校
5 . N2O4常用作火箭推进器的燃料。已知反应2NO2(g) N2O4(g) △H<0,不同条件下,N2O4的含量随时间(t)的变化如图,则反应历程从I改变为II所采取的措施可能是
N2O4(g) △H<0,不同条件下,N2O4的含量随时间(t)的变化如图,则反应历程从I改变为II所采取的措施可能是
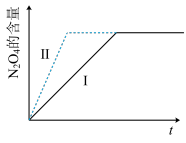
 N2O4(g) △H<0,不同条件下,N2O4的含量随时间(t)的变化如图,则反应历程从I改变为II所采取的措施可能是
N2O4(g) △H<0,不同条件下,N2O4的含量随时间(t)的变化如图,则反应历程从I改变为II所采取的措施可能是
| A.增大NO2的浓度 | B.升高温度 | C.增大压强 | D.加入催化剂 |
您最近一年使用:0次
2020-08-05更新
|
253次组卷
|
6卷引用:黑龙江省牡丹江市第三中学2021-2022学年高二上学期期中考试化学(理)试题
名校
解题方法
6 . 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡Sn,发生反应: Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。
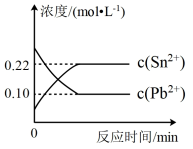
下列判断正确的是

下列判断正确的是
| A.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| B.25℃时,该反应的平衡常数K=2.2 |
| C.平衡体系中加入金属铅后,c(Pb2+)增大 |
| D.升高温度,平衡体系中c(Pb2+)增大,说明该反应正反应是吸热反应 |
您最近一年使用:0次
2020-07-21更新
|
552次组卷
|
5卷引用:黑龙江省巴彦县第三高级中学2021-2022学年高二上学期11月月考化学试题
名校
7 . 常温常压下,O3溶于水产生的游离氧原子[O]有很强的杀菌消毒能力,发生的反应如下:( )
反应①:O3 O2+[O] ΔH>0 平衡常数为K1
O2+[O] ΔH>0 平衡常数为K1
反应②:[O]+O3 2O2 ΔH<0 平衡常数为K2
2O2 ΔH<0 平衡常数为K2
总反应:2O3 3O2 ΔH<0 平衡常数为K
3O2 ΔH<0 平衡常数为K
下列叙述正确的是
反应①:O3
 O2+[O] ΔH>0 平衡常数为K1
O2+[O] ΔH>0 平衡常数为K1反应②:[O]+O3
 2O2 ΔH<0 平衡常数为K2
2O2 ΔH<0 平衡常数为K2总反应:2O3
 3O2 ΔH<0 平衡常数为K
3O2 ΔH<0 平衡常数为K下列叙述正确的是
| A.降低温度,K减小 | B.K=K1+K2 |
| C.增大压强,K2减小 | D.适当升温,可提高消毒效率 |
您最近一年使用:0次
2020-02-21更新
|
319次组卷
|
12卷引用:【全国百强校】黑龙江省大庆市第一中学2018-2019学年高二下学期开学检测化学试题
【全国百强校】黑龙江省大庆市第一中学2018-2019学年高二下学期开学检测化学试题江西省宜春市上高二中2017-2018学年高二第一次月考化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题【全国百强校】四川省成都市第七中学2018-2019学年高二上学期半期考试化学试题【市级联考】广东省清远市2018-2019学年高二第一学期期末质量检测化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期第一次月考化学试题福建三明市2020届高三毕业班第一次教学质量检测卷化学试题(已下线)考点10 化学平衡常数及其图象分析-2020年高考化学命题预测与模拟试题分类精编河南省豫南九校2020-2021学年高二上学期第二次联考化学试题广东省广州市第八十九中学2020-2021学年高二上学期期中考试化学试题(已下线)课时37 化学平衡常数-2022年高考化学一轮复习小题多维练(全国通用)07-2023新东方高二上期中考化学
名校
8 . 已知:[CoCl4]2-(蓝色)与[Co(H2O)6]2+(粉红色)之间存在如下平衡:[CoCl4]2-+6H2O  [Co(H2O)6]2++4Cl- △H<0。现有呈现紫色的氯化钴溶液。
[Co(H2O)6]2++4Cl- △H<0。现有呈现紫色的氯化钴溶液。
(1)甲同学向上述溶液中通入HCl,发现溶液变为___ 色;
(2)乙同学向上述溶液中加水,平衡___ (填“向右”、“向左”或“不”)移动。为使平衡保持该移动方向,还可采取的措施有____ (写一种)。
 [Co(H2O)6]2++4Cl- △H<0。现有呈现紫色的氯化钴溶液。
[Co(H2O)6]2++4Cl- △H<0。现有呈现紫色的氯化钴溶液。(1)甲同学向上述溶液中通入HCl,发现溶液变为
(2)乙同学向上述溶液中加水,平衡
您最近一年使用:0次
名校
9 . 下列变化不能用勒夏特列原理解释的是( )
A.工业制取金属钾Na(l)+KCl(l)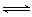 NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来 NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.合成氨时将氨液化分离,可提高原料的利用率 |
| D.新制氯水久置后颜色变浅 |
您最近一年使用:0次
2019-10-22更新
|
140次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2019-2020学年高二上学期期中考试化学试题
名校
10 . 下列反应能用勒夏特列原理解释的是
| A.加入催化剂有利于氨的合成 |
| B.煅烧粉碎的黄铁矿矿石有利于SO2的生成 |
| C.硫酸生产中用98%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3 |
D.工业制取金属钾Na(l)+KCl(l)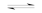 NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出 NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出 |
您最近一年使用:0次
2019-09-27更新
|
301次组卷
|
6卷引用:黑龙江省勃利县高级中学2020届高三上学期期中考试化学试题



