1 . 根据实验目的设计方案并进行实验,观察到相关现象。其中方案设计或结论均正确的是
| 实验目的 | 实验方案 | 现象 | 结论 | |
| A | 检验Na2SO3固体是否变质 | 将Na2SO3固体溶于水加入少量酸性KMnO4溶液 | 最终溶液无色 | Na2SO3固体未变质 |
| B | 检验木炭与浓硫酸共热后的酸性气体 | 将木炭与浓硫酸加热反应后的气体依次通过品红溶液、澄清石灰水 | 品红溶液褪色,澄清石灰水变浑浊 | 木炭与浓硫酸加热反应后的气体中有SO2和CO2 |
| C | 探究1-溴丁烷消去后的有机产物 | 将2.0g NaOH、15mL无水乙醇、5mL 1-溴丁烷和碎瓷片共热后的气体直接通入酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色 | 1-溴丁烷消去后有不饱和烃生成 |
| D | 探究浓度对化学平衡的影响 | 向5mL 0.005mol/L FeCl3溶液中加入5mL 0.015mol/L KSCN溶液,振荡后再加入4滴1mol/LKSCN溶液 | 溶液红色变深 | 增大反应物浓度,平衡向正方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确 的是
| 实验目的 | 方案设计 | 现象 | 结论 | |
| A | 探究Fe和S反应特点 | 将适量硫粉和铁粉混合堆成条状。用灼热的玻璃棒触及一端,当混合物呈红热状态时,移开玻璃棒。 | 混合物继续保持红热并持续扩散,粉末呈黑色 | 该反应为放热反应 |
| B | 比较沉淀的Ksp大小 | 向相同浓度和体积的浓氨水中,分别加入等量AgCl和AgI固体,充分搅拌 | 氯化银溶解,碘化银无变化 | Ksp:AgCl>AgI |
| C | 判断平衡移动的方向 | 将装有NO2气体的注射器的活塞缓慢向外拉 | 红棕色逐渐变浅 | 可逆反应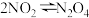 平衡正向移动 平衡正向移动 |
| D | 检验Na2S2O3样品是否含有Na2SO4杂质 | 取少量样品溶于水,先加入过量稀盐酸,过滤,向滤液中滴加少量BaCl2溶液 | 滤液中出现浑浊 | 该样品中含有Na2SO4杂质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . CH3CHO在NaOH溶液作用下制取2-丁烯醛的历程如下:
下列说法不正确 的是

下列说法
| A.OH-是该反应的催化剂 |
B.CH3CHO分子中甲基上的“ ”比 ”比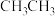 中的“ 中的“ ”更易电离出H+ ”更易电离出H+ |
| C.反应(4)加热失水有利于反应(3)平衡正向移动 |
| D.CH3CHO与CH3CH2CHO的混合液在NaOH溶液作用下最多可得到2种羟基醛 |
您最近一年使用:0次
2024-04-10更新
|
555次组卷
|
5卷引用:2024届浙江省嘉兴市高三下学期二模化学试题
2024届浙江省嘉兴市高三下学期二模化学试题(已下线)化学(浙江卷01)-2024年高考押题预测卷(已下线)压轴题04 化学反应机理 历程 能垒图分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)(已下线)选择题11-16湖北省沙市中学2024届高三下学期模拟预测化学试题
名校
解题方法
4 . 已知难溶性化合物 的化学式为
的化学式为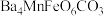 ,对
,对 进行如下实验,部分产物已经略去。
进行如下实验,部分产物已经略去。 中的金属元素在该实验条件下不能与
中的金属元素在该实验条件下不能与 产生配合物。
产生配合物。
(1) 高温下在
高温下在 气流中的反应
气流中的反应________ 氧化还原反应(填“属于”或“不属于”), 中钡元素的化合价为
中钡元素的化合价为________ 。
(2)步骤Ⅳ可以进行的原因除了生成 降低体系的能量之外,从化学平衡的角度解释能够发生的原因
降低体系的能量之外,从化学平衡的角度解释能够发生的原因________ 。
(3)下列说法正确的是________。
(4)固体 在一定条件下也可以与
在一定条件下也可以与 溶液反应,写出反应的离子方程式
溶液反应,写出反应的离子方程式________ 。
(5)设计实验检验混合气体A(除 外)的成份
外)的成份________ 。
 的化学式为
的化学式为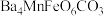 ,对
,对 进行如下实验,部分产物已经略去。
进行如下实验,部分产物已经略去。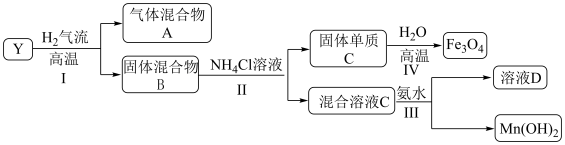
 中的金属元素在该实验条件下不能与
中的金属元素在该实验条件下不能与 产生配合物。
产生配合物。(1)
 高温下在
高温下在 气流中的反应
气流中的反应 中钡元素的化合价为
中钡元素的化合价为(2)步骤Ⅳ可以进行的原因除了生成
 降低体系的能量之外,从化学平衡的角度解释能够发生的原因
降低体系的能量之外,从化学平衡的角度解释能够发生的原因(3)下列说法正确的是________。
A.溶液D中阳离子只有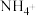 |
| B.若磁铁能吸引反应Ⅳ的剩余固体,则证明铁有剩余 |
| C.步骤Ⅱ中的氯化铵溶液也可以用盐酸代替 |
D.依据步骤Ⅲ可知碱性强弱 |
(4)固体
 在一定条件下也可以与
在一定条件下也可以与 溶液反应,写出反应的离子方程式
溶液反应,写出反应的离子方程式(5)设计实验检验混合气体A(除
 外)的成份
外)的成份
您最近一年使用:0次
名校
解题方法
5 . 丙烯是一种重要的化工原料,在催化剂作用下,可以由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):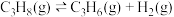

反应Ⅱ(氧化脱氢):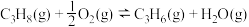

反应Ⅲ(氢气燃烧):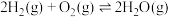
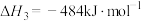
(1)
_____ kJ/mol。
(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入 和Ar的混合气体。在温度为
和Ar的混合气体。在温度为 时,
时, 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图1
的物质的量分数的关系如图1
①结合图1,从平衡移动的角度分析,“通入Ar”的作用是_____ 。
②若要将 的平衡转化率提高到60%,则
的平衡转化率提高到60%,则
_____ 。
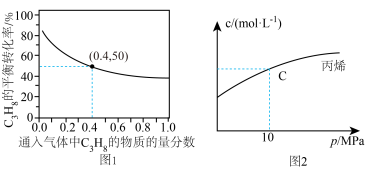
(3)恒温条件下,测得反应Ⅰ平衡时 的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时
的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时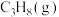 的物质的量浓度随平衡总压变化的曲线
的物质的量浓度随平衡总压变化的曲线_____ 。(在图中C点平衡总压为10Mpa时,丙烷和丙烯的物质的浓度相等)。
(4)①关于反应Ⅲ,下列说法正确的是_____ 。
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高 的转化率
的转化率
②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是_____ 。
(5)研究表明, 可催化氧化
可催化氧化 脱氢制丙烯。在p=0.1MPa,
脱氢制丙烯。在p=0.1MPa, ,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
下列说法不正确的是_____。
反应Ⅰ(直接脱氢):
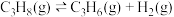

反应Ⅱ(氧化脱氢):
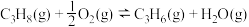

反应Ⅲ(氢气燃烧):
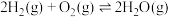
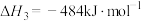
(1)

(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入
 和Ar的混合气体。在温度为
和Ar的混合气体。在温度为 时,
时, 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图1
的物质的量分数的关系如图1①结合图1,从平衡移动的角度分析,“通入Ar”的作用是
②若要将
 的平衡转化率提高到60%,则
的平衡转化率提高到60%,则
(3)恒温条件下,测得反应Ⅰ平衡时
 的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时
的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时 的物质的量浓度随平衡总压变化的曲线
的物质的量浓度随平衡总压变化的曲线(4)①关于反应Ⅲ,下列说法正确的是
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高
 的转化率
的转化率②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是
(5)研究表明,
 可催化氧化
可催化氧化 脱氢制丙烯。在p=0.1MPa,
脱氢制丙烯。在p=0.1MPa, ,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:| t℃ | 丙烷转化率 | 产物的选择性 | ||
 |  | CO | ||
| 400 | 4.06 | 93.12 | 2.20 | 4.68 |
| 500 | 12.32 | 91.23 | 3.16 | 5.61 |
| 600 | 35.22 | 85.44 | 7.73 | 6.83 |
| A.在较高温度下,催化剂X可提高产生丙烯反应的速率 |
B. 催化氧化 催化氧化 脱氢制丙烯的反应是放热反应 脱氢制丙烯的反应是放热反应 |
| C.相同条件下,使用不同的催化剂,丙烷的平衡转化率相同 |
| D.温度升高,催化剂X的活性下降,丙烯的产率降低 |
您最近一年使用:0次
2023-12-05更新
|
223次组卷
|
4卷引用:浙江省稽阳联谊学校2023-2024学年高三上学期联考化学试题
浙江省稽阳联谊学校2023-2024学年高三上学期联考化学试题(已下线)专题10 化学反应原理综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省宁波市2023-2024学年高二上学期九校联考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期1月期末化学试题
解题方法
6 . 下列实验装置,可以达到实验目的的是
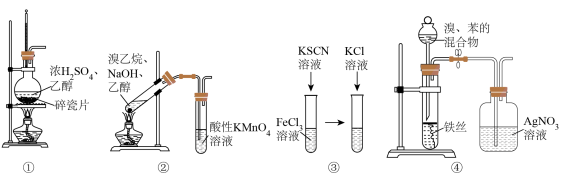
| A.用装置①在实验室制备乙烯 |
| B.用装置②证明溴乙烷消去反应有乙烯生成 |
C.用装置③探究KCl浓度是否对FeCl3+3KSCN Fe(SCN)3+3KCl的平衡移动有影响 Fe(SCN)3+3KCl的平衡移动有影响 |
| D.用装置④证明溴和苯发生的是取代反应而不是加成反应 |
您最近一年使用:0次
7 . 某兴趣小组用淀粉水解液和浓 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展了实验(夹持仪器已省略):
,按如下流程开展了实验(夹持仪器已省略):
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式: (
( 作催化剂)。
作催化剂)。
请回答:
(1)图1装置中仪器乙的名称___________ 。若C烧杯中盛放足量氢氧化钠溶液,写出C中发生反应的离子方程式___________ (假设气体全部被吸收),除了氢氧化钠溶液,还可以选用___________ (至少写出两种溶液)。
(2)下列有关操作说法不正确 的是___________。
(3)步骤Ⅳ中离心分离后得到的滤液中加入氨水还会析出产品沉淀,请结合离子方程式和平衡移动原理加以解释___________ 。
(4)草酸晶体 含有结晶水,某同学通过如下实验测定其组成:
含有结晶水,某同学通过如下实验测定其组成:
①配制标准氢氧化钠溶液:称取一定质量氢氧化钠固体,用适量水溶解后,选择合适的操作并排序(步骤可重复使用),配制溶液:___________
a→b→(___________)→(___________)→f→d→(___________)→(___________)→h
a.检查容量瓶玻璃塞处是否漏水b.将烧杯中的液体全部转移到容量瓶中
c.用蒸馏水洗涤烧杯和玻璃棒2-3次d.加蒸馏水至容量瓶接近标线
e.盖好瓶塞,反复上下颠倒容量瓶f.轻轻摇动容量瓶
g.离刻度线 时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中
,则该滴定法测得产品中 的值
的值___________ (填“偏大”“偏小”“无影响”)。
 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展了实验(夹持仪器已省略):
,按如下流程开展了实验(夹持仪器已省略):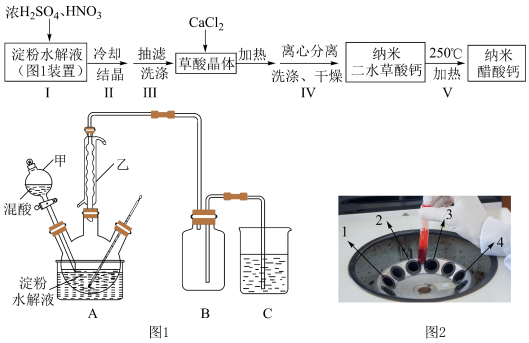
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式:
 (
( 作催化剂)。
作催化剂)。请回答:
(1)图1装置中仪器乙的名称
(2)下列有关操作说法
| A.步骤Ⅱ采取冷却结晶,以防止草酸晶体失水 |
| B.步骤Ⅲ洗涤可用乙醇水溶液,步骤IV洗涤可用蒸馏水洗涤 |
C.步骤Ⅴ采用 加热,为提高反应速率,也可采用更高温度加热 加热,为提高反应速率,也可采用更高温度加热 |
| D.步骤Ⅳ采用离心分离,装置如图2所示,操作时应将两支离心管放置于1、4处 |
(3)步骤Ⅳ中离心分离后得到的滤液中加入氨水还会析出产品沉淀,请结合离子方程式和平衡移动原理加以解释
(4)草酸晶体
 含有结晶水,某同学通过如下实验测定其组成:
含有结晶水,某同学通过如下实验测定其组成:①配制标准氢氧化钠溶液:称取一定质量氢氧化钠固体,用适量水溶解后,选择合适的操作并排序(步骤可重复使用),配制溶液:
a→b→(___________)→(___________)→f→d→(___________)→(___________)→h
a.检查容量瓶玻璃塞处是否漏水b.将烧杯中的液体全部转移到容量瓶中
c.用蒸馏水洗涤烧杯和玻璃棒2-3次d.加蒸馏水至容量瓶接近标线
e.盖好瓶塞,反复上下颠倒容量瓶f.轻轻摇动容量瓶
g.离刻度线
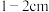 时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述
 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中
,则该滴定法测得产品中 的值
的值
您最近一年使用:0次
2023-10-09更新
|
214次组卷
|
4卷引用:浙江省强基联盟2023-2024学年高三上学期10月联考化学试题
浙江省强基联盟2023-2024学年高三上学期10月联考化学试题浙江强基联盟2023-2024学年第一学期高三年级10月联考 化学(已下线)专题09 化学实验综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)T20-实验综合题
解题方法
8 . 某小组设计实验探究铜被碘氧化的产物及铜元素的价态。 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色);
②铜元素被氧化可能存在的形式有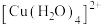 (蓝色)、
(蓝色)、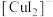 (无色);
(无色);
③ (无色),易被空气氧化。
(无色),易被空气氧化。
请回答:
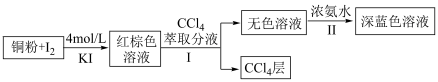
(1)步骤Ⅰ中加入 萃取分液的目的是
萃取分液的目的是___________ 。
(2)用离子方程式表示步骤Ⅱ中发生的反应___________ 。
(3)已知 为白色不溶于水的固体,向
为白色不溶于水的固体,向 中加入浓
中加入浓 溶液,现象为
溶液,现象为___________ 。
(4)向深蓝色溶液中滴加浓盐酸,溶液呈黄绿色,写出该转化能进行的可能原因___________ 。
(已知: 稳定性远大于
稳定性远大于 (黄色),
(黄色), 稳定指的是不易发生解离反应
稳定指的是不易发生解离反应 )
)
(5) 层呈
层呈___________ 色。如何设计实验将 层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将
层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将 层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,
层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,___________ 。请补充完实验操作中涉及的离子方程式: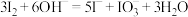 ,
,___________ 。
 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色);②铜元素被氧化可能存在的形式有
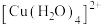 (蓝色)、
(蓝色)、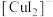 (无色);
(无色);③
 (无色),易被空气氧化。
(无色),易被空气氧化。请回答:
(1)步骤Ⅰ中加入
 萃取分液的目的是
萃取分液的目的是(2)用离子方程式表示步骤Ⅱ中发生的反应
(3)已知
 为白色不溶于水的固体,向
为白色不溶于水的固体,向 中加入浓
中加入浓 溶液,现象为
溶液,现象为(4)向深蓝色溶液中滴加浓盐酸,溶液呈黄绿色,写出该转化能进行的可能原因
(已知:
 稳定性远大于
稳定性远大于 (黄色),
(黄色), 稳定指的是不易发生解离反应
稳定指的是不易发生解离反应 )
)(5)
 层呈
层呈 层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将
层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将 层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,
层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,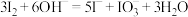 ,
,
您最近一年使用:0次
2023-10-09更新
|
236次组卷
|
4卷引用:浙江省强基联盟2023-2024学年高三上学期10月联考化学试题
浙江省强基联盟2023-2024学年高三上学期10月联考化学试题浙江强基联盟2023-2024学年第一学期高三年级10月联考 化学(已下线)专题08 工艺流程综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)压轴题11 无机化工流程综合分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
9 . 氧化镍(NiO)在冶金、化学及电子工业等领域中有广泛应用,某兴趣小组由工业废渣(主要成分:Fe、Ni,其它杂质不与酸反应)制备氧化镍的流程如下:
请回答:
(1)下列说法正确的是_______。
(2)滤液3经过一系列操作可得到氧化镍粗品,包含以下步骤:
a.将滤液放入烧杯中用煤气灯进行加热
b.将滤出的沉淀物进行烘干
c.用pH试纸测定溶液至不呈碱性
d.经马釜炉 焙烧
焙烧
e.过滤
①请给出合理的操作排序(从上述操作中选取,按先后次序列出字母)_______ 。为提高氧化镍产率,向滤液3中加入稍过量的碳酸铵固体→e→→→e→→→氧化镍粗品
②步骤a中对滤液进行加热的原因是_______ 。
(3)氧化镍产品的纯度可用配位滴定法测定。取1.500g氧化镍粗品,酸溶后配成250mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为 的
的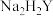 标准液滴定,平均消耗
标准液滴定,平均消耗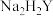 标准液
标准液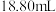 。
。
已知:Ⅰ.
Ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。
显橙黄色。
①粗品中氧化镍的纯度是_______ 。(保留四位有效数字)
②下列操作会使测定结果偏低的是_______ 。
A.锥形瓶中溶液颜色由橙黄色局部变为紫色后立即停止滴定
B.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
C.滴定前平视读数,滴定后俯视读数
D.振荡锥形瓶时,锥形瓶内溶液溅出


请回答:
(1)下列说法正确的是_______。
| A.通过冲击破碎的方式预处理工业废渣可加快其在酸溶时的反应速率 |
B.滤液1中的主要金属阳离子为 、 、 和 和 |
| C.操作Ⅱ与操作Ⅲ均为过滤,仅需用到的玻璃仪器:普通漏斗、烧杯 |
D.滤渣2中加入过量氨水发生的反应为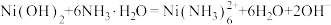 |
a.将滤液放入烧杯中用煤气灯进行加热
b.将滤出的沉淀物进行烘干
c.用pH试纸测定溶液至不呈碱性
d.经马釜炉
 焙烧
焙烧e.过滤
①请给出合理的操作排序(从上述操作中选取,按先后次序列出字母)
②步骤a中对滤液进行加热的原因是
(3)氧化镍产品的纯度可用配位滴定法测定。取1.500g氧化镍粗品,酸溶后配成250mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为
 的
的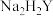 标准液滴定,平均消耗
标准液滴定,平均消耗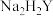 标准液
标准液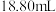 。
。已知:Ⅰ.

Ⅱ.紫脲酸胺:紫色试剂,遇
 显橙黄色。
显橙黄色。①粗品中氧化镍的纯度是
②下列操作会使测定结果偏低的是
A.锥形瓶中溶液颜色由橙黄色局部变为紫色后立即停止滴定
B.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
C.滴定前平视读数,滴定后俯视读数
D.振荡锥形瓶时,锥形瓶内溶液溅出
您最近一年使用:0次
2023-08-20更新
|
340次组卷
|
2卷引用:浙江省Z20名校联盟(浙江省名校新高考研究联盟)2023届高三上学期第二次联考化学试题
名校
解题方法
10 . 足量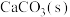 在水中的溶解过程如下:
在水中的溶解过程如下:
 ,该悬浊液达到平衡后,下列叙述
,该悬浊液达到平衡后,下列叙述不正确 的是
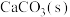 在水中的溶解过程如下:
在水中的溶解过程如下:
 ,该悬浊液达到平衡后,下列叙述
,该悬浊液达到平衡后,下列叙述A.升高温度,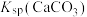 减小 减小 |
B.加少量水稀释,上述平衡正向移动, 不变 不变 |
C.向悬浊液中加入少量 固体, 固体, 减小 减小 |
D.向悬浊液中滴入盐酸, ,导致平衡正向移动 ,导致平衡正向移动 |
您最近一年使用:0次
2023-07-31更新
|
474次组卷
|
2卷引用:浙江省台州市2022-2023学年高三上学期第一次教学质量评估化学试题



