1 . 在容积为1L的密闭容器中,以Ag-ZSM为催化剂,相同时间测得0.1mol NO转化为 的转化率随温度变化如图所示[有CO时反应为
的转化率随温度变化如图所示[有CO时反应为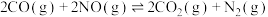 ;无CO时反应为
;无CO时反应为
 ](忽略温度对催化剂活性的影响)。下列说法正确的是
](忽略温度对催化剂活性的影响)。下列说法正确的是
 的转化率随温度变化如图所示[有CO时反应为
的转化率随温度变化如图所示[有CO时反应为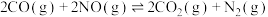 ;无CO时反应为
;无CO时反应为
 ](忽略温度对催化剂活性的影响)。下列说法正确的是
](忽略温度对催化剂活性的影响)。下列说法正确的是
| A.X点若更换高效催化剂NO转化率不变 |
B.Y点再通入CO、 各0.01mol,此时 各0.01mol,此时 |
C.反应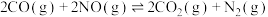 的△H>0 的△H>0 |
D.达平衡后,其他条件不变,使 ,NO转化率增大 ,NO转化率增大 |
您最近一年使用:0次
名校
解题方法
2 . 相变离子液体体系因节能潜力大被认为是新一代 吸收剂,某新型相变离子液体X吸收
吸收剂,某新型相变离子液体X吸收 的过程如图,已知X的阴离子中所有原子共平面,下列说法错误的是
的过程如图,已知X的阴离子中所有原子共平面,下列说法错误的是
 吸收剂,某新型相变离子液体X吸收
吸收剂,某新型相变离子液体X吸收 的过程如图,已知X的阴离子中所有原子共平面,下列说法错误的是
的过程如图,已知X的阴离子中所有原子共平面,下列说法错误的是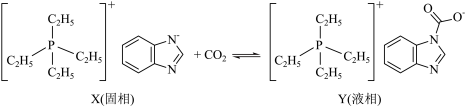
| A.X的阳离子中所有原子(除H外)均达到最外层8电子稳定状态 |
B.真空条件下有利于Y解析出 |
| C.X的阴离子中所有N均提供2个电子参与大π键的形成 |
| D.Y的熔点比X的低,可推知阴离子半径:Y>X |
您最近一年使用:0次
2024-04-27更新
|
408次组卷
|
2卷引用:2024届江西省吉安市第一中学高三下学期一模化学试题
3 . 利用含钴废料(主要成分为 ,还含有少量的铝箔、
,还含有少量的铝箔、 等杂质)制备碳酸钴的工艺流程如图:
等杂质)制备碳酸钴的工艺流程如图:
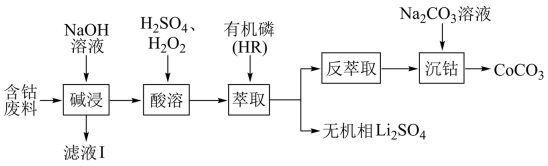
已知:萃取 的反应原理:
的反应原理: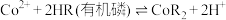 。下列说法错误的是
。下列说法错误的是
A.“滤液Ⅰ”中溶质的主要成分是 |
B.“酸溶”反应中 做氧化剂 做氧化剂 |
C.“反萃取”中可加入 分离出 分离出 |
D.“沉钴”时 溶液滴加速率不宜过快,目的是防止生成 溶液滴加速率不宜过快,目的是防止生成 |
您最近一年使用:0次
4 . 血红蛋白可与 结合,更易与
结合,更易与 配位,血红蛋白与
配位,血红蛋白与 配位示意如图所示。血红蛋白
配位示意如图所示。血红蛋白 与
与 、
、 结合的反应可表示为
结合的反应可表示为
②
下列说法中错误的是
 结合,更易与
结合,更易与 配位,血红蛋白与
配位,血红蛋白与 配位示意如图所示。血红蛋白
配位示意如图所示。血红蛋白 与
与 、
、 结合的反应可表示为
结合的反应可表示为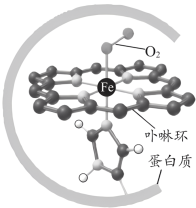

②

下列说法中错误的是
A.相同温度下, | B.反应①②的 、 、 均小于0 均小于0 |
C.图中 的配位数为6 的配位数为6 | D.用高压氧舱治疗 中毒时,平衡①②均逆向移动 中毒时,平衡①②均逆向移动 |
您最近一年使用:0次
2024-01-13更新
|
1131次组卷
|
7卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期期末考试化学试题
江西省宜春市丰城市第九中学2023-2024学年高三上学期期末考试化学试题辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题2024届辽宁省沈阳市高三教学质量检测(一模)化学试题(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)辽宁省沈阳市2024届高三一模化学试题天津市红桥区2024届高三下学期二模化学试题
名校
5 . 下列有关实验的目的、方案设计、现象和结论中存在不正确 的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 探究温度对下列平衡的影响: | 取两支试管,分别加入2mL0.5mol/L的 溶液,将其中一支先加热,然后置于冷水中,与另一支试管进行对比 溶液,将其中一支先加热,然后置于冷水中,与另一支试管进行对比 | 加热时溶液变为黄色,置于冷水中后溶液由黄色变为蓝色。该正反应 。 。 |
| B | 探究下列反应存在限度: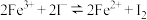 | 在试管中入5mL0.1mol/L的KI溶液,然后向试管中滴加5~6滴0.1mol/L的 溶液,继续加2mL的 溶液,继续加2mL的 ,充分振荡。取上清液于另一支试管中,滴加2滴KSCN溶液 ,充分振荡。取上清液于另一支试管中,滴加2滴KSCN溶液 | 上层清液滴加KSCN溶液后,溶液呈血红色。该反应存在限度。 |
| C | 探究 浓度对下列平衡的影响: 浓度对下列平衡的影响: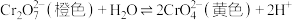 | 在试管中加入2mL0.5mol/L的 溶液,然后向试管中继续滴加5~10滴10mol/L的盐酸 溶液,然后向试管中继续滴加5~10滴10mol/L的盐酸 | 加入盐酸后,溶液由橙黄变为橙色。增大 离子浓度,平衡向逆向移动。 离子浓度,平衡向逆向移动。 |
| D | 探究KI对 单质在水中溶解的促进作用: 单质在水中溶解的促进作用: | 在试管中加入5mL碘水,加入1mL的 ,充分振荡,再向试管中加入1mL浓KI溶液,振荡 ,充分振荡,再向试管中加入1mL浓KI溶液,振荡 | 碘水加 萃取后下层为紫红色,滴加浓KI振荡后, 萃取后下层为紫红色,滴加浓KI振荡后, 层紫色变浅。KI能促进 层紫色变浅。KI能促进 在水中的溶解。 在水中的溶解。 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-10更新
|
199次组卷
|
2卷引用:江西省吉安市第一中学2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
6 . 为探究 在盐酸中与
在盐酸中与 、
、 的反应,某实验小组设计如图实验。
的反应,某实验小组设计如图实验。
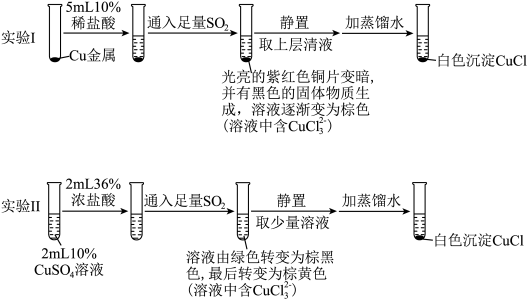
已知: ,实验Ⅰ中得到的黑色固体为
,实验Ⅰ中得到的黑色固体为 。下列说法正确的是
。下列说法正确的是
 在盐酸中与
在盐酸中与 、
、 的反应,某实验小组设计如图实验。
的反应,某实验小组设计如图实验。
已知:
 ,实验Ⅰ中得到的黑色固体为
,实验Ⅰ中得到的黑色固体为 。下列说法正确的是
。下列说法正确的是A.实验Ⅰ、Ⅱ中生成 白色沉淀的原理不相同 白色沉淀的原理不相同 |
B. 在实验Ⅰ、Ⅱ中呈现的化学性质一致 在实验Ⅰ、Ⅱ中呈现的化学性质一致 |
C.实验Ⅰ通入 时反应的离子方程式为 时反应的离子方程式为 |
D.实验Ⅱ若消耗 ,则生成 ,则生成 个 个 |
您最近一年使用:0次
2023-09-27更新
|
193次组卷
|
7卷引用:江西省部分高中学校2024届高三上学期9月大联考化学试题
名校
解题方法
7 . 下列实验方案不能达到相应目的的是


| A.探究温度对化学平衡的影响 | B.研究浓度对化学平衡的影响 |
| C.实现铜棒镀银 | D.证明化学反应存在一定的限度 |
您最近一年使用:0次
解题方法
8 . 由实验操作和现象,可得出相应正确结论的是
| 实验操作 | 现象 | 结论 | |
| A | 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液 | 先变橙色,后变蓝色 | 氧化性: Cl2>Br2>I2 |
| B | 将铁锈溶于浓盐酸,再滴加酸性高锰酸钾溶液 | 高锰酸钾溶液的紫色褪去 | 铁锈中含有二价铁 |
| C | 向铬酸钾溶液中缓慢滴加硫酸 | 黄色变为橙红色 |  +H2O +H2O 2 2 +2H+,增大氢离子浓度,平衡向生成 +2H+,增大氢离子浓度,平衡向生成 和的方向移动 和的方向移动 |
| D | 向蔗糖溶液中滴加稀硫酸,水浴加热,再加入新制Cu(OH)2悬浊液 | 无砖红色沉淀 | 蔗糖未发生水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 下列变化不能用勒夏特列原理解释的是
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| B.工业上合成氨要在高温、催化剂条件下进行 |
| C.实验室可用排饱和食盐水的方法收集氯气 |
D.向氯水中加 后,溶液漂白性增强 后,溶液漂白性增强 |
您最近一年使用:0次
2023-04-22更新
|
252次组卷
|
2卷引用:江西省宜春市宜丰中学2023届高三模拟预测化学试题
10 . 某小组同学探究盐对Fe3++3SCN- Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。
实验I:探究KCl对Fe3+和SCN-平衡体系的影响将已用稀盐酸酸化0.005mol·L-1FeCl3溶液(无色)和0.01mol·L-1KSCN溶液等体积混合,静置至体系达平衡,得红色溶液X。各取2mL溶液X放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
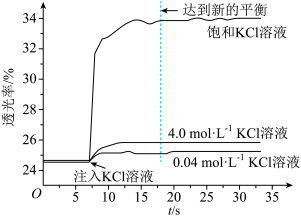
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②Cl、 与Fe3+均能发生络合反应:Fe3++4C1-
与Fe3+均能发生络合反应:Fe3++4C1- [FeCl4]-(黄色)、Fe3++2
[FeCl4]-(黄色)、Fe3++2
 [Fe(SO4)2]-(无色)。
[Fe(SO4)2]-(无色)。
(1)稀盐酸酸化FeCl3溶液的目的是___________ 。(用离子方程式表示)。采用浓度较低的FeCl3溶液制备Fe3+和SCN-的平衡体系,是为了避免___________ (填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对Fe3+和SCN-平衡体系有影响,且随着KCl浓度增大,Fe3++3SCN- Fe(SCN)3平衡向
Fe(SCN)3平衡向___________ (填“正反应”或“逆反应”)方向移动。
实验II:探究盐对Fe3+和SCN-平衡体系产生影响的原因
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使Fe3+和SCN-平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应Fe3++4C1- [FeCl4]-,离子浓度发生变化,导致Fe3+和SCN-平衡状态发生变化。
[FeCl4]-,离子浓度发生变化,导致Fe3+和SCN-平衡状态发生变化。
(3)基于以上分析,该组同学取2mL红色溶液X,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
基于以上实验现象可得出结论:K+的盐效应弱于Na+的盐效应。简述获得结论的依据:______ 。
(4)取2mL溶液X继续进行实验,结果如下表。
上述实验③和实验④可证明副反应影响了Fe3+和SCN-平衡体系,结合实验现象及化学用语分析副反应对Fe3+和SCN-平衡体系有影响的原因:___________ 。
实验III:探究现象a中溶液变为浅黄色的的原因
(5)由实验④、实验⑤和实验⑥可知,溶液变为浅黄色与___________ (填微粒的化学式)无关。
(6)为了进一步确认现象a中使溶液呈浅黄色的微粒只有Fe(SCN)3,补充完整实验⑦的操作___________ 。
 Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。实验I:探究KCl对Fe3+和SCN-平衡体系的影响将已用稀盐酸酸化0.005mol·L-1FeCl3溶液(无色)和0.01mol·L-1KSCN溶液等体积混合,静置至体系达平衡,得红色溶液X。各取2mL溶液X放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②Cl、
 与Fe3+均能发生络合反应:Fe3++4C1-
与Fe3+均能发生络合反应:Fe3++4C1- [FeCl4]-(黄色)、Fe3++2
[FeCl4]-(黄色)、Fe3++2
 [Fe(SO4)2]-(无色)。
[Fe(SO4)2]-(无色)。(1)稀盐酸酸化FeCl3溶液的目的是
(2)从实验结果来看,KCl溶液确实对Fe3+和SCN-平衡体系有影响,且随着KCl浓度增大,Fe3++3SCN-
 Fe(SCN)3平衡向
Fe(SCN)3平衡向实验II:探究盐对Fe3+和SCN-平衡体系产生影响的原因
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使Fe3+和SCN-平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应Fe3++4C1-
 [FeCl4]-,离子浓度发生变化,导致Fe3+和SCN-平衡状态发生变化。
[FeCl4]-,离子浓度发生变化,导致Fe3+和SCN-平衡状态发生变化。(3)基于以上分析,该组同学取2mL红色溶液X,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
| 序号 | 加入少量盐 | 溶液颜色 |
| ① | KCl | 变浅 |
| ② | NaCl | 变浅程度较大 |
(4)取2mL溶液X继续进行实验,结果如下表。
| 序号 | 加入溶液 | 溶液颜色 |
| ③ | 1mL蒸馏水 | 略变浅 |
| ④ | 1mL3mol·L-1盐酸 | 明显变浅,溶液偏黄 |
| ⑤ | 1mL1.5mol·L-1硫酸 | 现象a:溶液变为浅黄色 |
实验III:探究现象a中溶液变为浅黄色的的原因
| 序号 | 实验操作 | 溶液颜色 |
| ⑥ | 取1mL0.0025mol:L-1Fe2(SO4)3溶液(无色),加入1mL0.01mol·L-1KSCN溶液,再加入1mL1.5mol·L-1硫酸 | 溶液先变红,加入硫酸后变为浅黄色 |
| ⑦ | 取1mL0.005mol·L-1FeCl3溶液(无色) | 溶液为无色 |
(6)为了进一步确认现象a中使溶液呈浅黄色的微粒只有Fe(SCN)3,补充完整实验⑦的操作
您最近一年使用:0次



