解题方法
1 . 氯亚铂酸钾是合成绝大部分二价铂化合物的原料,广泛应用于电镀、医药中间体、催化剂前驱体等的制备。
已知:
利用Pt废料制备氯亚铂酸钾,流程如下:
(2)关于实验步骤说法错误的是___________。
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目___________ 。
(4)步骤⑦得到的溶液中含 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。
①蒸发浓缩需要控制温度75℃附近的原因___________ 。
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是___________ 。
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是___________ 。___________ 。
已知:
| 氯亚铂酸钾(K2PtCl4) | 水溶性可溶 10 g/L(20℃)、不溶于乙醇、受热分解。 |
| 氯铂酸钾(K2PtCl6) | 溶于热水、微溶于冷水、几乎不溶于乙醇、乙醚。 |
| 氯铂酸(H2PtCl6) | 110℃时部分分解,150℃开始生成金属铂。 |
| 亚硝酸钾(KNO2) | 有一定还原性,还原性:KNO2弱于K2C2O4。 |
| 亚硝酸(HNO2) | 弱酸、不稳定、易分解。 |
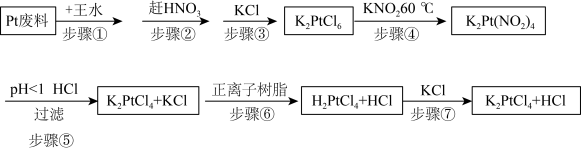
| A.步骤①中王水可以用浓硫酸代替 |
| B.步骤②利用硝酸的易挥发性,适合加强热 |
| C.步骤③加入KCl能促进K2PtCl6晶体析出 |
| D.步骤④用还原剂K2C2O4代替更好 |
(2)关于实验步骤说法错误的是___________。
| A.步骤⑤利用酸性条件下亚硝酸的不稳定性 |
B.步骤⑥用正离子树脂交换是指 和 和 的交换 的交换 |
| C.步骤⑦是氧化还原反应 |
| D.最后得到的溶液中经蒸发能除去HCl |
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目
(4)步骤⑦得到的溶液中含
 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。①蒸发浓缩需要控制温度75℃附近的原因
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是
A.  B.
B.  C.
C.  D.
D.
您最近一年使用:0次
2024高三下·全国·专题练习
2 . 丙烯是三大合成材料的基本原料之一,可用于生产多种重要有机化工原料。由丙烷制丙烯的两种方法如下:
I.丙烷无氧脱氢法:
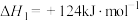
II.丙烷氧化脱氢法: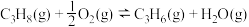

请回答下列问题:
(1)对于反应I,下列条件有利于提高 的平衡转化率的是___________(填字母)
的平衡转化率的是___________(填字母)
(2)某温度下,在刚性密闭容器中充入 发生反应I,起始压强为
发生反应I,起始压强为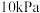 ,平衡时总压强为
,平衡时总压强为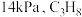 的平衡转化率为
的平衡转化率为___________ 。
(3)一定压强下,向密闭容器中充入一定量的 和
和 ,发生反应
,发生反应
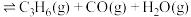 ,
, 的平衡转化率在不同投料比
的平衡转化率在不同投料比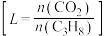 下与温度的关系如图所示,投料比L由小到大的顺序为
下与温度的关系如图所示,投料比L由小到大的顺序为___________ ,判断依据是___________ 。 等副产物,在催化剂的作用下,
等副产物,在催化剂的作用下, 的转化率和
的转化率和 的产率随温度的变化关系如图所示,
的产率随温度的变化关系如图所示, 的选择性:550℃
的选择性:550℃___________ 575℃(填“>”或“<”)。
I.丙烷无氧脱氢法:

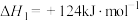
II.丙烷氧化脱氢法:
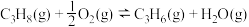

请回答下列问题:
(1)对于反应I,下列条件有利于提高
 的平衡转化率的是___________(填字母)
的平衡转化率的是___________(填字母)| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
 发生反应I,起始压强为
发生反应I,起始压强为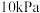 ,平衡时总压强为
,平衡时总压强为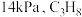 的平衡转化率为
的平衡转化率为(3)一定压强下,向密闭容器中充入一定量的
 和
和 ,发生反应
,发生反应
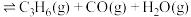 ,
, 的平衡转化率在不同投料比
的平衡转化率在不同投料比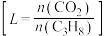 下与温度的关系如图所示,投料比L由小到大的顺序为
下与温度的关系如图所示,投料比L由小到大的顺序为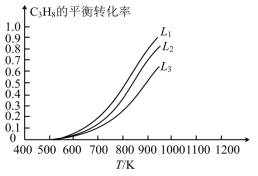
 等副产物,在催化剂的作用下,
等副产物,在催化剂的作用下, 的转化率和
的转化率和 的产率随温度的变化关系如图所示,
的产率随温度的变化关系如图所示, 的选择性:550℃
的选择性:550℃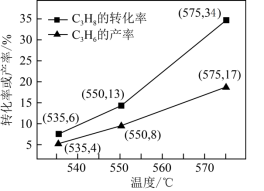
您最近一年使用:0次
2024·浙江温州·二模
3 . 硝酸盐型熔盐(含 )在太阳能光热发电领域被广泛应用.高纯
)在太阳能光热发电领域被广泛应用.高纯 的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下:
的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下: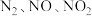 .
.
请回答:
(1)写出溶液A中的所有离子_________ ;方法Ⅱ中,“氧化吸收液”的目的是__________ .
(2)下列说法正确的是_________.
(3)方法Ⅰ中,用 代替
代替 ,得到副产品
,得到副产品 .工业上用
.工业上用 溶液浸取菱镁矿的煅烧粉(含
溶液浸取菱镁矿的煅烧粉(含 ),不断加热蒸出氨气,以获得较高浓度的
),不断加热蒸出氨气,以获得较高浓度的 溶液,其原理是
溶液,其原理是_________ .
(4)在某温度下, 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂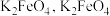 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素_________ .写出 与
与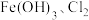 共热制取
共热制取 的化学方程式:
的化学方程式:_________ .
 )在太阳能光热发电领域被广泛应用.高纯
)在太阳能光热发电领域被广泛应用.高纯 的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下:
的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下: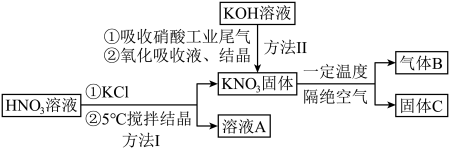
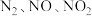 .
.请回答:
(1)写出溶液A中的所有离子
(2)下列说法正确的是_________.
A.方法Ⅰ说明:该条件下,酸性 |
B.方法Ⅱ中,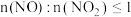 ,氮氧化物才能被足量的 ,氮氧化物才能被足量的 溶液充分吸收 溶液充分吸收 |
C. 固体与浓硫酸共热,可产生红棕色气体 固体与浓硫酸共热,可产生红棕色气体 |
| D.若气体B是一种单质,则所得固体C中不能含有三种元素 |
(3)方法Ⅰ中,用
 代替
代替 ,得到副产品
,得到副产品 .工业上用
.工业上用 溶液浸取菱镁矿的煅烧粉(含
溶液浸取菱镁矿的煅烧粉(含 ),不断加热蒸出氨气,以获得较高浓度的
),不断加热蒸出氨气,以获得较高浓度的 溶液,其原理是
溶液,其原理是(4)在某温度下,
 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂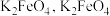 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素 与
与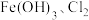 共热制取
共热制取 的化学方程式:
的化学方程式:
您最近一年使用:0次
2024-04-01更新
|
493次组卷
|
5卷引用:压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题浙江省温州市普通高中2024届高三下学期第二次适应性考试(二模)化学试题(已下线)化学(浙江卷01)-2024年高考押题预测卷(已下线)压轴题11 无机化工流程综合分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
4 . 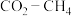 催化重整可获得合成气
催化重整可获得合成气 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为
反应①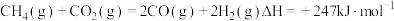
反应②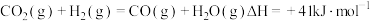
反应③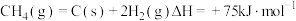
反应④
研究发现在密闭容器中 下,
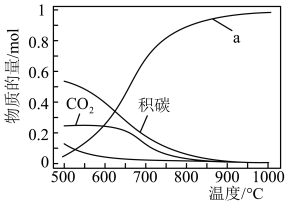
下,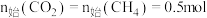 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
 催化重整可获得合成气
催化重整可获得合成气 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为反应①
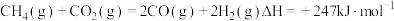
反应②
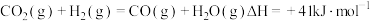
反应③
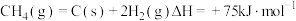
反应④

研究发现在密闭容器中
 下,
下,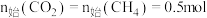 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
A.图中a表示 |
B. 的 的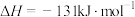 |
C.其他条件不变,在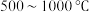 范围,随着温度的升高,平衡时 范围,随着温度的升高,平衡时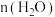 不断增大 不断增大 |
D.当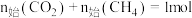 ,其他条件不变时,提高 ,其他条件不变时,提高 的值,能减少平衡时积碳量 的值,能减少平衡时积碳量 |
您最近一年使用:0次
2024-02-13更新
|
1166次组卷
|
4卷引用:江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷
江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题山东省潍坊市2024届高高考模拟训练调研化学试题
解题方法
5 . 根据实验操作及现象,得出结论正确的是
| 选项 | 实验操作及现象 | 结论 |
| A |  和稀硫酸混合产生浅黄色沉淀和刺激性气味的气体 和稀硫酸混合产生浅黄色沉淀和刺激性气味的气体 | 硫酸表现氧化性, 表现还原性 表现还原性 |
| B | 向酸性 溶液中滴加乙苯,溶液褪色 溶液中滴加乙苯,溶液褪色 | 乙苯的苯环中含有碳碳双键 |
| C | Ag与HI溶液生成黄色沉淀和无色气体 |  和 和 生成AgI,促进Ag和HI溶液发生反应生成AgI和 生成AgI,促进Ag和HI溶液发生反应生成AgI和 |
| D | 在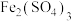 溶液中加入铜粉,溶液变蓝色 溶液中加入铜粉,溶液变蓝色 | 氧化性: , ,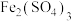 和Cu发生置换反应 和Cu发生置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023高三·全国·专题练习
6 . 25℃,向40mL0.05mol/L的FeCl3溶液中加入10mL0.15mol/L的KSCN溶液,发生反应:Fe3++3SCN- Fe(SCN)3,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示(盐类的水解影响可忽略不计)。下列说法正确的是
Fe(SCN)3,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示(盐类的水解影响可忽略不计)。下列说法正确的是
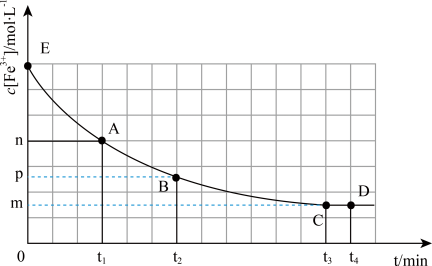
 Fe(SCN)3,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示(盐类的水解影响可忽略不计)。下列说法正确的是
Fe(SCN)3,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示(盐类的水解影响可忽略不计)。下列说法正确的是
| A.在该反应过程中,A点的正反应速率小于B点的逆反应速率 |
| B.E点对应的坐标为(0,0.04) |
C.该反应的平衡常数K=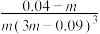 |
| D.t4时向溶液中加入50mL0.1mol/LKCl溶液,平衡不移动 |
您最近一年使用:0次
2023·广东汕头·三模
7 . 为研究工业废水(含有 和Cu2+,且
和Cu2+,且 的浓度远大于Cu2+)的处理方法,某实验小组用NaOH溶液调节该废水的pH(溶液体积变化忽略不计),测得上层清液中铜元素的含量随pH变化如图所示:
的浓度远大于Cu2+)的处理方法,某实验小组用NaOH溶液调节该废水的pH(溶液体积变化忽略不计),测得上层清液中铜元素的含量随pH变化如图所示:
下列有关说法正确的是
 和Cu2+,且
和Cu2+,且 的浓度远大于Cu2+)的处理方法,某实验小组用NaOH溶液调节该废水的pH(溶液体积变化忽略不计),测得上层清液中铜元素的含量随pH变化如图所示:
的浓度远大于Cu2+)的处理方法,某实验小组用NaOH溶液调节该废水的pH(溶液体积变化忽略不计),测得上层清液中铜元素的含量随pH变化如图所示:| 图表 | 查阅资料 |
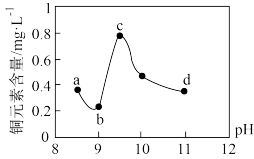 | 存在平衡Ⅰ: 存在平衡Ⅱ:  |
| A.处理工业废水中的Cu2+最佳点应选择c点 |
| B.bc段:随pH升高,Cu2+的量增加,平衡Ⅰ正向移动 |
C.cd段:随pH升高, 增大,再次有Cu(OH)2成 增大,再次有Cu(OH)2成 |
| D.d点以后,随pH升高,铜元素含量下降并保持不变 |
您最近一年使用:0次
2023·山东·高考真题
真题
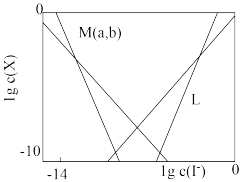
8 . 在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系: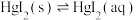 ;
;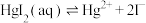 ;
;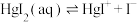 ;
; ;
; ,平衡常数依次为
,平衡常数依次为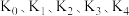 。已知
。已知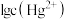 、
、 ,
, 、
、 随
随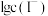 的变化关系如图所示,下列说法错误的是
的变化关系如图所示,下列说法错误的是
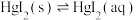 ;
;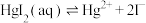 ;
;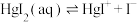 ;
; ;
; ,平衡常数依次为
,平衡常数依次为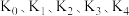 。已知
。已知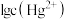 、
、 ,
, 、
、 随
随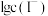 的变化关系如图所示,下列说法错误的是
的变化关系如图所示,下列说法错误的是
A.线 表示 表示 的变化情况 的变化情况 |
B.随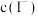 增大, 增大,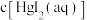 先增大后减小 先增大后减小 |
C.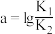 |
D.溶液中I元素与 元素的物质的量之比始终为 元素的物质的量之比始终为 |
您最近一年使用:0次
2023-06-19更新
|
7085次组卷
|
8卷引用:专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)
(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点1 电离平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题03 化学平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(不定项选择题)山东省齐鲁名师联盟2023-2024学年高三上学期第一次诊断考试化学试题
2023·江苏盐城·模拟预测
名校
9 . 卤族元素单质及其化合物应用广泛。 具有与卤素单质相似的化学性质。
具有与卤素单质相似的化学性质。 在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的
在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的 反应生成硫酰氟(
反应生成硫酰氟( )。
)。 与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37.
与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37. 通入
通入 酸性溶液中可制得黄绿色气体
酸性溶液中可制得黄绿色气体 ,该气体常用作自来水消毒剂。工业用
,该气体常用作自来水消毒剂。工业用 制备
制备 的热化学方程式为
的热化学方程式为

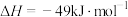 。下列关于反应
。下列关于反应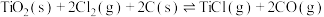 的说法
的说法不正确 的是
 具有与卤素单质相似的化学性质。
具有与卤素单质相似的化学性质。 在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的
在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的 反应生成硫酰氟(
反应生成硫酰氟( )。
)。 与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37.
与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37. 通入
通入 酸性溶液中可制得黄绿色气体
酸性溶液中可制得黄绿色气体 ,该气体常用作自来水消毒剂。工业用
,该气体常用作自来水消毒剂。工业用 制备
制备 的热化学方程式为
的热化学方程式为

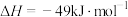 。下列关于反应
。下列关于反应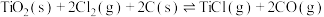 的说法
的说法A.保持其他条件不变,平衡时升高温度,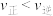 |
B.保持其他条件不变,平衡时通入 ,达到新平衡时 ,达到新平衡时 变小 变小 |
C.反应生成1mol ,转移电子数目为 ,转移电子数目为 |
D.及时分离出CO,有利于 生成 生成 |
您最近一年使用:0次
2023·山东济宁·三模
10 . 利用某一工业钴渣(主要成分为 ,含少量
,含少量 、
、 、MgO、CuO)制备金属钴的流程如图所示:
、MgO、CuO)制备金属钴的流程如图所示:
①沉淀1为黄钠铁矾,化学式为: 。
。
②当某离子浓度 时认为沉淀完全,
时认为沉淀完全, ,
, ,
, ,
, ,
,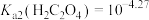
③氧化性:
(1)“浸出”过程中 元发生反应的离子方程式为
元发生反应的离子方程式为_______ ,用盐酸代替硫酸的缺点是_______ 。
(2)“浸出液”中加入 的作用是
的作用是_______ ,试剂a为_______ 。
(3)有机萃取剂用HR表示,发生萃取的反应可表示为 ,为回收
,为回收 ,可向有机相中加入一定浓度的
,可向有机相中加入一定浓度的 ,将其反萃取到水相,其原理是
,将其反萃取到水相,其原理是_______ 。
(4)沉淀2为 ,当
,当 恰好沉淀完全时,溶液中HF浓度为
恰好沉淀完全时,溶液中HF浓度为 ,则此时溶液的pH=
,则此时溶液的pH=_______ 。用 溶液沉钴,其水溶液中存在反应
溶液沉钴,其水溶液中存在反应 ,其平衡常数为K,则K=
,其平衡常数为K,则K=_______ 。
(5)已知氧化性: 。工业上采用惰性电极电解
。工业上采用惰性电极电解 溶液制取钴,不用
溶液制取钴,不用 溶液代替
溶液代替 溶液的原因是
溶液的原因是_______ 。
 ,含少量
,含少量 、
、 、MgO、CuO)制备金属钴的流程如图所示:
、MgO、CuO)制备金属钴的流程如图所示: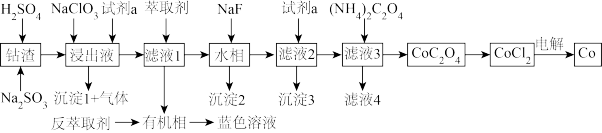
①沉淀1为黄钠铁矾,化学式为:
 。
。②当某离子浓度
 时认为沉淀完全,
时认为沉淀完全, ,
, ,
, ,
, ,
,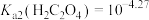
③氧化性:

(1)“浸出”过程中
 元发生反应的离子方程式为
元发生反应的离子方程式为(2)“浸出液”中加入
 的作用是
的作用是(3)有机萃取剂用HR表示,发生萃取的反应可表示为
 ,为回收
,为回收 ,可向有机相中加入一定浓度的
,可向有机相中加入一定浓度的 ,将其反萃取到水相,其原理是
,将其反萃取到水相,其原理是(4)沉淀2为
 ,当
,当 恰好沉淀完全时,溶液中HF浓度为
恰好沉淀完全时,溶液中HF浓度为 ,则此时溶液的pH=
,则此时溶液的pH= 溶液沉钴,其水溶液中存在反应
溶液沉钴,其水溶液中存在反应 ,其平衡常数为K,则K=
,其平衡常数为K,则K=(5)已知氧化性:
 。工业上采用惰性电极电解
。工业上采用惰性电极电解 溶液制取钴,不用
溶液制取钴,不用 溶液代替
溶液代替 溶液的原因是
溶液的原因是
您最近一年使用:0次



