1 . 我国提出“CO2排放力争于2023年前达到峰值,努力争取2060年前实现碳中和”。研发CO2的利用技术,降低空气中CO2的含量是实现该目标的重要途径。
(1)下面是用H2捕捉CO2时发生的两个反应:
I.CO2(g)+4H2(g) CH4(g)+2H2O(g) ∆H1
CH4(g)+2H2O(g) ∆H1
II.CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
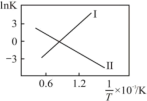
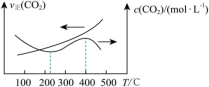
①反应I、II的lnK随1/T的变化如图所示,则ΔH2___________ 0(填“>”“<”或“=”)0;有利于反应I自发进行的温度是___________ (填“高温”或“低温”)。___________ ,而速率仍然增大的可能原因是___________ ___________ ,反应II的平衡常数Kp为___________ (保留两位有效数字)。[已知:CH4的选择性=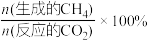 ]
]
(2)利用化学链将高炉废气中的CO2转化为CO的示意图如下。___________ ,该化学链的总反应是___________ 。
(1)下面是用H2捕捉CO2时发生的两个反应:
I.CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ∆H1
CH4(g)+2H2O(g) ∆H1II.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2①反应I、II的lnK随1/T的变化如图所示,则ΔH2
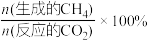 ]
](2)利用化学链将高炉废气中的CO2转化为CO的示意图如下。

您最近半年使用:0次
2 . 向锌氨溶液(由 液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂
液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂 。不同
。不同 下(其它条件不变)达到平衡后
下(其它条件不变)达到平衡后 和
和 的萃取效果如图所示。
的萃取效果如图所示。
反应ⅱ:
反应ⅲ:
② 的锌氨溶液中,
的锌氨溶液中,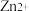 主要以
主要以 形式存在
形式存在
下列说法不正确 的是
 液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂
液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂 。不同
。不同 下(其它条件不变)达到平衡后
下(其它条件不变)达到平衡后 和
和 的萃取效果如图所示。
的萃取效果如图所示。

反应ⅱ:

反应ⅲ:

②
 的锌氨溶液中,
的锌氨溶液中,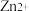 主要以
主要以 形式存在
形式存在下列说法
A.锌氨溶液中存在 的电离平衡和 的电离平衡和 的水解平衡 的水解平衡 |
B. 时,加入萃取剂 时,加入萃取剂 达到平衡后, 达到平衡后,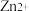 主要以 主要以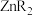 的形式存在 的形式存在 |
C. 由8到10,萃取剂中氨的含量增大的原因是反应ⅲ的平衡向正反应方向移动 由8到10,萃取剂中氨的含量增大的原因是反应ⅲ的平衡向正反应方向移动 |
D. 由8到6, 由8到6, 和 和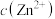 均增大,前者对反应ⅱ的影响小于后者 均增大,前者对反应ⅱ的影响小于后者 |
您最近半年使用:0次
3 . 乙烯合成的发展体现了化学科学与技术的不断进步。
(1)用烃类热裂解法制乙烯是乙烯工业化生产的开端。
①乙烷高温裂解制备乙烯(反应Ⅰ)的化学方程式是______ 。
②在裂解过程中伴随反应Ⅱ: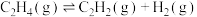 ,在高温下缩短
,在高温下缩短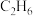 在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ
在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ______ 反应Ⅱ。(填“>”“<”或“=”)
(2)乙炔选择性加氢制乙烯是石油化工领域重要的发展阶段。
以钯(Pd)为催化剂可有效提高乙烯产率,在催化剂表面的反应机理如下图所示(吸附在催化剂表面的粒子用*标注)。______ 。
a.NP-Pd催化反应过程中步骤Ⅰ为放热反应
b.ISA-Pd催化反应过程中步骤Ⅱ为决速步骤
c.两种催化剂均能降低总反应的反应热
②吸附态乙烯( )脱离催化剂表面,可得到
)脱离催化剂表面,可得到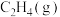 ,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制
,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制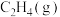 选择性较好的催化剂是
选择性较好的催化剂是______ 。
(3)以 为原料用不同的方法制乙烯有助于实现碳中和。
为原料用不同的方法制乙烯有助于实现碳中和。
I.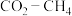 干气重整制乙烯。下图是2种投料比[
干气重整制乙烯。下图是2种投料比[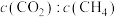 ,分别为1:1、2:1]下,反应温度对
,分别为1:1、2:1]下,反应温度对 平衡转化率影响的曲线。
平衡转化率影响的曲线。______ 。
②当曲线a、b对应的投料比达到相同的 平衡转化率时,对应的反应温度与投料比的关系是
平衡转化率时,对应的反应温度与投料比的关系是______ 。
Ⅱ.双金属串联催化剂电催化 制乙烯,装置示意图如图所示。
制乙烯,装置示意图如图所示。
已知:法拉第效率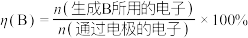
______ 。
④该环境下,测得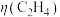 可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是______ mol。
(1)用烃类热裂解法制乙烯是乙烯工业化生产的开端。
①乙烷高温裂解制备乙烯(反应Ⅰ)的化学方程式是
②在裂解过程中伴随反应Ⅱ:
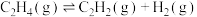 ,在高温下缩短
,在高温下缩短 在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ
在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ(2)乙炔选择性加氢制乙烯是石油化工领域重要的发展阶段。
以钯(Pd)为催化剂可有效提高乙烯产率,在催化剂表面的反应机理如下图所示(吸附在催化剂表面的粒子用*标注)。
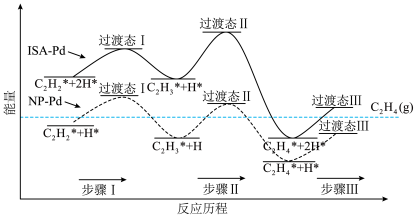
a.NP-Pd催化反应过程中步骤Ⅰ为放热反应
b.ISA-Pd催化反应过程中步骤Ⅱ为决速步骤
c.两种催化剂均能降低总反应的反应热
②吸附态乙烯(
 )脱离催化剂表面,可得到
)脱离催化剂表面,可得到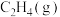 ,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制
,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制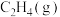 选择性较好的催化剂是
选择性较好的催化剂是(3)以
 为原料用不同的方法制乙烯有助于实现碳中和。
为原料用不同的方法制乙烯有助于实现碳中和。I.
 干气重整制乙烯。下图是2种投料比[
干气重整制乙烯。下图是2种投料比[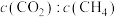 ,分别为1:1、2:1]下,反应温度对
,分别为1:1、2:1]下,反应温度对 平衡转化率影响的曲线。
平衡转化率影响的曲线。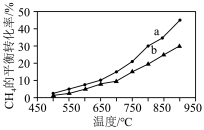
②当曲线a、b对应的投料比达到相同的
 平衡转化率时,对应的反应温度与投料比的关系是
平衡转化率时,对应的反应温度与投料比的关系是Ⅱ.双金属串联催化剂电催化
 制乙烯,装置示意图如图所示。
制乙烯,装置示意图如图所示。已知:法拉第效率
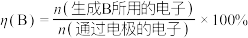
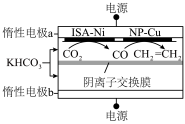
④该环境下,测得
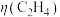 可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
您最近半年使用:0次
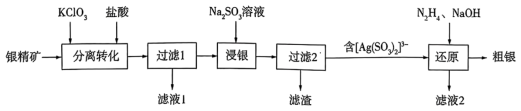
4 . 以银精矿(主要成分为Ag2S、FeS2、ZnS)为原料采用“预氧化湿法提银”工艺流程如下: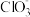 有较强的氧化性,被还原为Cl-。
有较强的氧化性,被还原为Cl-。
(1)“分离转化”时,为提高 的转化率可采取的措施是
的转化率可采取的措施是___________ ; 转化为AgCl和S的化学方程式为
转化为AgCl和S的化学方程式为___________ 。
(2)已知: ,
,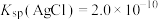 ,若不加KClO3,直接加氯化物,依据反应
,若不加KClO3,直接加氯化物,依据反应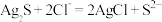 ,能否实现此反应较完全转化?并说明理由:
,能否实现此反应较完全转化?并说明理由:___________ 。
(3)滤液1中的金属阳离子有___________ 。在整个工艺中可循环利用的物质是___________ 。
(4)“浸银”时,发生反应的离子方程式为___________ 。
(5)“分离转化”时,除上述方法外也可以使用过量FeCl3、HCl和 的混合液作为浸出剂,将Ag2S中的银以
的混合液作为浸出剂,将Ag2S中的银以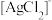 形式浸出,建立化学平衡状态。请解释浸出剂中
形式浸出,建立化学平衡状态。请解释浸出剂中 、H⁺的作用
、H⁺的作用___________ 。
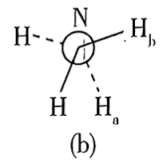
(6)还原过程中所用的N2H4,分子可能有两种不同的构象——顺式和反式,沿N—N键轴方向的投影如下图所示,其中(a)为反式,(b)为顺式。测得 分子极性很大,说明它具有
分子极性很大,说明它具有___________ 构象(填“反式”或“顺式”)。
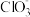 有较强的氧化性,被还原为Cl-。
有较强的氧化性,被还原为Cl-。(1)“分离转化”时,为提高
 的转化率可采取的措施是
的转化率可采取的措施是 转化为AgCl和S的化学方程式为
转化为AgCl和S的化学方程式为(2)已知:
 ,
,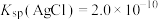 ,若不加KClO3,直接加氯化物,依据反应
,若不加KClO3,直接加氯化物,依据反应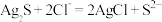 ,能否实现此反应较完全转化?并说明理由:
,能否实现此反应较完全转化?并说明理由:(3)滤液1中的金属阳离子有
(4)“浸银”时,发生反应的离子方程式为
(5)“分离转化”时,除上述方法外也可以使用过量FeCl3、HCl和
 的混合液作为浸出剂,将Ag2S中的银以
的混合液作为浸出剂,将Ag2S中的银以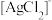 形式浸出,建立化学平衡状态。请解释浸出剂中
形式浸出,建立化学平衡状态。请解释浸出剂中 、H⁺的作用
、H⁺的作用(6)还原过程中所用的N2H4,分子可能有两种不同的构象——顺式和反式,沿N—N键轴方向的投影如下图所示,其中(a)为反式,(b)为顺式。测得
 分子极性很大,说明它具有
分子极性很大,说明它具有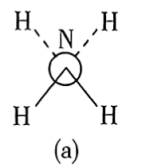
您最近半年使用:0次
7日内更新
|
76次组卷
|
2卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
解题方法
5 . 废电池中含磷酸铁锂,提锂后的废渣主要含 、
、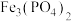 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。 、
、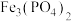 均难溶于水。
均难溶于水。
ii.将 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。
(1)酸浸前,将废渣粉碎的目的是________ 。
(2)从平衡移动的角度解释加入硝酸溶解 的原因:
的原因:________ 。
(3)在酸浸液中加入 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中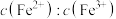 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用:________ 。 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:________ 。
(5)过滤得到电池级 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有________ 。
(6)磷酸铁锂-石墨电池的总反应: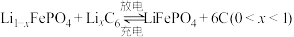 。
。
①高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是________ 。
②放电时负极的电极反应式是________ 。
 、
、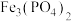 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。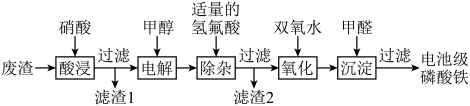
 、
、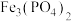 均难溶于水。
均难溶于水。ii.将
 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。(1)酸浸前,将废渣粉碎的目的是
(2)从平衡移动的角度解释加入硝酸溶解
 的原因:
的原因:(3)在酸浸液中加入
 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中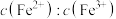 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用: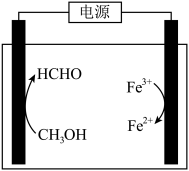
 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:(5)过滤得到电池级
 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有(6)磷酸铁锂-石墨电池的总反应:
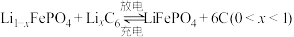 。
。①高温条件下,
 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是②放电时负极的电极反应式是
您最近半年使用:0次
6 . 应用(CO2催化加氢规模化生产甲醇是综合利用(CO2,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
 ,需通过以下两步实现:
,需通过以下两步实现:
I.

II.

(1)反应过程中各物质的相对能量变化情况如图所示: =
=___________ ,反应是快反应___________ (填“Ⅰ”或“Ⅱ”)
(2)若
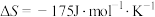 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。
(3)已知反应 ,在540K下,按初始投料
,在540K下,按初始投料 、
、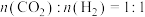 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:___________ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数Kp=___________ (MPa)-2(用平衡分压计算)。
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为___________ 。
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式___________ 。

 ,需通过以下两步实现:
,需通过以下两步实现:I.


II.


(1)反应过程中各物质的相对能量变化情况如图所示:

 =
=(2)若

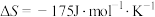 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。| A.0℃ | B.70℃ | C.150℃ | D.280°C |
(3)已知反应
 ,在540K下,按初始投料
,在540K下,按初始投料 、
、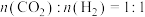 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:
②N点在b曲线上,540K时的压强平衡常数Kp=
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式
您最近半年使用:0次
解题方法
7 . 氯亚铂酸钾是合成绝大部分二价铂化合物的原料,广泛应用于电镀、医药中间体、催化剂前驱体等的制备。
已知:
利用Pt废料制备氯亚铂酸钾,流程如下:
(2)关于实验步骤说法错误的是___________。
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目___________ 。
(4)步骤⑦得到的溶液中含 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。
①蒸发浓缩需要控制温度75℃附近的原因___________ 。
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是___________ 。
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是___________ 。___________ 。
已知:
| 氯亚铂酸钾(K2PtCl4) | 水溶性可溶 10 g/L(20℃)、不溶于乙醇、受热分解。 |
| 氯铂酸钾(K2PtCl6) | 溶于热水、微溶于冷水、几乎不溶于乙醇、乙醚。 |
| 氯铂酸(H2PtCl6) | 110℃时部分分解,150℃开始生成金属铂。 |
| 亚硝酸钾(KNO2) | 有一定还原性,还原性:KNO2弱于K2C2O4。 |
| 亚硝酸(HNO2) | 弱酸、不稳定、易分解。 |
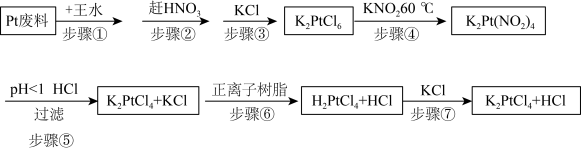
| A.步骤①中王水可以用浓硫酸代替 |
| B.步骤②利用硝酸的易挥发性,适合加强热 |
| C.步骤③加入KCl能促进K2PtCl6晶体析出 |
| D.步骤④用还原剂K2C2O4代替更好 |
(2)关于实验步骤说法错误的是___________。
| A.步骤⑤利用酸性条件下亚硝酸的不稳定性 |
B.步骤⑥用正离子树脂交换是指 和 和 的交换 的交换 |
| C.步骤⑦是氧化还原反应 |
| D.最后得到的溶液中经蒸发能除去HCl |
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目
(4)步骤⑦得到的溶液中含
 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。①蒸发浓缩需要控制温度75℃附近的原因
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是
A.  B.
B.  C.
C.  D.
D.
您最近半年使用:0次
2024·黑龙江·模拟预测
解题方法
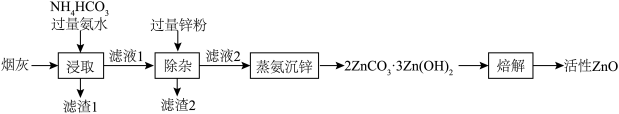
8 . 活性ZnO俗名锌白,用作白色颜料,也广泛用于生产玻璃、橡胶、油漆、塑料等。利用化工厂产生的烟灰(ZnO,还含有少量CuO、MnO2、FeO等杂质)制备活性ZnO的工艺流程如图。
(1)Zn的基态价电子排布式为___________ ,烟灰中的主要成分ZnO发生反应的化学方程式为___________ ,滤渣1的主要成分为___________ 。
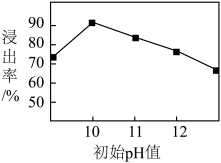
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是___________ 。 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式___________ 。
(4)“蒸氨”时会出现白色固体 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率___________ (填“小于”、“大于”或“等于”)100%。
(6)已知 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。___________ (填化学式)。
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为___________ 。
(1)Zn的基态价电子排布式为
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是
 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式(4)“蒸氨”时会出现白色固体
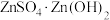 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率
(6)已知
 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。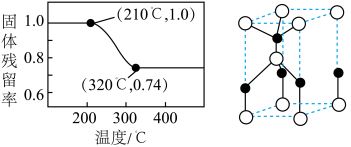
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为
您最近半年使用:0次
9 . 某校化学学习小组探究 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题:
(1)写出实验中制备 的化学方程式
的化学方程式________ 。
(2)配制100mL
 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和________ 。
【实验探究】
向3mL
 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
猜想1: 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;
猜想2: 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。
(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,________ ,证明猜想1不成立。
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。
已知:常温下,溶液中 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。________ (填写微粒符号),依据的实验证据是________ 。
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度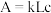 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验结果讨论:若 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。
(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如: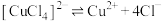 。
。
丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为: 溶液,
溶液,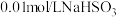 溶液,
溶液, 固体,
固体,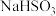 固体
固体
 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题: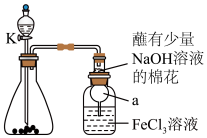
(1)写出实验中制备
 的化学方程式
的化学方程式(2)配制100mL

 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和【实验探究】
向3mL

 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:猜想1:
 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;猜想2:
 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是
 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。组别 | 溶液1(1mL) | 溶液2(2mL) | 现象 |
a |
|
| 溶液1和溶液2混合后,组别a、b、c所得溶液红棕色依次加深。 |
b |  的饱和溶液,用 的饱和溶液,用 固体调节. 固体调节. | ||
c |  的饱和溶液,用 的饱和溶液,用 固体调节 固体调节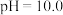 |
 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。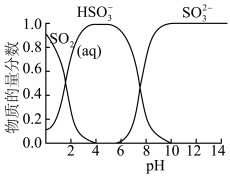
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度
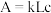 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验序号 | 操作 | 吸光度 |
1 | 把1mL 0.1mol/L 溶液与2mL 溶液与2mL 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 |
|
2 |
|
 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若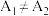 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如:
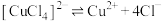 。
。丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为:
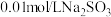 溶液,
溶液,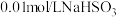 溶液,
溶液, 固体,
固体,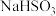 固体
固体实验序号 | 操作 | 吸光度 | 结论 |
3 | 向3mL 0.1mol/L 溶液中通入 溶液中通入 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 |
| |
4 |
  (填“大于”、“小于”或“等于”) (填“大于”、“小于”或“等于”) | 平衡向 |
您最近半年使用:0次
10 . 回答下列问题。
(1)已知下列热化学方程式:
Ⅰ.
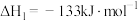
Ⅱ.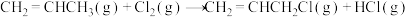
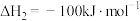
在相同条件下, 的正反应的活化能
的正反应的活化能 为
为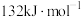 ,则逆反应的活化能
,则逆反应的活化能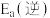 为
为___________  。
。
(2)查阅资料得知,反应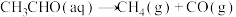 在含有少量I2的溶液中分两步进行:
在含有少量I2的溶液中分两步进行:
第Ⅰ步反应为 (慢反应);
(慢反应);
第Ⅱ步为快反应。
增大I2的浓度___________ (填“能”或“不能”)明显增大总反应的平均速率,理由为___________ 。
(3)氯化铜晶体( )常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
___________ (填字母,下同)。
a.KMnO4溶液 b.氯水 c.溴水 d.H2O2溶液
②溶液C中加入试剂y可以调节溶液pH,从而除去 而不引入杂质。试剂y可选用下列物质中的
而不引入杂质。试剂y可选用下列物质中的___________ 。
a.Cu b.CuO c. d.NaOH
d.NaOH
③SOCl2与水反应的化学方程式为___________ 。
④SOCl2与 混合并加热,可得到无水CuCl2的原因是
混合并加热,可得到无水CuCl2的原因是___________ 。
(1)已知下列热化学方程式:
Ⅰ.

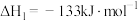
Ⅱ.
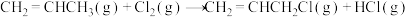
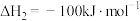
在相同条件下,
 的正反应的活化能
的正反应的活化能 为
为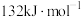 ,则逆反应的活化能
,则逆反应的活化能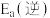 为
为 。
。(2)查阅资料得知,反应
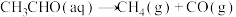 在含有少量I2的溶液中分两步进行:
在含有少量I2的溶液中分两步进行:第Ⅰ步反应为
 (慢反应);
(慢反应);第Ⅱ步为快反应。
增大I2的浓度
(3)氯化铜晶体(
 )常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下: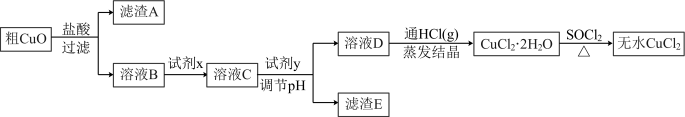
 |  |  | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 6.7 |
已知:氯化亚砜(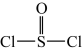 )熔点-105℃,沸点78.8℃,易水解。
)熔点-105℃,沸点78.8℃,易水解。
a.KMnO4溶液 b.氯水 c.溴水 d.H2O2溶液
②溶液C中加入试剂y可以调节溶液pH,从而除去
 而不引入杂质。试剂y可选用下列物质中的
而不引入杂质。试剂y可选用下列物质中的a.Cu b.CuO c.
 d.NaOH
d.NaOH③SOCl2与水反应的化学方程式为
④SOCl2与
 混合并加热,可得到无水CuCl2的原因是
混合并加热,可得到无水CuCl2的原因是
您最近半年使用:0次

 溶液
溶液



