1 . 已知 呈粉红色,
呈粉红色,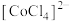 呈蓝色,
呈蓝色,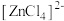 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
 呈粉红色,
呈粉红色,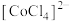 呈蓝色,
呈蓝色,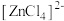 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
A.等物质的量的 和 和 中σ键数之比为3:2 中σ键数之比为3:2 |
| B.由实验①可推知△H<0 |
| C.实验②是由于c(H2O)增大,导致平衡逆向移动 |
D.由实验③可知配离子的稳定性: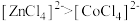 |
您最近一年使用:0次
2020-07-11更新
|
5788次组卷
|
30卷引用:四川省遂宁市2020-2021学年高二上学期期末教学水平监测化学试题
四川省遂宁市2020-2021学年高二上学期期末教学水平监测化学试题2020年天津卷化学高考试题(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)热点8 无机化工流程分析(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)江苏省盐城市阜宁中学2020-2021学年高二下学期期中考试化学试题(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年天津卷化学高考真题变式题1-12福建省龙岩第一中学2021-2022学年高二下学期第一次月考化学试题北京市第二十二中学2021-2022学年高三上学期12月阶段性测试理科化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)黑龙江省牡丹江市第一高级中学2021-2022学年高二下学期4月月考化学试题福建省三明市教研联盟2021-2022学年高二下学期期中联考化学试题(已下线)专题9 平衡移动专练天津市2023届高三上学期第一次模拟测试化学试题新疆石河子第一中学2021-2022学年高二4月月考化学试题河北省邯郸市第一中学2022-2023学年高三上学期一轮复习(四)化学试题四川省巴中市恩阳区2022-2023学年高二下学期4月期中考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高二下学期5月月考化学试题广东省广州市执信中学2023-2024学年高三上学期开学考试化学试题(已下线)第7讲 配合物与超分子江苏省海安高级中学2023-2024学年高二上学期第一次考试化学试题广东省广州市执信中学2023-2024学年高三上学期 开学化学试卷山东省滨州市阳信县第一中学2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
2 . 下列实验中,对现象的解释不正确 的是
| 选项 | A | B | C | D |
| 装置及操作 |  向右轻轻推动活塞压缩体积 | 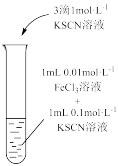 | 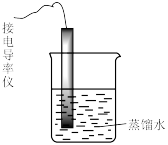 分别测定20℃和80℃蒸馏水的电导率 | 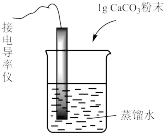 |
| 现象 | 气体红棕色先变深再变浅 | 溶液血红色加深 | 80℃蒸馏水的电导率大于20℃的 | 加入 粉末后电导率增大 粉末后电导率增大 |
| 解释 | 压强增大, 平衡先逆向移动,再正向移动 平衡先逆向移动,再正向移动 | 增大反应物浓度, 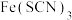 平衡正向移动 平衡正向移动 | 温度升高,水的电离平衡正向移动 |  在水中存在 在水中存在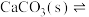  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-06更新
|
931次组卷
|
13卷引用:北京海淀区2022-2023学年高二上学期期末考试化学试题
北京海淀区2022-2023学年高二上学期期末考试化学试题北京一零一中学2022-2023高二上学期期末考试化学试题北京市首都师范大学附属中学2022-2023学年高二上学期期末考试化学试题天津市部分区2023-2024学年高二上学期期末练习化学试题北京市顺义牛栏山第一中学2022-2023学年高二下学期3月月考化学试题河南省濮阳市第一高级中学2022-2023学年高二下学期期中质量检测化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十三中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷四川省德阳市什邡中学2023-2024学年高二上学期11月期中考试化学试题北京市第五十中学2023-2024学年高二上学期12月月考化学试题北京交通大学附属中学第二分校2023-2024学年高二上学期12月月考化学试题
名校
3 . 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
下列说法正确的是
 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
| 平衡v正(SO2)/mol/(L·s) | v1 | v2 | v3 |
| 平衡c(SO3)mol/L | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率/α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
| A.v1<v2,c2<2c1 | B.K1>K3,p2>2p3 |
| C.v1>v3,α1(SO2)>α3(SO2) | D.c2>2c3,α2(SO3)+α3(SO2)<1 |
您最近一年使用:0次
2021-08-14更新
|
1550次组卷
|
25卷引用:浙江省诸暨市2019-2020学年高二上学期期末考试化学试题
浙江省诸暨市2019-2020学年高二上学期期末考试化学试题宁夏银川一中2020-2021学年高二上学期期末考试化学试题浙江省宁波市九校2020-2021学年高二上学期期末联考化学试题(已下线)【绍兴新东方】绍兴高中化学00008天津市静海区第一中学2020届高三下学期第六周周末训练化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡 高考帮人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关(已下线)【浙江新东方】高中化学20210304-010(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)四川省蓬安中学校2019-2020学年高二上学期开学考试化学试题(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题广西浦北中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.3.3 温度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)2.3.2 压强变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)吉林省长春市第二中学2021-2022学年高二上学期第一次月考化学试题江西省吉安一中2021-2022学年高二上学期第一次段考化学试题江西省九江市第一中学2021-2022学年高二上学期期中考试化学试题江西省宜春市八校2022-2023学年高二上学期12月联考化学试题河北省部分学校2023-2024学年高二上学期10月联考化学试题安徽省当涂第一中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
4 . 某温度下,改变0.1mol/LK2Cr2O7溶液的pH时,各种含铬元素微粒及OH-浓度变化如图所示(已知H2CrO4是二元酸),下列有关说法中正确的是


| A.该温度下的Kw=10-13 |
B.溶液中存在平衡 +H2O⇌2 +H2O⇌2 +2H+,该温度下此反应的K=10-13.2 +2H+,该温度下此反应的K=10-13.2 |
| C.向0.1mol/LK2Cr2O7溶液中加入一定量NaOH固体,溶液橙色加深 |
D.E点溶液中存在:c(K+)<2c( )+3c( )+3c( ) ) |
您最近一年使用:0次
2022-04-29更新
|
788次组卷
|
4卷引用:湖北省武汉外国语学校2022-2023学年高二上学期期末考试化学试题
湖北省武汉外国语学校2022-2023学年高二上学期期末考试化学试题 东北三省四城市联考暨沈阳市2021-2022学年高三质量监测(二)化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)辽宁省沈阳市同泽中学2022-2023学年高二12月月考化学试题
名校
解题方法
5 . 实验小组同学为探究Fe2+性质,进行如下实验。
【实验Ⅰ】向2mL 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。
(1)甲同学通过上述实验分析 具有
具有_______ (填“氧化”或“还原”)性。
乙同学查阅资料发现 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
(2) 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为_______ 。
【实验Ⅱ】验证 与
与 发生反应
发生反应_______ 。
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是_______ 。
丙同学设计实验进一步证明 可与
可与 反应。
反应。
【实验Ⅲ】
①X为_______ 。
②实验能够证实 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是_______ 。
(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低 ,
,_______ 。
【实验Ⅰ】向2mL
 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。(1)甲同学通过上述实验分析
 具有
具有乙同学查阅资料发现
 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。(2)
 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为【实验Ⅱ】验证
 与
与 发生反应
发生反应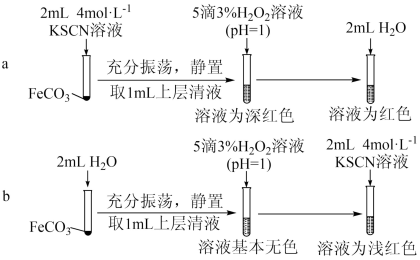
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是
丙同学设计实验进一步证明
 可与
可与 反应。
反应。【实验Ⅲ】
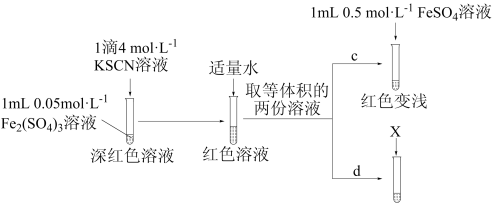
①X为
②实验能够证实
 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低
 ,
,
您最近一年使用:0次
2022-05-30更新
|
1314次组卷
|
11卷引用:北京市第八十中学2022-2023学年高三上学期期末测试化学试题
北京市第八十中学2022-2023学年高三上学期期末测试化学试题北京市东城区2022届高三综合练习(二模)化学试题北京市育才学校2022届高三下学期三模化学试题北京市一零一中学2022届高三三模化学试题(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)北京市北京一零一中学2022-2023学年高三上学期统练7化学试题(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)实验探究题北京师范大学附属中学预科部2023-2024学年高三上学期12月月考化学试题北京大学附属中学预科部2023-2024学年高三上学期12月阶段练习化学试题
名校
解题方法
6 . 研究碘在不同溶剂中的溶解性。进行实验:
①向试管中放入一小粒碘晶体,再加入蒸馏水,充分溶解后,得到黄色溶液a和少量不溶的碘;
②取5mL溶液a,加入 四氯化碳,振荡,静置,液体分层,下层呈紫色,上层无色;
四氯化碳,振荡,静置,液体分层,下层呈紫色,上层无色;
③将②所得下层溶液全部取出,加入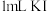 溶液,振荡,静置,下层溶液紫色变浅,上层溶液b呈黄色(颜色比溶液a深)。
溶液,振荡,静置,下层溶液紫色变浅,上层溶液b呈黄色(颜色比溶液a深)。
已知:ⅰ.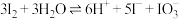 ;
;
ⅱ. 。
。
下列说法不正确 的是
①向试管中放入一小粒碘晶体,再加入蒸馏水,充分溶解后,得到黄色溶液a和少量不溶的碘;
②取5mL溶液a,加入
 四氯化碳,振荡,静置,液体分层,下层呈紫色,上层无色;
四氯化碳,振荡,静置,液体分层,下层呈紫色,上层无色;③将②所得下层溶液全部取出,加入
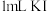 溶液,振荡,静置,下层溶液紫色变浅,上层溶液b呈黄色(颜色比溶液a深)。
溶液,振荡,静置,下层溶液紫色变浅,上层溶液b呈黄色(颜色比溶液a深)。已知:ⅰ.
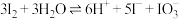 ;
;ⅱ.
 。
。下列说法
A. 是极性溶剂, 是极性溶剂, 是非极性溶剂,非极性的 是非极性溶剂,非极性的 更易溶于 更易溶于 |
| B.②中的下层溶液为碘的四氯化碳溶液 |
C.溶液b中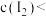 溶液a中 溶液a中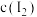 |
D.向①所得浊液中加入 ,使 ,使 增大,反应ⅰ平衡逆向移动,析出 增大,反应ⅰ平衡逆向移动,析出 |
您最近一年使用:0次
2023-01-06更新
|
756次组卷
|
4卷引用:北京市东城区2022-2023学年高三上学期1月期末统一检测化学试卷
名校
解题方法
7 . 下列说法正确的是
| A.工业合成氨时,原料气必须净化处理是为了防止产品NH3中混有太多杂质 |
| B.对于某一可逆反应来说,反应速率加快,反应限度不一定增大 |
| C.凡是放热反应一定能自发进行,凡是熵增加的反应也一定能自发进行 |
| D.化学平衡正向移动,正反应速率一定增大 |
您最近一年使用:0次
2022-01-01更新
|
701次组卷
|
4卷引用:黑龙江省齐齐哈尔市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
8 . 下列有关实验现象的解释或所得结论正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某补血口服液中滴加几滴酸性 溶液 溶液 | 酸性 溶液紫色褪去 溶液紫色褪去 | 该补血口服液中一定含有 |
| B | 用蒸馏水溶解 固体,并继续加水稀释 固体,并继续加水稀释 | 溶液由绿色逐渐变为蓝色 | 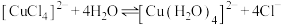 正向移动 正向移动 |
| C | 将25℃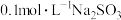 溶液加热到40℃,用传感器监测溶液pH变化 溶液加热到40℃,用传感器监测溶液pH变化 | 溶液的pH逐渐减小 | 温度升高, 水解平衡正向移动 水解平衡正向移动 |
| D | 将铜与浓硫酸反应产生的气体通入 溶液中 溶液中 | 产生白色沉淀 | 该气体中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-01更新
|
1273次组卷
|
8卷引用:高中化学-高二上-12
名校
9 . 工业合成氨是人类科学技术的一项重大突破。其合成原理为: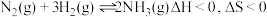 。
。
(1)下列关于工业合成氨的说法正确的是_______。
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______。
(3)某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如图:
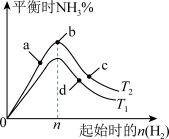
①图像中 和
和 的关系是:
的关系是:
_______  (填“>,<或=”)。
(填“>,<或=”)。
②a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是:
的转化率最高的是:_______ 。
③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是_______ 。
(4)恒温下,向一个4L的恒容密闭容器中充入 和
和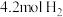 ,反应过程中对
,反应过程中对 的浓度进行检测
的浓度进行检测
①20min后,反应达平衡,氨气的浓度为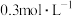 ,用
,用 表示的平均反应速率为
表示的平均反应速率为_______ 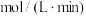 。且此时,混合气体的总压强为p,则该反应的化学平衡常数
。且此时,混合气体的总压强为p,则该反应的化学平衡常数
_______ [对于气相反应,用某组分B的平衡压强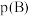 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作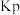 ,如
,如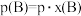 ,p为平衡总压强,
,p为平衡总压强,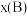 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。
②若维持容器体积不变,温度不变,向原平衡体系中再加入 和
和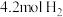 ,再次达平衡后,氨气的浓度
,再次达平衡后,氨气的浓度_______  (填“大于”或“小于”或“等于”)。
(填“大于”或“小于”或“等于”)。
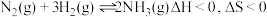 。
。(1)下列关于工业合成氨的说法正确的是_______。
A.因为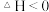 ,所以该反应一定能自发进行 ,所以该反应一定能自发进行 |
B.因为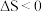 ,所以该反应一定不能自发进行 ,所以该反应一定不能自发进行 |
| C.在高温下进行是为了提高反应物的转化率 |
| D.该反应在低温下能自发进行 |
A.容器内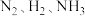 的浓度之比为1∶3∶2 的浓度之比为1∶3∶2 |
B. 百分含量保持不变 百分含量保持不变 |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |

①图像中
 和
和 的关系是:
的关系是:
 (填“>,<或=”)。
(填“>,<或=”)。②a、b、c、d四点所处的平衡状态中,反应物
 的转化率最高的是:
的转化率最高的是:③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是
(4)恒温下,向一个4L的恒容密闭容器中充入
 和
和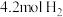 ,反应过程中对
,反应过程中对 的浓度进行检测
的浓度进行检测①20min后,反应达平衡,氨气的浓度为
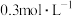 ,用
,用 表示的平均反应速率为
表示的平均反应速率为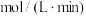 。且此时,混合气体的总压强为p,则该反应的化学平衡常数
。且此时,混合气体的总压强为p,则该反应的化学平衡常数
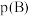 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作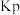 ,如
,如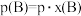 ,p为平衡总压强,
,p为平衡总压强,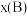 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。②若维持容器体积不变,温度不变,向原平衡体系中再加入
 和
和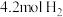 ,再次达平衡后,氨气的浓度
,再次达平衡后,氨气的浓度 (填“大于”或“小于”或“等于”)。
(填“大于”或“小于”或“等于”)。
您最近一年使用:0次
2022-12-07更新
|
704次组卷
|
3卷引用:辽宁省沈阳市第十中学2022-2023学年高二上学期期末综合测评化学试题
名校
解题方法
10 . 在催化剂作用下,向刚性容器中按物质的量比1︰1充入甲醇和异丁烯(用R表示),分别在T1和T2两个温度下发生反应生成有机物W:CH3OH(g)+R(g)⇌W(g) ΔH。异丁烯的转化率随时间的变化关系如图所示。下列说法正确的是
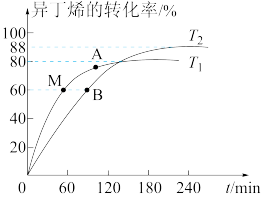

| A.T1>T2,ΔH>0 |
| B.vM正=vB正>vA逆 |
| C.维持T2不变,再向容器中充入1 mol W,新平衡时W的百分含量减小 |
D.T1时,容器内起始总压为p0 kPa,则用分压表示的该反应的平衡常数Kp= kPa-1 kPa-1 |
您最近一年使用:0次
2021-03-07更新
|
1355次组卷
|
8卷引用:重庆市第一中学校2020-2021学年高二下学期期末考试化学试题
重庆市第一中学校2020-2021学年高二下学期期末考试化学试题重庆市强基联合体2021届高三下学期质量检测化学试题山东省济南市平阴县第一中学2021届高三下学期3月月考化学试题河南省鹤壁市高中2020-2021学年高二下学期第三次段考化学试题(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)安徽省马鞍山市第二中学2021-2022学年高二上学期期中考试化学试题(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)



