名校
解题方法
1 . 氯化亚铜为白色难溶于水,不溶于乙醇的固体。可用作催化剂、脱色剂,实验室制备它的流程之一如下: 的装置如图所示:
的装置如图所示:
(1)B中试剂是________ (填名称),装置A中发生反应的物质不可能是下列中的___________ (填标号)。
A. 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO
(2)适合点燃C处酒精灯的标志是______________ ,进入C处反应装置中的气体中含有少量HCl,实验中没有除去HCl的原因是________________________ 。
(3)试剂a可以是NaOH,也可以是_________ (填一种),写出NaOH与尾气主要反应的化学方程式____________________ 。
(4)“还原”过程中浓盐酸的作用是_____________ 。向 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是____________________ 。
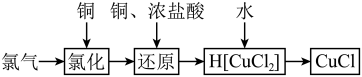
 的装置如图所示:
的装置如图所示: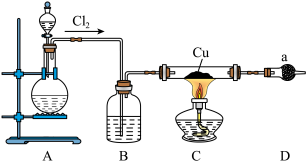
(1)B中试剂是
A.
 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO(2)适合点燃C处酒精灯的标志是
(3)试剂a可以是NaOH,也可以是
(4)“还原”过程中浓盐酸的作用是
 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
您最近一年使用:0次
名校
2 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①Co(OH)2为浅青色沉淀
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是___________ ,c=___________ 。___________ 。
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:___________ ;反应的离子方程式为:___________ 。
| 实验序号 | 操作 | 现象 | |
| 实验i:[Cu(NH3)4]2+的配制 | 实验i-a | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的6mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合CuSO4溶液和NH3·H2O溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
| 实验ii:[Co(NH3)6]2+的配制 | 实验ii-a | 在试管内混合CoCl2溶液和过量6mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合CoCl2溶液和过量14mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 | |
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是
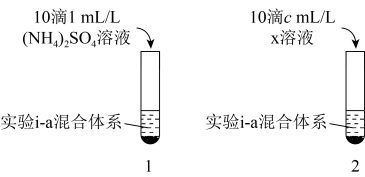
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:
您最近一年使用:0次
3 . 研究 的综合利用具有重要的意义。
的综合利用具有重要的意义。
Ⅰ. 催化重整制氢气
催化重整制氢气
一种 与
与 催化重整制取
催化重整制取 的过程如图1所示。在反应管中加入
的过程如图1所示。在反应管中加入 和催化剂,先通入
和催化剂,先通入 ,待步骤Ⅰ完成后,再将
,待步骤Ⅰ完成后,再将 以一定流速通入,并控制温度为
以一定流速通入,并控制温度为 ,进行步骤Ⅱ。
,进行步骤Ⅱ。___________ 。
(2)步骤Ⅱ中还存在少量副反应: ,测得出口处
,测得出口处 和
和 的流量随时间变化如图2所示。
的流量随时间变化如图2所示。 时出口处气体流量
时出口处气体流量 略高于
略高于 的原因是
的原因是___________ 。
②反应进行 后,反应管中仍残留较多
后,反应管中仍残留较多 ,但
,但 流量迅速降低,
流量迅速降低, 流量升高,可能的原因是
流量升高,可能的原因是___________ 。
Ⅱ. 用于烟气脱硝
用于烟气脱硝
(3) 烟气脱硝相关反应如下:
烟气脱硝相关反应如下:
反应Ⅰ

反应Ⅱ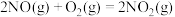

反应Ⅲ
①反应Ⅲ的
___________  。
。
②反应Ⅰ和反应II的平衡常数分别为 、
、 ,则相同温度下反应Ⅲ的
,则相同温度下反应Ⅲ的
___________ (用 、
、 表示)。
表示)。
(4)模拟烟气脱硝:一定条件下,将 、
、 和
和 按
按 匀速通过催化脱硝反应器,测得
匀速通过催化脱硝反应器,测得 去除率和
去除率和 转化率随反应温度的变化如图3所示。
转化率随反应温度的变化如图3所示。 时,
时, 的去除率随温度升高而升高,可能原因是
的去除率随温度升高而升高,可能原因是___________ 。
②当温度高于 时,
时, 的去除率随温度升高而降低,可能原因是
的去除率随温度升高而降低,可能原因是___________ 。
 的综合利用具有重要的意义。
的综合利用具有重要的意义。Ⅰ.
 催化重整制氢气
催化重整制氢气一种
 与
与 催化重整制取
催化重整制取 的过程如图1所示。在反应管中加入
的过程如图1所示。在反应管中加入 和催化剂,先通入
和催化剂,先通入 ,待步骤Ⅰ完成后,再将
,待步骤Ⅰ完成后,再将 以一定流速通入,并控制温度为
以一定流速通入,并控制温度为 ,进行步骤Ⅱ。
,进行步骤Ⅱ。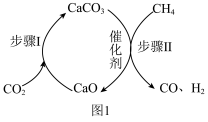
(2)步骤Ⅱ中还存在少量副反应:
 ,测得出口处
,测得出口处 和
和 的流量随时间变化如图2所示。
的流量随时间变化如图2所示。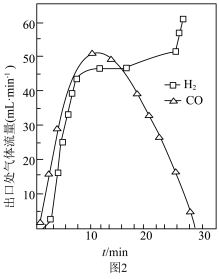
 时出口处气体流量
时出口处气体流量 略高于
略高于 的原因是
的原因是②反应进行
 后,反应管中仍残留较多
后,反应管中仍残留较多 ,但
,但 流量迅速降低,
流量迅速降低, 流量升高,可能的原因是
流量升高,可能的原因是Ⅱ.
 用于烟气脱硝
用于烟气脱硝(3)
 烟气脱硝相关反应如下:
烟气脱硝相关反应如下:反应Ⅰ


反应Ⅱ
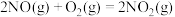

反应Ⅲ

①反应Ⅲ的

 。
。②反应Ⅰ和反应II的平衡常数分别为
 、
、 ,则相同温度下反应Ⅲ的
,则相同温度下反应Ⅲ的
 、
、 表示)。
表示)。(4)模拟烟气脱硝:一定条件下,将
 、
、 和
和 按
按 匀速通过催化脱硝反应器,测得
匀速通过催化脱硝反应器,测得 去除率和
去除率和 转化率随反应温度的变化如图3所示。
转化率随反应温度的变化如图3所示。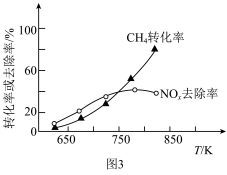
 时,
时, 的去除率随温度升高而升高,可能原因是
的去除率随温度升高而升高,可能原因是②当温度高于
 时,
时, 的去除率随温度升高而降低,可能原因是
的去除率随温度升高而降低,可能原因是
您最近一年使用:0次
名校
4 . CO2的资源化利用具有重要的意义。合成尿素[CO(NH2)2]是利用CO2的途径之一。尿素合成主要通过下列反应实现:
2NH3(g)+CO2(g)=NH2COONH4(s) △H1=-272kJ/mol
NH2COONH4(s)=CO(NH2)2(l)+H2O(g) △H2=+138kJ/mol
(1)二氧化碳和氨气合成尿素和水蒸气的热化学方程式为_______ ;该反应自发进行的条件是_______ (填“低温”、“高温”或“任意条件“”)。
(2)MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂,可由MgCl2与沉淀剂(尿素、氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成的是Mg5(CO3)4(OH)2沉淀,与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是_______ 。
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。_______ 。
②控制电压为0.8V,电解时转移电子的物质的量为_______ mol。
CH4与CO2重整主要发生下列反应:
反应1:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
反应2:H2(g)+CO2(g) H2O(g)+CO(g) △H=+41kJ/mol
H2O(g)+CO(g) △H=+41kJ/mol
恒温,将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2。
(4)下列说法正确的是_______。
(5)CH4和CO2的平衡转化率随温度变化关系如图3所示。_______ (写出计算式即可)。
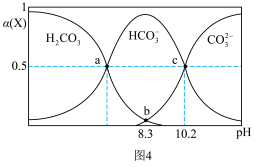
(6)室温下,H2CO3溶液中各含碳微粒的物质的量分数与pH的关系如图4所示。则H2CO3的Ka1=_______ 。
2NH3(g)+CO2(g)=NH2COONH4(s) △H1=-272kJ/mol
NH2COONH4(s)=CO(NH2)2(l)+H2O(g) △H2=+138kJ/mol
(1)二氧化碳和氨气合成尿素和水蒸气的热化学方程式为
(2)MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂,可由MgCl2与沉淀剂(尿素、氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成的是Mg5(CO3)4(OH)2沉淀,与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。
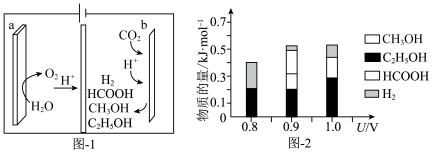
②控制电压为0.8V,电解时转移电子的物质的量为
CH4与CO2重整主要发生下列反应:
反应1:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol反应2:H2(g)+CO2(g)
 H2O(g)+CO(g) △H=+41kJ/mol
H2O(g)+CO(g) △H=+41kJ/mol恒温,将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2。
(4)下列说法正确的是_______。
| A.n(CO)保持不变说明容器已经达到平衡状态 |
| B.容器中气体密度不变能说明反应已经达到平衡状态 |
| C.恒容向容器中充入He,CH4平衡转化率变小 |
| D.如果将容器体积缩小为1L,则反应1的化学反应速率变快,反应2不变 |
(5)CH4和CO2的平衡转化率随温度变化关系如图3所示。

(6)室温下,H2CO3溶液中各含碳微粒的物质的量分数与pH的关系如图4所示。则H2CO3的Ka1=
您最近一年使用:0次
5 . 下列描述对应方程式错误的是
A. 溶液在冷水和热水中颜色不同: 溶液在冷水和热水中颜色不同: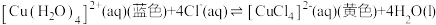  |
B.施加适量石膏降低盐碱地土壤的碱性: |
C.用FeS除去废水中的 : :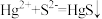 |
D.硅酸钠溶液存放过程中变浑浊: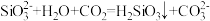 |
您最近一年使用:0次
解题方法
6 . 工业上利用软锰矿(主要成分为 ,含少量
,含少量 、FeO和
、FeO和 等杂质)和含
等杂质)和含 的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为 。
。
②不同金属离子生成氢氧化物沉淀的pH如下表:
③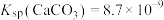 ,
,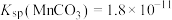 。
。
回答下列问题:
(1)下列说法正确的是________(填序号)。
(2)调节溶液的pH前,加入软锰矿发生“氧化”作用的离子方程式是________ 。
(3)调节pH:加入适量的熟石灰,调节pH=5。充分反应后生成的沉淀有________ 。如果没有前期的“氧化”环节,pH就需要调节到更大的数值,这样会导致________ 。
(4)“沉锰”过程中加入氨水的目的是________ (从化学平衡移动的角度解释)。“沉锰”过程宜在较低温度下进行,可能的原因是________ (写1条即可)。“沉锰”时通过控制合理的pH,就可以控制 的浓度,达到不产生
的浓度,达到不产生 的目的,原因是
的目的,原因是________ 。
 ,含少量
,含少量 、FeO和
、FeO和 等杂质)和含
等杂质)和含 的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。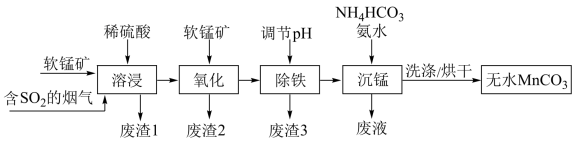
 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为 。
。②不同金属离子生成氢氧化物沉淀的pH如下表:
| 离子 |  |  |  |
| 开始沉淀时pH | 2.7 | 7.5 | 7.8 |
| 完全沉淀时pH | 3.7 | 9.7 | 9.8 |
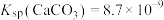 ,
,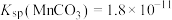 。
。回答下列问题:
(1)下列说法正确的是________(填序号)。
| A.最好使用粉状软锰矿进行“溶浸” | B.废渣1的主要成分和“芯片”相同 |
| C.溶浸时不会发生氧化还原反应 | D.废液经处理可用于灌溉农作物 |
(2)调节溶液的pH前,加入软锰矿发生“氧化”作用的离子方程式是
(3)调节pH:加入适量的熟石灰,调节pH=5。充分反应后生成的沉淀有
(4)“沉锰”过程中加入氨水的目的是
 的浓度,达到不产生
的浓度,达到不产生 的目的,原因是
的目的,原因是
您最近一年使用:0次
7 . 以 溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
资料:i.水溶液中: 呈无色;
呈无色; 呈黄色;
呈黄色; 呈棕色。
呈棕色。
ii. ;CuCl为白色固体,难溶于水。
;CuCl为白色固体,难溶于水。
将等体积的溶液a分别加到等量铜粉中,实验记录如下:
(1)Ⅰ中产生白色沉淀的离子方程式是____________ 。
(2)对于实验Ⅱ的现象进行分析。
①经检验Ⅱ中气体为 。分析气体产生的原因,进行实验:将
。分析气体产生的原因,进行实验:将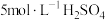 溶液加到铜粉中,溶液慢慢变蓝,未检测到
溶液加到铜粉中,溶液慢慢变蓝,未检测到 。
。
依据电极反应式,分析产生 的原因
的原因____________ 。
②Ⅱ中溶液变为黄色,用离子方程式解释可能原因____________ 。
(3)对比实验Ⅰ、Ⅲ,分析实验Ⅲ中将溶液a加到铜粉中未产生白色沉淀的原因。
①假设1: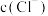 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。
实验验证:取Ⅰ中洗涤后的沉淀,加入饱和NaCl溶液,白色沉淀溶解。结合平衡移动原理解释沉淀溶解的原因____________ 。
②假设2: 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。
实验验证:______ (填操作和现象),证实假设2不合理。
(4)实验Ⅱ、Ⅲ对比,实验Ⅱ中产生气泡,实验Ⅲ中无气泡。分析可能原因______ 。
(5)结合现象和化学反应原理解释选择 与浓盐酸的混合液而不单独选择
与浓盐酸的混合液而不单独选择 溶液或浓盐酸做腐蚀液的原因
溶液或浓盐酸做腐蚀液的原因____________ 。
 溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。资料:i.水溶液中:
 呈无色;
呈无色; 呈黄色;
呈黄色; 呈棕色。
呈棕色。ii.
 ;CuCl为白色固体,难溶于水。
;CuCl为白色固体,难溶于水。将等体积的溶液a分别加到等量铜粉中,实验记录如下:
实验 | 溶液a | 现象 |
Ⅰ |  溶液( 溶液( ) ) | 产生白色沉淀,溶液蓝色变浅,5h时铜粉剩余 |
Ⅱ | 浓盐酸(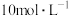 ) ) | 产生无色气泡,溶液无色;继而溶液变为黄色;较长时间后溶液变为棕色,5h时铜粉剩余 |
Ⅲ |  溶液( 溶液( )和浓盐酸( )和浓盐酸(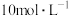 ) ) | 溶液由黄绿色变为棕色,无气泡;随着反应进行,溶液颜色变浅,后接近于无色,5h时铜粉几乎无剩余 |
(1)Ⅰ中产生白色沉淀的离子方程式是
(2)对于实验Ⅱ的现象进行分析。
①经检验Ⅱ中气体为
 。分析气体产生的原因,进行实验:将
。分析气体产生的原因,进行实验:将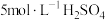 溶液加到铜粉中,溶液慢慢变蓝,未检测到
溶液加到铜粉中,溶液慢慢变蓝,未检测到 。
。依据电极反应式,分析产生
 的原因
的原因②Ⅱ中溶液变为黄色,用离子方程式解释可能原因
(3)对比实验Ⅰ、Ⅲ,分析实验Ⅲ中将溶液a加到铜粉中未产生白色沉淀的原因。
①假设1:
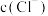 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。实验验证:取Ⅰ中洗涤后的沉淀,加入饱和NaCl溶液,白色沉淀溶解。结合平衡移动原理解释沉淀溶解的原因
②假设2:
 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。实验验证:
(4)实验Ⅱ、Ⅲ对比,实验Ⅱ中产生气泡,实验Ⅲ中无气泡。分析可能原因
(5)结合现象和化学反应原理解释选择
 与浓盐酸的混合液而不单独选择
与浓盐酸的混合液而不单独选择 溶液或浓盐酸做腐蚀液的原因
溶液或浓盐酸做腐蚀液的原因
您最近一年使用:0次
解题方法
8 . 废电池中含磷酸铁锂,提锂后的废渣主要含 、
、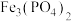 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。 、
、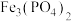 均难溶于水。
均难溶于水。
ii.将 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。
(1)酸浸前,将废渣粉碎的目的是________ 。
(2)从平衡移动的角度解释加入硝酸溶解 的原因:
的原因:________ 。
(3)在酸浸液中加入 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中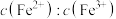 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用:________ 。 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:________ 。
(5)过滤得到电池级 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有________ 。
(6)磷酸铁锂-石墨电池的总反应: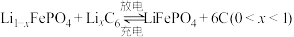 。
。
①高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是________ 。
②放电时负极的电极反应式是________ 。
 、
、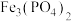 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。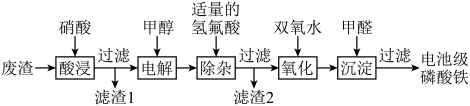
 、
、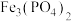 均难溶于水。
均难溶于水。ii.将
 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。(1)酸浸前,将废渣粉碎的目的是
(2)从平衡移动的角度解释加入硝酸溶解
 的原因:
的原因:(3)在酸浸液中加入
 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中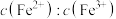 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用: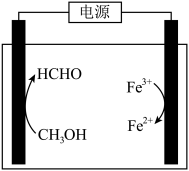
 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:(5)过滤得到电池级
 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有(6)磷酸铁锂-石墨电池的总反应:
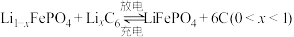 。
。①高温条件下,
 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是②放电时负极的电极反应式是
您最近一年使用:0次
解题方法
9 . 某实验小组从某废旧锂离子电池正极活性材料(主要成分可表示为 ,还含有少量
,还含有少量 、
、 的化合物)中分别回收处理金属元素,工艺流程如下图所示:
的化合物)中分别回收处理金属元素,工艺流程如下图所示: 、
、 、
、 、
、 ;
;
②有关金属离子沉淀完全的 见下表:
见下表:
(1)丁二酮肟分子中 杂化的碳原子个数为
杂化的碳原子个数为______ ,二丁二酮肟镍中存在的化学键有______ (填序号)。
A. 链 B.氢键 C.金属键 D.配位键
链 B.氢键 C.金属键 D.配位键
(2)“氧化”过程的操作为控制体系的 在
在 ,加入
,加入 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式______ 。
(3)P507萃取剂(用HA表示)萃取 的原理可表示为
的原理可表示为 的浸出与水相
的浸出与水相 的关系如图所示。分析
的关系如图所示。分析 较小时萃取率偏低的原因为
较小时萃取率偏低的原因为______ 。 和
和 在空气氛围中焙烧可得到
在空气氛围中焙烧可得到 ,该反应化学方程式为
,该反应化学方程式为______ 。
(5)将草酸钴晶体 置于空气中加热,受热过程中固体残留率(
置于空气中加热,受热过程中固体残留率( )变化如下图所示,则C点固体物质的化学式为
)变化如下图所示,则C点固体物质的化学式为______ 。 的一种晶胞如图所示(仅标出
的一种晶胞如图所示(仅标出 与
与 未标出)、该晶胞中占有O的个数为
未标出)、该晶胞中占有O的个数为______ 。
 ,还含有少量
,还含有少量 、
、 的化合物)中分别回收处理金属元素,工艺流程如下图所示:
的化合物)中分别回收处理金属元素,工艺流程如下图所示: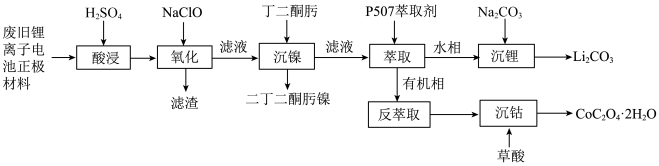
 、
、 、
、 、
、 ;
;②有关金属离子沉淀完全的
 见下表:
见下表:离子 |
|
|
|
|
| 9.3 | 3.2 | 9.0 | 8.9 |
③沉镍反应为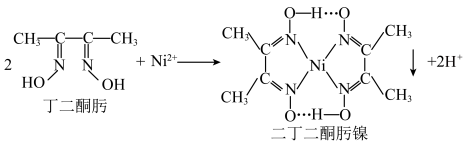
(1)丁二酮肟分子中
 杂化的碳原子个数为
杂化的碳原子个数为A.
 链 B.氢键 C.金属键 D.配位键
链 B.氢键 C.金属键 D.配位键(2)“氧化”过程的操作为控制体系的
 在
在 ,加入
,加入 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式(3)P507萃取剂(用HA表示)萃取
 的原理可表示为
的原理可表示为 的浸出与水相
的浸出与水相 的关系如图所示。分析
的关系如图所示。分析 较小时萃取率偏低的原因为
较小时萃取率偏低的原因为
 和
和 在空气氛围中焙烧可得到
在空气氛围中焙烧可得到 ,该反应化学方程式为
,该反应化学方程式为(5)将草酸钴晶体
 置于空气中加热,受热过程中固体残留率(
置于空气中加热,受热过程中固体残留率( )变化如下图所示,则C点固体物质的化学式为
)变化如下图所示,则C点固体物质的化学式为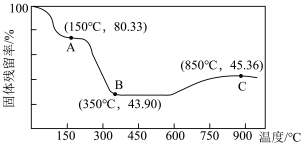
 的一种晶胞如图所示(仅标出
的一种晶胞如图所示(仅标出 与
与 未标出)、该晶胞中占有O的个数为
未标出)、该晶胞中占有O的个数为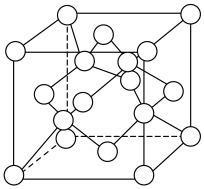
您最近一年使用:0次
10 . 我国提出“CO2排放力争于2023年前达到峰值,努力争取2060年前实现碳中和”。研发CO2的利用技术,降低空气中CO2的含量是实现该目标的重要途径。
(1)下面是用H2捕捉CO2时发生的两个反应:
I.CO2(g)+4H2(g) CH4(g)+2H2O(g) ∆H1
CH4(g)+2H2O(g) ∆H1
II.CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
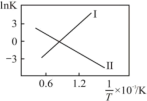
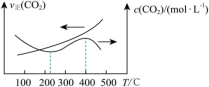
①反应I、II的lnK随1/T的变化如图所示,则ΔH2___________ 0(填“>”“<”或“=”)0;有利于反应I自发进行的温度是___________ (填“高温”或“低温”)。___________ ,而速率仍然增大的可能原因是___________ ___________ ,反应II的平衡常数Kp为___________ (保留两位有效数字)。[已知:CH4的选择性=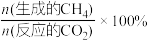 ]
]
(2)利用化学链将高炉废气中的CO2转化为CO的示意图如下。___________ ,该化学链的总反应是___________ 。
(1)下面是用H2捕捉CO2时发生的两个反应:
I.CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ∆H1
CH4(g)+2H2O(g) ∆H1II.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2①反应I、II的lnK随1/T的变化如图所示,则ΔH2
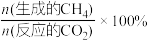 ]
](2)利用化学链将高炉废气中的CO2转化为CO的示意图如下。

您最近一年使用:0次



