名校
1 . I.由γ羟基丁酸(HOCH2CH2CH2COOH )生成γ丁内酯的反应如下: HOCH2CH2CH2COOH
 +H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为0.180 mol/L,测得γ丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
+H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为0.180 mol/L,测得γ丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
(1)该反应在50~80 min内的平均反应速率为_______ mol/(L·min)。
(2)120 min时γ羟基丁酸的转化率为_______ 。
II.某学习小组欲探究外界条件对化学反应速率的影响,设计实验如下表所示:
(3)实验I、II探究的是:其它条件相同时,Na2S2O3溶液的浓度对反应速率的影响,若实验III、IV也想达到与实验I、II相同的探究目的,则X=_______ 。
(4)探究温度对反应速率的影响的实验组是_______ 。实验根据溶液出现淡黄色浑浊所需时间,可判断反应的快慢。该探究实验中发生反应的离子方程式为_____ 。

 +H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为0.180 mol/L,测得γ丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
+H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为0.180 mol/L,测得γ丁内酯的浓度随时间变化的数据如表所示。回答下列问题:| t/min | 21 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| c/(mol·L-1) | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(2)120 min时γ羟基丁酸的转化率为
II.某学习小组欲探究外界条件对化学反应速率的影响,设计实验如下表所示:
| 实验序号 | 温度 | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| I | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| II | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| III | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| IV | 35 | 5 | 0.2 | X | 0.2 | Y |
(4)探究温度对反应速率的影响的实验组是
您最近一年使用:0次
名校
2 . 已知反应A(g) +2B(g) 3C(g),ΔH<0,向一恒温恒容的密闭容器中充入1molA(g)和 3molB(g)发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
3C(g),ΔH<0,向一恒温恒容的密闭容器中充入1molA(g)和 3molB(g)发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是

 3C(g),ΔH<0,向一恒温恒容的密闭容器中充入1molA(g)和 3molB(g)发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
3C(g),ΔH<0,向一恒温恒容的密闭容器中充入1molA(g)和 3molB(g)发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
| A.若容器内压强不变,表明反应达到平衡 |
| B.t2时改变的条件:向容器中加入B |
| C.平衡常数K:K(Ⅱ) <K(Ⅰ) |
| D.平衡时A的体积分数φ(Ⅱ)>φ(Ⅰ) |
您最近一年使用:0次
2022-10-08更新
|
540次组卷
|
5卷引用:福建省连城县第一中学2022-2023学年高二上学期第一次月考化学试题
名校
3 . 某温度下,在恒容密闭容器中加入一定量X,发生反应2X(s) Y(s)+ Z(g) ΔH;一段时间后达到平衡。下列说法不正确的是
Y(s)+ Z(g) ΔH;一段时间后达到平衡。下列说法不正确的是
 Y(s)+ Z(g) ΔH;一段时间后达到平衡。下列说法不正确的是
Y(s)+ Z(g) ΔH;一段时间后达到平衡。下列说法不正确的是| A.升高温度,若c(Z)增大,则ΔH>0 |
| B.平衡后加入一定量Z,达新平衡后m(Y)减小 |
| C.加入等物质的量的X和Z,平衡不移动 |
| D.加入一定量氩气(Ar),平衡不移动 |
您最近一年使用:0次
名校
4 . 甲醇是重要的化工原料,发展前景广阔。研究表明, 加氢可以合成甲醇,反应如下:
加氢可以合成甲醇,反应如下: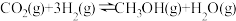
(1)反应的平衡常数表达式为K=___________ 。
(2)有利于提高平衡时 转化率的措施有
转化率的措施有___________ (填字母)。
a.使用催化剂
b.加压
c.增大 和H2的初始投料比
和H2的初始投料比
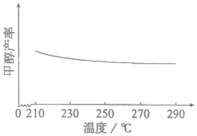
(3)研究温度对甲醇产率的影响时发现,在210~290℃,保持原料气中 和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
___________ 0(填“>”“=”或“<”),依据是___________ 。
 加氢可以合成甲醇,反应如下:
加氢可以合成甲醇,反应如下: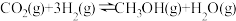
(1)反应的平衡常数表达式为K=
(2)有利于提高平衡时
 转化率的措施有
转化率的措施有a.使用催化剂
b.加压
c.增大
 和H2的初始投料比
和H2的初始投料比(3)研究温度对甲醇产率的影响时发现,在210~290℃,保持原料气中
 和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的

您最近一年使用:0次
2021-12-02更新
|
798次组卷
|
4卷引用:福建省上杭县才溪中学2022-2023学年高二上学期10月月考化学试题
名校
5 . 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积缩小到原来的一半,再达到平衡时,测得A的浓度增大为0.8mol/L。下列有关判断正确的是
| A.x+y>z | B.C的体积分数下降 |
| C.B的转化率减小 | D.平衡常数增大 |
您最近一年使用:0次
名校
6 . 下列装置及设计不能达到实验目的的是
| 选项 | A | B | C | D |
| 装置 | 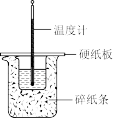 | 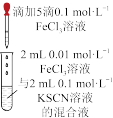 | 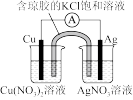 |  |
| 目的 | 测定中和热 | 验证增大反应物浓度对平衡的影响 | 组装铜银原电池 | 验证温度对平衡移动的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-10-07更新
|
180次组卷
|
2卷引用:福建省武平县第一中学2021-2022学年高二上学期第一次月考化学试题
名校
7 . 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
下列说法正确的是
 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
| 平衡v正(SO2)/mol/(L·s) | v1 | v2 | v3 |
| 平衡c(SO3)mol/L | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率/α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
| A.v1<v2,c2<2c1 | B.K1>K3,p2>2p3 |
| C.v1>v3,α1(SO2)>α3(SO2) | D.c2>2c3,α2(SO3)+α3(SO2)<1 |
您最近一年使用:0次
2021-08-14更新
|
1550次组卷
|
25卷引用:福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题
福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题(已下线)【浙江新东方】高中化学20210304-010广西浦北中学2021-2022学年高二上学期第一次月考化学试题吉林省长春市第二中学2021-2022学年高二上学期第一次月考化学试题江西省吉安一中2021-2022学年高二上学期第一次段考化学试题江西省宜春市八校2022-2023学年高二上学期12月联考化学试题河北省部分学校2023-2024学年高二上学期10月联考化学试题安徽省当涂第一中学2023-2024学年高二上学期10月月考化学试题天津市静海区第一中学2020届高三下学期第六周周末训练化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡 高考帮人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关浙江省诸暨市2019-2020学年高二上学期期末考试化学试题宁夏银川一中2020-2021学年高二上学期期末考试化学试题浙江省宁波市九校2020-2021学年高二上学期期末联考化学试题(已下线)【绍兴新东方】绍兴高中化学00008(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)四川省蓬安中学校2019-2020学年高二上学期开学考试化学试题(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)2.3.3 温度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)2.3.2 压强变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)江西省九江市第一中学2021-2022学年高二上学期期中考试化学试题
名校
8 . 已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl-⇌[CoCl4]2-+6H2OΔH,用该溶液做实验,溶液的颜色变化如图:

以下结论和解释错误的是

以下结论和解释错误的是
| A.由实验①可推知ΔH>0 |
| B.等物质的量的[Co(H2O)6]2+和[CoCl4]2-中σ键数之比为9∶2 |
| C.实验②是由于c(H2O)增大,导致平衡逆向移动 |
| D.由实验③可知配离子的稳定性:[ZnCl4]2->[CoCl4]2- |
您最近一年使用:0次
2021-04-07更新
|
172次组卷
|
5卷引用:福建省龙岩第一中学2021-2022学年高二(实验班)下学期第一次月考化学试题
名校
9 . 钴钼系催化剂主要用于石油炼制等工艺,从废钴钼催化剂(主要含有MoS2、CoS和Al2O3)中回收钴和钼的工艺流程如图:

已知:浸取液中的金属离子主要为MoO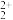 、Co2+、Al3+。
、Co2+、Al3+。
(1)钼酸铵[(NH4)2MoO4]中Mo的化合价为________ ,MoS2在空气中高温焙烧产生两种氧化物:SO2和____________ (填化学式)。
(2)为了加快酸浸速率,可采取的措施为_______________________ (任写一条)。
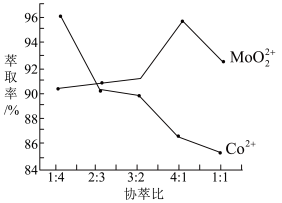
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取MoO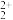 和Co2+,萃取情况如图所示,当协萃比
和Co2+,萃取情况如图所示,当协萃比
_________________ ,更有利于MoO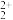 的萃取。
的萃取。
(4)操作Ⅰ的名称为_______________________ 。
(5)向有机相1中滴加氨水,发生反应的离子方程式为_____________________________ 。
(6)Co2+萃取的反应原理为Co2+ +2HR CoR2 +2H+,向有机相2中加入H2SO4能进行反萃取的原因是
CoR2 +2H+,向有机相2中加入H2SO4能进行反萃取的原因是_______________________ (结合平衡移动原理解释)。
(7)Co3O4可用作电极,若选用KOH电解质溶液,通电时可转化为CoOOH,其电极反应式为___________________________ 。

已知:浸取液中的金属离子主要为MoO
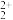 、Co2+、Al3+。
、Co2+、Al3+。(1)钼酸铵[(NH4)2MoO4]中Mo的化合价为
(2)为了加快酸浸速率,可采取的措施为
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取MoO
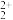 和Co2+,萃取情况如图所示,当协萃比
和Co2+,萃取情况如图所示,当协萃比
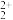 的萃取。
的萃取。
(4)操作Ⅰ的名称为
(5)向有机相1中滴加氨水,发生反应的离子方程式为
(6)Co2+萃取的反应原理为Co2+ +2HR
 CoR2 +2H+,向有机相2中加入H2SO4能进行反萃取的原因是
CoR2 +2H+,向有机相2中加入H2SO4能进行反萃取的原因是(7)Co3O4可用作电极,若选用KOH电解质溶液,通电时可转化为CoOOH,其电极反应式为
您最近一年使用:0次
名校
10 . 下列叙述及解释正确的是( )
A.2NO2(g)(红棕色) N2O4(g)(无色)ΔH<0,平衡后,对平衡体系缩小容积、增大压强,平衡向正反应方向移动,体系颜色变浅 N2O4(g)(无色)ΔH<0,平衡后,对平衡体系缩小容积、增大压强,平衡向正反应方向移动,体系颜色变浅 |
B.对于2C(s)+O2(g) 2CO(g),在平衡后,加入碳,平衡向正反应方向移动 2CO(g),在平衡后,加入碳,平衡向正反应方向移动 |
C.对于N2+3H2 2NH3,平衡后,压强不变,充入氦气,平衡向逆方向移动 2NH3,平衡后,压强不变,充入氦气,平衡向逆方向移动 |
D.FeCl3+3KSCN Fe(SCN)3+3KCl,平衡后,加少量KCl,平衡逆移,体系颜色变浅 Fe(SCN)3+3KCl,平衡后,加少量KCl,平衡逆移,体系颜色变浅 |
您最近一年使用:0次
2020-09-16更新
|
102次组卷
|
3卷引用:福建省武平县第一中学2021-2022学年高二上学期第一次月考化学试题



