名校
1 . 过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq) CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
(1)利用上述反应制备760g CHCOH,放出的热量为_______ kJ。
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
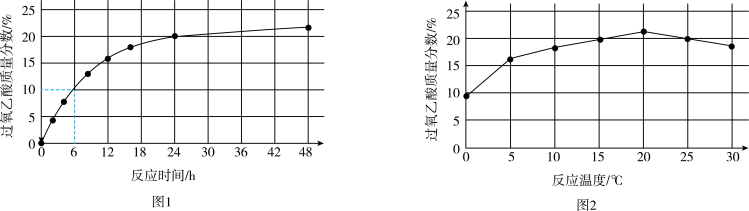 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=_____ g/h。(用含m的代数式表示)
②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是_______ (写出2条)。
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
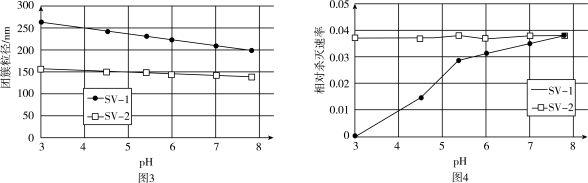
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是___________ 。
 CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol(1)利用上述反应制备760g CHCOH,放出的热量为
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。

依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
您最近一年使用:0次
2 . 在一定条件下,可逆反应A+B mC变化如下图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况,问:
mC变化如下图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况,问:
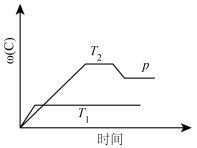
(1)温度T1_____ T2(填“大于”“等于”或“小于”),正反应是_____ (填“吸热”或“放热”)反应。
(2)如果A、B、C均为气体,则m_____ 2(填“大于”“等于”或“小于”)。
(3)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强_____ ,平衡_____ 移动。
(4)当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡_____ 移动。
 mC变化如下图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况,问:
mC变化如下图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后增大容器内压强的变化情况,问:
(1)温度T1
(2)如果A、B、C均为气体,则m
(3)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强
(4)当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡
您最近一年使用:0次
名校
3 . 现有反应mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则
(1)m+n_______ (填“>”“<”或“=”)p。
(2)减压时,A的质量分数_______ (填“增大”“减小”或“不变”,下同)。
(3)若加入B(体积不变),则B的转化率_______ 。
(4)若升高温度,则平衡时,B、C的浓度之比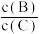 将
将_______ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量_______ 。
(6)若反应体系平衡后,再加入C(体积不变),则B的体积分数_______ ,而维持容器内气体的压强不变,充入氖气时,混合物的颜色_______ (填“变浅”“变深”或“不变”)。
(1)m+n
(2)减压时,A的质量分数
(3)若加入B(体积不变),则B的转化率
(4)若升高温度,则平衡时,B、C的浓度之比
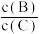 将
将(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若反应体系平衡后,再加入C(体积不变),则B的体积分数
您最近一年使用:0次
名校
4 . 已知
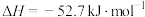 ,常温下N2O4为无色气体。
,常温下N2O4为无色气体。
(1)某课外活动小组为了探究压强对化学平衡的影响,设计了相关实验,请根据所学知识预测实验结果:在容积为30cm3针筒中抽入10cm3的NO2气体,将针筒前端封闭,静置一段时间至气体颜色不变。将针筒活塞拉至20cm3处,此时气体的颜色___________ (填“变深”、“变浅”或“不变”),一段时间后气体颜色___________ (填“变深”、“变浅”或“不变”),但仍比拉动活塞之前针筒内气体的颜色___________ (填“深”或“浅”)。在此过程中,该反应的化学平衡常数___________ (填“增大”、“减小”或“不变”),混合气体中NO2的百分含量___________ (填“增大”、“减小”或“不变”)。
(2)利用现代手持技术传感器可以探究压强对该平衡的影响。
在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①有关该过程说法正确的是___________ 。
a.E、H两点对应的NO2的体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
②反应至B点时NO2的转化率为___________ 。
③图像中C、E两点气体平均摩尔质量较大的点为___________ (填代号)。
(3)某温度下,在体积恒为1 L的密闭容器内,起始时只加入1 mol NO2,达到平衡时其转化率为75%,则该温度下反应 的平衡常数
的平衡常数
___________ L⋅mol-1。

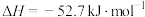 ,常温下N2O4为无色气体。
,常温下N2O4为无色气体。(1)某课外活动小组为了探究压强对化学平衡的影响,设计了相关实验,请根据所学知识预测实验结果:在容积为30cm3针筒中抽入10cm3的NO2气体,将针筒前端封闭,静置一段时间至气体颜色不变。将针筒活塞拉至20cm3处,此时气体的颜色
(2)利用现代手持技术传感器可以探究压强对该平衡的影响。
在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①有关该过程说法正确的是
a.E、H两点对应的NO2的体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
②反应至B点时NO2的转化率为
③图像中C、E两点气体平均摩尔质量较大的点为
(3)某温度下,在体积恒为1 L的密闭容器内,起始时只加入1 mol NO2,达到平衡时其转化率为75%,则该温度下反应
 的平衡常数
的平衡常数
您最近一年使用:0次
5 . 在一个2L的恒容密闭容器中,加入3molA和1molB发生如下反应:3A(g)+B(g) 2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应是___ 反应(填“吸热”或“放热”),D的状态是__ (填“气态”或“非气态”)。
(2)达到平衡时,A的转化率为___ ,此温度下的平衡常数K=__ (保留两位小数)。
(3)若加入适量B,则A的转化率将__ (填“增大”“减小”或“不变”,下同),化学平衡常数将__ 。
 2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应是
(2)达到平衡时,A的转化率为
(3)若加入适量B,则A的转化率将
您最近一年使用:0次
解题方法
6 . 在密闭容器中进行如下反应: ,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。
,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。
(1)增加C的含量,平衡____________ ,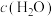
___________ .
(2)保持反应容器体积和温度不变,通入 ,平衡
,平衡____________ ,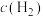
____________ .
(3)在一定温度下,缩小反应容器体积,平衡向____________ 方向移动,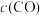
___________ , 的转化率
的转化率
______________ 。
(4)保持反应容器体积不变,升高温度,平衡向_________ 方向移动,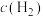
___________ .
(5)保持反应容器体积和温度不变,再通入 ,平衡向
,平衡向__________ 方向移动, 的转化率
的转化率
_________ ,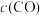
___________ 。
 ,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。
,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。(1)增加C的含量,平衡
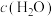
(2)保持反应容器体积和温度不变,通入
 ,平衡
,平衡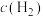
(3)在一定温度下,缩小反应容器体积,平衡向
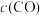
 的转化率
的转化率
(4)保持反应容器体积不变,升高温度,平衡向
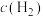
(5)保持反应容器体积和温度不变,再通入
 ,平衡向
,平衡向 的转化率
的转化率
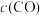
您最近一年使用:0次
解题方法
7 . 研究CO和 的应用对构建生态文明型社会具有重要意义。
的应用对构建生态文明型社会具有重要意义。
(1)用CO和 为原料可制取甲醇:
为原料可制取甲醇:
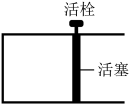
 。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和
。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和 。
。
①能够说明反应已经处于平衡状态的是:_________ 。
A.容器内CO的物质的量浓度不变
B.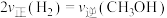
C.容器内气体压强不变
D.混合气体的密度不变
E.容器内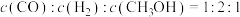
②若其他条件均保持不变,起始时拔去活栓,让活塞自由移动,则平衡时 的体积百分含量将
的体积百分含量将_________ (填“增大”、“减少”或“不变”)
(2)二氧化碳是潜在的碳资源,可以与 合成二甲醚(化学式为
合成二甲醚(化学式为 ),也可以与
),也可以与 直接转化为乙酸。
直接转化为乙酸。
①一种“二甲醚燃料电池”的结构如图所示,以熔融的碳酸钾为电解质,总反应为: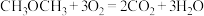 。该电池工作时,负极的电极反应为
。该电池工作时,负极的电极反应为_________ 。

②以二氧化钛表面覆盖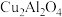 为催化剂,可以将
为催化剂,可以将 和
和 直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:_________ 。

 的应用对构建生态文明型社会具有重要意义。
的应用对构建生态文明型社会具有重要意义。(1)用CO和
 为原料可制取甲醇:
为原料可制取甲醇:
 。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和
。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和 。
。
①能够说明反应已经处于平衡状态的是:
A.容器内CO的物质的量浓度不变
B.
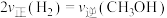
C.容器内气体压强不变
D.混合气体的密度不变
E.容器内
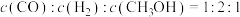
②若其他条件均保持不变,起始时拔去活栓,让活塞自由移动,则平衡时
 的体积百分含量将
的体积百分含量将(2)二氧化碳是潜在的碳资源,可以与
 合成二甲醚(化学式为
合成二甲醚(化学式为 ),也可以与
),也可以与 直接转化为乙酸。
直接转化为乙酸。①一种“二甲醚燃料电池”的结构如图所示,以熔融的碳酸钾为电解质,总反应为:
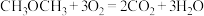 。该电池工作时,负极的电极反应为
。该电池工作时,负极的电极反应为
②以二氧化钛表面覆盖
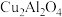 为催化剂,可以将
为催化剂,可以将 和
和 直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
您最近一年使用:0次
解题方法
8 . 大气、水体常见污染元素主要有氮、硫。含氮废气、废液处理是化学学科重要研究课题。
(1)在含 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是___ 。
(2)用NaClO可以将氨氮(NH3、NH )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式___ 。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。
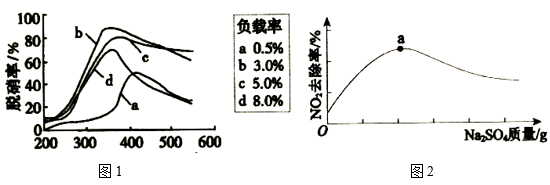
为达到最佳的脱硝效果,应采取的反应条件为___ (填温度和负载率数值)。
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+ (aq)
(aq) CaSO4(s)+
CaSO4(s)+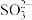 (aq)
(aq)
Ⅱ.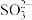 (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq)
浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是___ 。
(1)在含
 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是(2)用NaClO可以将氨氮(NH3、NH
 )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。

为达到最佳的脱硝效果,应采取的反应条件为
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+
 (aq)
(aq) CaSO4(s)+
CaSO4(s)+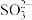 (aq)
(aq)Ⅱ.
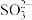 (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq) 浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是
您最近一年使用:0次
2021-06-30更新
|
140次组卷
|
2卷引用:江苏省宿迁市2020-2021学年高二下学期期末考试化学试题
名校
9 . I.现有下列物质①熔化的NaCl②盐酸③氯气④冰醋酸⑤铜⑥酒精⑦硫酸氢钠⑧液氨⑨SO2⑩Al2O3,请按要求回答下列问题。
(1)属于强电解质的是_______ (填序号)
(2)在上述状态下能导电的是_______ (填序号)
(3)属于非电解质,但溶于水后的水溶液能导电的是_______ (填序号)
II.工业合成氨N2(g)+3H2(g) 2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
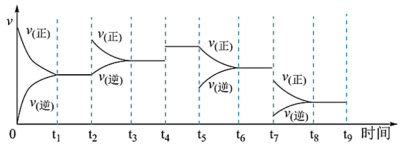
(4)其中 t4时刻所对应的实验条件改变是_____ ,t5时刻所对应的实验条件改变是_____ ,平衡常数最大的时间段是_____ 。
(5)为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_______(填字母)。
(6)实际生产中一般采用的反应条件为400~500℃,原因是_______ 。
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于非电解质,但溶于水后的水溶液能导电的是
II.工业合成氨N2(g)+3H2(g)
 2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
(4)其中 t4时刻所对应的实验条件改变是
(5)为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_______(填字母)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
您最近一年使用:0次
名校
10 . 现有反应mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)m+n___________ p(填“>”、“<”或“=”)。
(2)减压时,A的质量分数___________ (填“增大”、“减小”或“不变”,下同)。
(3)若加入B(容器体积不变),则A的转化率___________ ,B的转化率___________ 。
(4)若升高温度,则平衡时,B、C的浓度之比将___________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量___________ 。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色___________ (填“变浅”、“变深”或“不变”,下同),而维持容器内气体的压强不变充入氖气时,混合物的颜色___________ 。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)m+n
(2)减压时,A的质量分数
(3)若加入B(容器体积不变),则A的转化率
(4)若升高温度,则平衡时,B、C的浓度之比将
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色
您最近一年使用:0次



