1 . 甲醇是一种可再生的清洁能源,二氧化碳催化加氢制甲醇,有利于实现“碳达峰”、“碳中和”。已知有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ. ,
,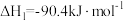 ;
;
Ⅱ. ,
, ;
;
Ⅲ. ,
,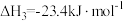 ;
;
Ⅳ. ,
,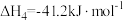 ;
;
请回答下列问题:
(1)

_______ 。
(2)在体积一定的密闭容器中按物质的量比1:2充入CO和 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②反应Ⅰ达平衡后,下列措施能提高 产率的是
产率的是_______ (填字母)。
A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:_______ 的浓度随时间的变化; 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(4)对于反应Ⅲ,其速率方程式为 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
已知某温度下,上述反应平衡常数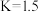 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  。
。
 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
 ,
,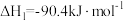 ;
;Ⅱ.
 ,
, ;
;Ⅲ.
 ,
,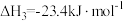 ;
;Ⅳ.
 ,
,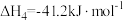 ;
;请回答下列问题:
(1)


(2)在体积一定的密闭容器中按物质的量比1:2充入CO和
 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。
 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
②反应Ⅰ达平衡后,下列措施能提高
 产率的是
产率的是A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入
 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示: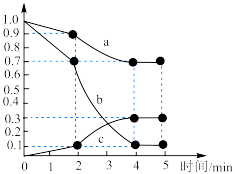
 内,
内, 的平均反应速率为
的平均反应速率为 。
。(4)对于反应Ⅲ,其速率方程式为
 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。已知某温度下,上述反应平衡常数
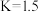 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:| 物质 |  |  |  |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |

 。
。
您最近一年使用:0次
解题方法
2 . 苯甲酸甲酯是一种无色透明油状液体,具有浓郁的冬青油香气,用于配制香水、香精,也可用作有机合成中间体、溶剂等。某实验小组以苯甲酸和甲醇为原料模拟工业合成苯甲酸甲酯,步骤如下:
Ⅰ.制备:向100mL如图所示的装置A中加入磁力搅拌子,然 后依次加入6.1 g苯甲酸、10 mL 95%甲醇、20 mL苯,微热将苯甲酸全部融化后,加入2.5克固体氯化铝催化剂。按如图所示组装好仪器,并预先在分水器内加入水至略低于支管口,加热回流4 h,直至反应基本完成。
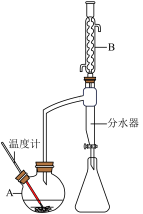
实验过程中分水器得到的液体会分层,需多次开启分水器活塞将下层液体放出。
Ⅱ.分离提纯:待反应液冷却至室温后过滤掉氯化铝,将液体倒入盛有冷水的烧杯中,再经过一系列分离提纯操作,最后蒸馏收集196~199°C馏分,得到5.0 g产品。
可能用到的数据如下:
请回答下列问题:
(1)苯甲酸的沸点高于苯甲酸甲酯的原因为___________ 。
(2)加料时,n(甲醇):n(苯甲酸)约为5:1,甲醇过量的原因是____________ ;但醇酸比超过5:1时,醇酸比的增加对产率影响不大,原因是___________ 。
(3)该实验的温度控制在85°C,应采取的加热方式为___________ 。
(4)实验中需多次将分水器中下层液体放出,其目的是___________ ,判断反应已经完成的标志是___________ 。
(5)步骤Ⅱ中,“一系列分离提纯操作”过程中用到的试剂包括a.无水氯化钙,b.饱和食盐水,c.5% Na2CO3溶液。按操作先后顺序应依次加入___________ (填字母),加入饱和食盐水的作用是___________ 。
(6)传统制法用浓硫酸催化,浓硫酸催化具有活性高,价格低廉的优点,但现代工艺多以固体氯化铝作催化剂。这样改进最主要的原因是___________ 。
Ⅰ.制备:向100mL如图所示的装置A中加入磁力搅拌子,然 后依次加入6.1 g苯甲酸、10 mL 95%甲醇、20 mL苯,微热将苯甲酸全部融化后,加入2.5克固体氯化铝催化剂。按如图所示组装好仪器,并预先在分水器内加入水至略低于支管口,加热回流4 h,直至反应基本完成。

实验过程中分水器得到的液体会分层,需多次开启分水器活塞将下层液体放出。
Ⅱ.分离提纯:待反应液冷却至室温后过滤掉氯化铝,将液体倒入盛有冷水的烧杯中,再经过一系列分离提纯操作,最后蒸馏收集196~199°C馏分,得到5.0 g产品。
可能用到的数据如下:
| 有机物名称 | 相对分子质量 | 密度/(g· cm-3) | 沸点/°C | 溶解性 |
| 苯甲酸 | 122 | 1.26 | 249 | 微溶于水,易溶于乙醇 |
| 甲醇 | 32 | 0.79 | 64.8 | 易溶于水 |
| 苯甲酸甲酯 | 136 | 1.08 | 198 | 难溶于水、易溶于乙醇 |
| 苯 | 78 | 0.88 | 80.1 | 难溶于水 |
(1)苯甲酸的沸点高于苯甲酸甲酯的原因为
(2)加料时,n(甲醇):n(苯甲酸)约为5:1,甲醇过量的原因是
(3)该实验的温度控制在85°C,应采取的加热方式为
(4)实验中需多次将分水器中下层液体放出,其目的是
(5)步骤Ⅱ中,“一系列分离提纯操作”过程中用到的试剂包括a.无水氯化钙,b.饱和食盐水,c.5% Na2CO3溶液。按操作先后顺序应依次加入
(6)传统制法用浓硫酸催化,浓硫酸催化具有活性高,价格低廉的优点,但现代工艺多以固体氯化铝作催化剂。这样改进最主要的原因是
您最近一年使用:0次
名校
3 . NOx(主要指NO和NO2)是大气主要污染物之一,有效去除大气中的NOx是环保工作者的重要研究课题。回答下列问题:
(1)已知:
①2NO2(g)+H2O(l)=HNO3 (aq) + HNO2(aq) △H1=-116.1 kJ·mol-1;
②3HNO2 (aq)=HNO3(aq) +2NO(g)+H2O(l) △H2=+75.9 kJ·mol-1。
则3NO2(g)+ H2O(l)=2HNO3 (aq)+NO(g)的△H为___________ 。
(2)在400 °C、催化剂存在条件下,NH3可以将NO还原为N2和H2O,反应为4NH3(g)+6NO(g) 5N2(g) +6H2O(g) △H<0。在该条件下,向体积为1 L的恒容密闭容器中通入4 mol NH3和6 mol NO发生上述反应,5 min末达到平衡, NO的平衡转化率为90%。
5N2(g) +6H2O(g) △H<0。在该条件下,向体积为1 L的恒容密闭容器中通入4 mol NH3和6 mol NO发生上述反应,5 min末达到平衡, NO的平衡转化率为90%。
①该反应的平衡常数表达式为Kc=___________ ,0~5 min用N2表示该反应的平均速率为___________ mol· L-1·min-1
②400 °C时,为提高NO的转化率,应选择的反应条件为___________ (填“增大压强”或“减小压强”)。
(3)NO和H2反应的化学方程式为2NO(g) +2H2(g) N2(g) + 2H2O(g),在T °C时,1 L恒容密闭容器里,充入0.003molNO和0.006molH2,测得体系的总压强p随时间t的变化如下表所示:
N2(g) + 2H2O(g),在T °C时,1 L恒容密闭容器里,充入0.003molNO和0.006molH2,测得体系的总压强p随时间t的变化如下表所示:
t=20 min时,体系中H2的分压p(H2)=___________ kPa,NO的平衡转化率为___________ %(保留一位小数)。
(4)温度为T° C,向体积不等的恒容密闭容器中分别加入足量活性炭和1 mol NO2,发生反应:2C(s)+2NO2(g) N2(g) +2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g) +2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
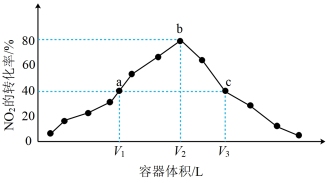
①c点时,反应___________ (填“是”或“否”)达到平衡状态。
②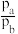
___________ (填“>”“=”或“<”) 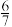 。
。
(1)已知:
①2NO2(g)+H2O(l)=HNO3 (aq) + HNO2(aq) △H1=-116.1 kJ·mol-1;
②3HNO2 (aq)=HNO3(aq) +2NO(g)+H2O(l) △H2=+75.9 kJ·mol-1。
则3NO2(g)+ H2O(l)=2HNO3 (aq)+NO(g)的△H为
(2)在400 °C、催化剂存在条件下,NH3可以将NO还原为N2和H2O,反应为4NH3(g)+6NO(g)
 5N2(g) +6H2O(g) △H<0。在该条件下,向体积为1 L的恒容密闭容器中通入4 mol NH3和6 mol NO发生上述反应,5 min末达到平衡, NO的平衡转化率为90%。
5N2(g) +6H2O(g) △H<0。在该条件下,向体积为1 L的恒容密闭容器中通入4 mol NH3和6 mol NO发生上述反应,5 min末达到平衡, NO的平衡转化率为90%。①该反应的平衡常数表达式为Kc=
②400 °C时,为提高NO的转化率,应选择的反应条件为
(3)NO和H2反应的化学方程式为2NO(g) +2H2(g)
 N2(g) + 2H2O(g),在T °C时,1 L恒容密闭容器里,充入0.003molNO和0.006molH2,测得体系的总压强p随时间t的变化如下表所示:
N2(g) + 2H2O(g),在T °C时,1 L恒容密闭容器里,充入0.003molNO和0.006molH2,测得体系的总压强p随时间t的变化如下表所示:| t/ min | 0 | 10 | 20 | 30 | 40 |
| p/kPa | 36 | 33.8 | 32 | 30.4 | 30.4 |
t=20 min时,体系中H2的分压p(H2)=
(4)温度为T° C,向体积不等的恒容密闭容器中分别加入足量活性炭和1 mol NO2,发生反应:2C(s)+2NO2(g)
 N2(g) +2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g) +2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
①c点时,反应
②
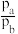
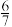 。
。
您最近一年使用:0次
2022-06-10更新
|
342次组卷
|
2卷引用:山西省吕梁市交城县2022届高三下学期第一次模拟考试理科综合化学试题
名校
4 . 在密闭容器中进行如下反应:
 ,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加 ,则平衡
,则平衡___________ (填“逆向移动”“正向移动”或“不移动”,下同),
___________ (填“增大”“减小”或“不变”,下同)。
(2)保持温度不变,增大反应容器的容积,则平衡___________ ,
___________ 。
(3)保持反应容器的容积和温度不变,通入 ,则平衡
,则平衡___________ ,
___________ 。
(4)保持反应容器的容积不变,升高温度,则平衡___________ ,
___________ 。

 ,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。(1)增加
 ,则平衡
,则平衡
(2)保持温度不变,增大反应容器的容积,则平衡

(3)保持反应容器的容积和温度不变,通入
 ,则平衡
,则平衡
(4)保持反应容器的容积不变,升高温度,则平衡

您最近一年使用:0次
2021-10-23更新
|
101次组卷
|
6卷引用:山西省大同市平城中学校2021-2022学年高二上学期10月月考化学试卷
山西省大同市平城中学校2021-2022学年高二上学期10月月考化学试卷(已下线)2.3.2 温度变化对化学平衡的影响(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)安徽省六安市晓天中学2021-2022学年高二上学期期中测试化学试题云南省保山第一中学2022-2023学年高二下学期期末考试化学试题云南省昌宁县第一中学2022-2023学年高二下学期期末考试化学试题
5 . 研究大气污染物和水污染物的处理对建设美丽中国具有重要意义。汽车尾气中的CO、NOx和碳氮化合物是大气污染物。科研工作者经过研究,可以用不同方法处理氮的氧化物﹐防止空气污染。回答下列问题:
(1)已知: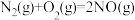



 能将NO转化成无毒物质。写出在298K时该反应的热化学方程式:
能将NO转化成无毒物质。写出在298K时该反应的热化学方程式:___________ 。
(2)我国科研人员研究出了用活性炭对汽车尾气中NO处理的方法: 。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率
。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率 (NO)随温度的变化关系如图所示:
(NO)随温度的变化关系如图所示:
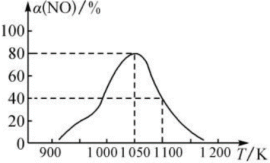
由图可知,温度低于1050K时,NO的转化率随温度升高而增大,原因是___________ 。
(3)科研人员进一步对比研究了活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1mol/L。不同温度下,测得2小时时NO去除率如图所示:

①据图分析,490℃以下反应活化能最小的是___________ (用a、b、c表示);CaO/C、La2O3/C去除NO效果比C更好,其理由是___________ 。(写出一条即可)
②上述实验中,490℃时,若测得CaO/C对NO的去除率为60%,则可能采取的措施是___________ 。
A.恒容下,及时分离出 B.压缩体积 C.恒容下,向体系通入氮气
B.压缩体积 C.恒容下,向体系通入氮气
③490℃时的反应速率
___________  ,该温度下此反应的平衡常数为121,则反应达到平衡时NO的去除率为
,该温度下此反应的平衡常数为121,则反应达到平衡时NO的去除率为___________ (保留两位有效数字)。
(4)氮氧化物也可以用尿素[ ]水溶液吸收。用尿素水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
]水溶液吸收。用尿素水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为___________ 。
(1)已知:
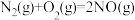



 能将NO转化成无毒物质。写出在298K时该反应的热化学方程式:
能将NO转化成无毒物质。写出在298K时该反应的热化学方程式:(2)我国科研人员研究出了用活性炭对汽车尾气中NO处理的方法:
 。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率
。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率 (NO)随温度的变化关系如图所示:
(NO)随温度的变化关系如图所示:
由图可知,温度低于1050K时,NO的转化率随温度升高而增大,原因是
(3)科研人员进一步对比研究了活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1mol/L。不同温度下,测得2小时时NO去除率如图所示:

①据图分析,490℃以下反应活化能最小的是
②上述实验中,490℃时,若测得CaO/C对NO的去除率为60%,则可能采取的措施是
A.恒容下,及时分离出
 B.压缩体积 C.恒容下,向体系通入氮气
B.压缩体积 C.恒容下,向体系通入氮气③490℃时的反应速率

 ,该温度下此反应的平衡常数为121,则反应达到平衡时NO的去除率为
,该温度下此反应的平衡常数为121,则反应达到平衡时NO的去除率为(4)氮氧化物也可以用尿素[
 ]水溶液吸收。用尿素水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
]水溶液吸收。用尿素水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
您最近一年使用:0次
6 . 氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=
CaCO3(s)+2H2(g),其反应的平衡常数K=____ (用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为_____ ;向该容器中补充amol炭,水蒸气的转化率将_____ (填“增大”、“减小”或“不变”)。
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡_____ 移动( 填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___ (填“变大”、“变小”或“不变”)。
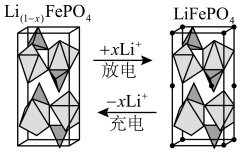
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:______ 。
Ⅰ.C(s)+H2O(g)
 CO(g)+H2(g) K1;
CO(g)+H2(g) K1;Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;Ⅲ.CaO(s)+CO2(g)
 CaCO3(s) K3;
CaCO3(s) K3;燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g),其反应的平衡常数K=
CaCO3(s)+2H2(g),其反应的平衡常数K=(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:

您最近一年使用:0次
2020-02-09更新
|
195次组卷
|
2卷引用:山西省大同市2020届高三第一次联合考试(市直)化学试题
名校
解题方法
7 . 金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层) RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤酸浸过程中发生氧化还原反应的化学方程式为______________________ 。
(2)萃取时应加入适量碱的作用是___________________ 。
(3)步骤④中反应的离子方程式为___________________ 。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____ mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______ 。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为_________________ 。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______ mol/L(萃取的量=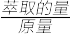 ×100%)
×100%)

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)
 RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)回答下列问题:
(1)步骤酸浸过程中发生氧化还原反应的化学方程式为
(2)萃取时应加入适量碱的作用是
(3)步骤④中反应的离子方程式为
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=
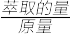 ×100%)
×100%)
您最近一年使用:0次
2018-03-20更新
|
586次组卷
|
4卷引用:【全国百强校】山西省太原市山西大学附属中学2019届高三下学期3月模块诊断理科综合化学试题
名校
8 . 实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓) Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:

(1)装置的连接顺序(按气体左右的方向)是____ →_____ →_____ →_____ →_______ →_____ →_____ →_____ (填各接口的编号)。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________________________ 。
(3)Ⅳ处观察到的现象是___________________________________________ 。
(4)若II中反应在适当的反应状况下,反应达最大限度以后,下列说法正确的是__________ 。
A.SO2浓度必定等于O2浓度的两倍
B.SO2、O2、SO3的分子数之比是2∶1∶2
C.SO2与O2不再化合生成SO3
D.反应混合物各成分的百分组成不再变化
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会_______ (填“增大”“不变”或“减小”)。
(6)用nmol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得III处增重mg,则本实验中SO2的转化率为______________________ 。(用n、m表示)
 Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
(1)装置的连接顺序(按气体左右的方向)是
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是
(3)Ⅳ处观察到的现象是
(4)若II中反应在适当的反应状况下,反应达最大限度以后,下列说法正确的是
A.SO2浓度必定等于O2浓度的两倍
B.SO2、O2、SO3的分子数之比是2∶1∶2
C.SO2与O2不再化合生成SO3
D.反应混合物各成分的百分组成不再变化
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会
(6)用nmol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得III处增重mg,则本实验中SO2的转化率为
您最近一年使用:0次
2016-12-09更新
|
230次组卷
|
2卷引用:2015-2016学年山西省忻州一中高一下期中化学试卷



