名校
解题方法
1 . 硫酸锌是一种重要的工业原料,ZnSO4∙H2O可用于制造印染用的媒染剂,木材及皮革保存剂等。以炼锌厂锌渣为原料,含ZnO、FeO、CuO、CdO等,生产ZnSO4∙H2O的流程如下:
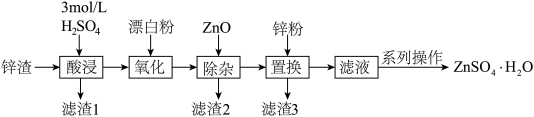
已知:①当溶液中剩余离子浓度小于1×10-5 mol∙L-1时,认为生成沉淀的反应进行完全;
②常温下,Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Fe(OH)2]= 4.9×10-17,Ksp[Cu(OH)2]= 2.2×10-20,Ksp[Zn(OH)2]=1×10-17。
(1)“酸浸”时,需不断通入高温水蒸气,其目的是___________ (填字母)。用18 mol∙L-1的浓硫酸配制3 mol∙L-1H2SO4溶液,下列操作会使所配溶液浓度偏小的是___________ (填字母)。
(2)结合必要的化学反应方程式,从平衡角度解释加入ZnO得到滤渣2的原理:___________ 。除杂过程中,若控制pH=4,溶液中c(Fe3+)=___________ mol∙L-1。结合实际生产情况一般取pH4.5~5.0,pH不宜过大的原因是___________ 。
(3)滤渣3含有Zn和___________ (写化学式)。
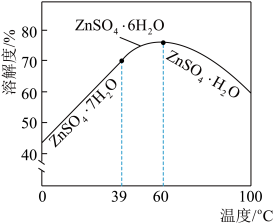
(4)硫酸锌晶体的溶解度与温度的变化如图所示。“系列操作”是:___________ ,洗涤、干燥。

已知:①当溶液中剩余离子浓度小于1×10-5 mol∙L-1时,认为生成沉淀的反应进行完全;
②常温下,Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Fe(OH)2]= 4.9×10-17,Ksp[Cu(OH)2]= 2.2×10-20,Ksp[Zn(OH)2]=1×10-17。
(1)“酸浸”时,需不断通入高温水蒸气,其目的是

(2)结合必要的化学反应方程式,从平衡角度解释加入ZnO得到滤渣2的原理:
(3)滤渣3含有Zn和
(4)硫酸锌晶体的溶解度与温度的变化如图所示。“系列操作”是:

您最近一年使用:0次
2023-01-08更新
|
285次组卷
|
3卷引用:山西省名校联考2022-2023学年高二上学期期末考试化学试题
山西省名校联考2022-2023学年高二上学期期末考试化学试题福建省宁德市2022-2023学年高二上学期期末居家检测化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)
名校
2 . 某温度下,在恒容密闭容器中加入一定量X,发生反应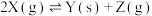
 ,一段时间后达到平衡。下列说法错误的是
,一段时间后达到平衡。下列说法错误的是
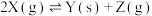
 ,一段时间后达到平衡。下列说法错误的是
,一段时间后达到平衡。下列说法错误的是A.升高温度,若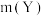 减小,则 减小,则 |
B.加入一定量Y,达新平衡后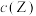 减小 减小 |
C.压缩容器, 增大 增大 |
D.恒压下充入一定量的氦气,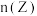 减少 减少 |
您最近一年使用:0次
2022-12-13更新
|
158次组卷
|
2卷引用:山西省晋城市第二中学校2022-2023学年高二上学期12月月考化学试题
3 . 重铬酸钾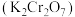 具有强氧化性,在实验室和工业中都有广泛的应用。
具有强氧化性,在实验室和工业中都有广泛的应用。 (黄色)和
(黄色)和 (橙色)在溶液中可相互转化。
(橙色)在溶液中可相互转化。
(1) 中元素铬(Cr)的化合价为
中元素铬(Cr)的化合价为_______ 。
(2)室温下,初始浓度为 的
的 溶液中
溶液中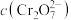 随
随 的变化如图所示。(忽略溶液体积变化)
的变化如图所示。(忽略溶液体积变化)

①用离子方程式表示 溶液中的转化反应
溶液中的转化反应_______ 。
②计算B点时 的转化率为
的转化率为_______ 。
③根据A点数据,计算上述反应的平衡常数_______ 。
(3)向橙色的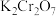 溶液中,滴加
溶液中,滴加 溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是
溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是_______ ,用平衡移动的原理解释溶液pH变小的原因是_______ 。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定二价铁含量。
用 溶液滴定20.00mL未知浓度的含
溶液滴定20.00mL未知浓度的含 的溶液,恰好完全反应时消耗
的溶液,恰好完全反应时消耗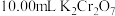 溶液,则溶液中
溶液,则溶液中 的物质的量浓度是
的物质的量浓度是_______ (已知: (未配平)。
(未配平)。
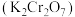 具有强氧化性,在实验室和工业中都有广泛的应用。
具有强氧化性,在实验室和工业中都有广泛的应用。 (黄色)和
(黄色)和 (橙色)在溶液中可相互转化。
(橙色)在溶液中可相互转化。(1)
 中元素铬(Cr)的化合价为
中元素铬(Cr)的化合价为(2)室温下,初始浓度为
 的
的 溶液中
溶液中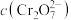 随
随 的变化如图所示。(忽略溶液体积变化)
的变化如图所示。(忽略溶液体积变化)
①用离子方程式表示
 溶液中的转化反应
溶液中的转化反应②计算B点时
 的转化率为
的转化率为③根据A点数据,计算上述反应的平衡常数
(3)向橙色的
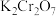 溶液中,滴加
溶液中,滴加 溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是
溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是(4)用重铬酸钾法(一种氧化还原滴定法)可测定二价铁含量。
用
 溶液滴定20.00mL未知浓度的含
溶液滴定20.00mL未知浓度的含 的溶液,恰好完全反应时消耗
的溶液,恰好完全反应时消耗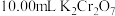 溶液,则溶液中
溶液,则溶液中 的物质的量浓度是
的物质的量浓度是 (未配平)。
(未配平)。
您最近一年使用:0次
2022-11-16更新
|
58次组卷
|
2卷引用:山西高中教育发展联盟2022-2023学年高二上学期11月份期中检测化学试题
名校
4 . 已知: 溶液中存在如下平衡:
溶液中存在如下平衡: (蓝色)
(蓝色)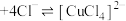 (黄色)
(黄色)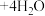
 。某同学通过实验研究氯化铜溶液颜色的变化。下列说法不正确的是。
。某同学通过实验研究氯化铜溶液颜色的变化。下列说法不正确的是。

 溶液中存在如下平衡:
溶液中存在如下平衡: (蓝色)
(蓝色)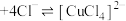 (黄色)
(黄色)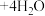
 。某同学通过实验研究氯化铜溶液颜色的变化。下列说法不正确的是。
。某同学通过实验研究氯化铜溶液颜色的变化。下列说法不正确的是。
| A.①溶液呈蓝色 | B.②中黄色物质是 |
| C.若对①加热,溶液可能会变为绿色 | D.若取②中溶液稀释,溶液不可能变为蓝色 |
您最近一年使用:0次
2022-11-16更新
|
123次组卷
|
3卷引用:山西高中教育发展联盟2022-2023学年高二上学期11月份期中检测化学试题
5 . 下图所示为工业合成氨的流程图。下列有关说法错误的是


A.步骤①中 和 和 以体积比1:2.8混合,有利于提高 以体积比1:2.8混合,有利于提高 的转化率 的转化率 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.步骤③既可以加快反应速率,又有利于提高原料的平衡转化率 |
| D.步骤④⑤的目的均是提高原料的转化率 |
您最近一年使用:0次
6 . 某同学研究 溶液中的化学平衡,设计如图所示实验。已知:
溶液中的化学平衡,设计如图所示实验。已知:

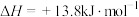 。实验现象如下:
。实验现象如下:
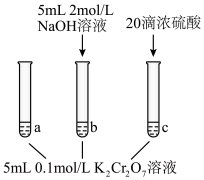
ⅰ.试管a中溶液为橙色;
ⅱ.试管b中溶液为黄色;
ⅲ.试管c中滴加浓硫酸后温度略有升高,溶液变为深橙色。
下列说法正确的是
 溶液中的化学平衡,设计如图所示实验。已知:
溶液中的化学平衡,设计如图所示实验。已知:

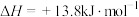 。实验现象如下:
。实验现象如下:
ⅰ.试管a中溶液为橙色;
ⅱ.试管b中溶液为黄色;
ⅲ.试管c中滴加浓硫酸后温度略有升高,溶液变为深橙色。
下列说法正确的是
| A.试管a中加入少量纯碱固体,溶液颜色不变 |
B.试管b中只存在 |
| C.该实验不能证明减小生成物浓度平衡正向移动 |
| D.试管c中影响平衡移动的主要因素是氢离子浓度 |
您最近一年使用:0次
名校
解题方法
7 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:

已知:①+6价铬盐在一定条件下可被还原为 ,
, 在水溶液中为绿色:②微热
在水溶液中为绿色:②微热 溶液,黄色加深。
溶液,黄色加深。
(1) 溶液中存在的转化反应是
溶液中存在的转化反应是___________ (用离子方程式表示);b试管中加水后平衡___________ (填“正向”、“不”或“逆向”)移动,
___________ (填“增大”、“减小”或“不变”)。
(2)对比试管c和b,推测试管c的现象是___________ 。对比试管a和b,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是 增大对平衡的影响。你认为是否需要再设计实验证明
增大对平衡的影响。你认为是否需要再设计实验证明 对平衡的影响,并说明理由:
对平衡的影响,并说明理由:___________ 。
(3)分析试管c继续滴加 溶液和过量稀
溶液和过量稀 的实验现象,说明+6价铬盐氧化性
的实验现象,说明+6价铬盐氧化性
___________  (填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为
(填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为___________ 。

已知:①+6价铬盐在一定条件下可被还原为
 ,
, 在水溶液中为绿色:②微热
在水溶液中为绿色:②微热 溶液,黄色加深。
溶液,黄色加深。(1)
 溶液中存在的转化反应是
溶液中存在的转化反应是
(2)对比试管c和b,推测试管c的现象是
 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是 增大对平衡的影响。你认为是否需要再设计实验证明
增大对平衡的影响。你认为是否需要再设计实验证明 对平衡的影响,并说明理由:
对平衡的影响,并说明理由:(3)分析试管c继续滴加
 溶液和过量稀
溶液和过量稀 的实验现象,说明+6价铬盐氧化性
的实验现象,说明+6价铬盐氧化性
 (填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为
(填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为
您最近一年使用:0次
名校
8 . 根据下列实验操作,能够得到相应实验现象或结论的是
| 选项 | 实验操作 | 实验现象或结论 |
| A | 用注射器吸入 由 由 和 和 组的混合气体,向外拉动注射器活塞至气体体积为原来的2倍 组的混合气体,向外拉动注射器活塞至气体体积为原来的2倍 | 减小容器压强,反应 的平衡逆向移动,气体颜色变深 的平衡逆向移动,气体颜色变深 |
| B | 分别向体积为20mL浓度为1mol/L和 的 的 溶液中加入2g锌粉,比较收集相同体积的 溶液中加入2g锌粉,比较收集相同体积的 所需的时间 所需的时间 | 反应物浓度越大,收集相同体积的 所需的时间越短,反应速率越快 所需的时间越短,反应速率越快 |
| C | 向盛有 5% 5% 溶液的甲、乙试管中分别滴加5滴等浓度的 溶液的甲、乙试管中分别滴加5滴等浓度的 和 和 溶液,对比气泡产生的速率 溶液,对比气泡产生的速率 | 若甲试管中产生气泡的速率更快,则 的催化效果比 的催化效果比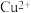 的好 的好 |
| D | 向滴加了KSCN(aq)的 溶液中加入少量KCl固体 溶液中加入少量KCl固体 | 平衡逆向移动,溶液颜色变浅 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-14更新
|
212次组卷
|
4卷引用:山西省长治市上党区2022-2023学年高二上学期11月期中考试化学试题
名校
9 . 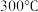 时,10L的某刚性密闭容器中存在如下平衡:
时,10L的某刚性密闭容器中存在如下平衡: ,平衡后再向容器中加入一定量的
,平衡后再向容器中加入一定量的 并重新达到平衡,下列说法中正确的是
并重新达到平衡,下列说法中正确的是
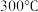 时,10L的某刚性密闭容器中存在如下平衡:
时,10L的某刚性密闭容器中存在如下平衡: ,平衡后再向容器中加入一定量的
,平衡后再向容器中加入一定量的 并重新达到平衡,下列说法中正确的是
并重新达到平衡,下列说法中正确的是A.新平衡时 的体积分数增大 的体积分数增大 | B.新平衡时 的转化率不变 的转化率不变 |
| C.新平衡时混合气体的平均相对分子质量减小 | D.新平衡时 的浓度减小 的浓度减小 |
您最近一年使用:0次
2022-10-14更新
|
146次组卷
|
3卷引用:山西省长治市、忻州市2022-2023学年高二上学期10月月考化学试题
名校
解题方法
10 . 下列叙述及解释正确的是
A.  ,在达到平衡后,对平衡体系采取增大压强(通过缩小体积实现)的措施,因为平衡向正反应方向移动,故体系颜色变浅 ,在达到平衡后,对平衡体系采取增大压强(通过缩小体积实现)的措施,因为平衡向正反应方向移动,故体系颜色变浅 |
B.  ,在达到平衡后,对平衡体系采取减小压强(通过增大体积实现)的措施,因为平衡不移动,故体系颜色不变 ,在达到平衡后,对平衡体系采取减小压强(通过增大体积实现)的措施,因为平衡不移动,故体系颜色不变 |
C.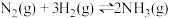 ,在达到平衡后,保持压强不变,充入He,平衡向左移动 ,在达到平衡后,保持压强不变,充入He,平衡向左移动 |
D. ,在达到平衡后,加少量 ,在达到平衡后,加少量 固体,因为平衡向逆反应方向移动,故体系颜色变浅 固体,因为平衡向逆反应方向移动,故体系颜色变浅 |
您最近一年使用:0次
2022-10-10更新
|
401次组卷
|
3卷引用:山西运城盐湖五中2022-2023学年高二上学期阶段性测试化学试题



