名校
1 . 将 放入密闭的真空容器中,反应
放入密闭的真空容器中,反应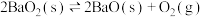 达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡相同
达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡相同
 放入密闭的真空容器中,反应
放入密闭的真空容器中,反应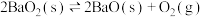 达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡相同
达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡相同| A.保持温度和体积不变,充入一定量的氧气 |
B.保持温度和体积不变,加入一定量的 |
| C.保持温度不变,缩小容器的体积 |
| D.保持体积不变,升高温度 |
您最近一年使用:0次
名校
2 . 工业废水中常含有一定量具有强氧化性和毒性的 和
和 ,必须进行处理。一种处理方法的工艺流程为:
,必须进行处理。一种处理方法的工艺流程为: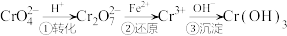 。下列说法正确的是
。下列说法正确的是
 和
和 ,必须进行处理。一种处理方法的工艺流程为:
,必须进行处理。一种处理方法的工艺流程为: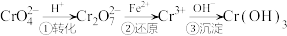 。下列说法正确的是
。下列说法正确的是A. 和 和 不可能共存于同一溶液 不可能共存于同一溶液 |
B.①中可用盐酸调节 |
C.②中 体现氧化性 体现氧化性 |
D.还原1 mol  离子,需要3 mol 离子,需要3 mol  |
您最近一年使用:0次
2022-12-06更新
|
103次组卷
|
2卷引用:安徽省芜湖市第一中学2022-2023学年高三上学期12月月考化学试题
名校
解题方法
3 . 某实验小组依据反应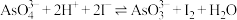 设计如图所示的原电池装置,探究pH对
设计如图所示的原电池装置,探究pH对 氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
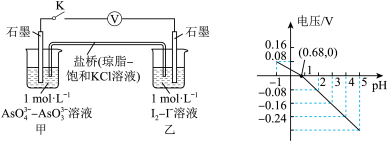
| A.调节pH可以改变反应的方向 | B.pH=0.68时,反应处于平衡状态 |
C.pH>0.68时,氧化性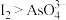 | D.pH=5时,负极电极反应式为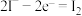 |
您最近一年使用:0次
2022-11-26更新
|
390次组卷
|
4卷引用:安徽省合肥市第一中学2022-2023学年高三上学期11月月考化学试题
名校
4 . 已知反应:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
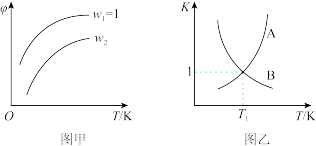
 CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
| A.图甲中W2>1 |
| B.图乙中,A线表示逆反应的平衡常数 |
| C.温度为T1,W=2时,Cl2的转化率为50% |
| D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强增大 |
您最近一年使用:0次
2022-05-18更新
|
1101次组卷
|
25卷引用:安徽省青阳县第一中学2021-2022学年高二下学期5月月考化学试题
安徽省青阳县第一中学2021-2022学年高二下学期5月月考化学试题安徽省舒城中学2021-2022学年高二上学期第二次月考化学试题安徽省芜湖市第十二中学2023-2024学年高二上学期10月月考化学试题吉林省白城市通榆县第一中学2020届高三上学期第三次月考化学试题陕西省西安市高新一中2020-2021学年高一下学期5月月考化学试题湖北省恩施咸丰春晖学校2021-2022学年高二上学期第一次月考化学试题山东省实验中学2021-2022学年高三上学期第二次诊断考试化学试题(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)河南省实验中学2021-2022学年高三上学期期末考试化学试题陕西宝鸡市眉县槐芽中学2022-2023学年高二上学期期中考试化学试题湖南省长沙市雅礼中学2023-2024学年高二上学期第一次月考化学试题湖北省黄冈市2018届高三上学期元月调研考试理综化学试题(已下线)2019年9月27日 《每日一题》2020年高考一轮复习-化学平衡常数和转化率(已下线)专题7.3 化学平衡常数 化学反应进行的方向(练)-《2020年高考一轮复习讲练测》鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时3 化学平衡图象山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题(已下线)第七章 化学反应速率与化学平衡 第42练 化学平衡常数及转化率的计算湖南省张家界市2023届高三下学期模拟考试化学试题河北省衡水中学2023届高三下学期第五次综合素养测评化学试题(已下线)考点23 化学平衡常数(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省宜春市丰城中学2023-2024学年高二下学期开学考试化学试题
5 . 二氧化铈(CeO2)可用作玻璃工业添加剂和有机反应催化剂。以氟碳铈矿(主要含有CeFCO3)为原料制备二氧化铈的一种工艺流程如图:
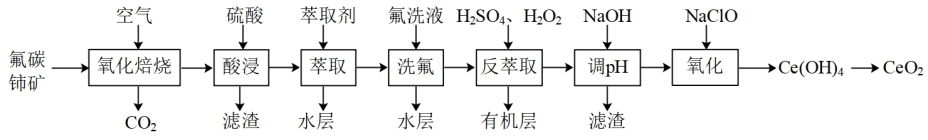
已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:
;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率、提高原料利用率的措施有_______ 。(写一种,合理即可)
(2)“氧化焙烧”后的固体产物中含有CeO2和CeF4,二者物质的量之比为3:1,“酸浸”时发生反应的离子方程式为_______ 。
(3)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP→CeTBP4++F-,氟洗液中添加Al3+的作用是_______ 。
(4)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为_______ 。
(5)“反萃取”后的水层溶液中c(Ce3+)=1mol·L-1,c(Al3+)=0.01mol·L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则需加入NaOH调节溶液pH的范围为_______ ,过滤后,再向滤液加入NaOH使Ce3+沉淀完全(已知:室温下,当溶液中的离子浓度c≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。K[Al(OH)3]=1.0×10-32,K[Ce(OH)3]=1.0×10-21)。
(6)“氧化”时发生反应的化学方程式为_______
(7)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得CeO24.48吨,则CeO2的产率为_______ (保留三位有效数字)。

已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:
;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:(1)“氧化焙烧”时,为了加快反应速率、提高原料利用率的措施有
(2)“氧化焙烧”后的固体产物中含有CeO2和CeF4,二者物质的量之比为3:1,“酸浸”时发生反应的离子方程式为
(3)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP→CeTBP4++F-,氟洗液中添加Al3+的作用是
(4)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为
(5)“反萃取”后的水层溶液中c(Ce3+)=1mol·L-1,c(Al3+)=0.01mol·L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则需加入NaOH调节溶液pH的范围为
(6)“氧化”时发生反应的化学方程式为
(7)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得CeO24.48吨,则CeO2的产率为
您最近一年使用:0次
6 . 三氧化二镍(Ni2O3)是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含金属Ni、A1、Fe及其氧化物、SiO2、C等)回收其中的镍并制备Ni2O3的工艺流程如下所示:

已知:①在该实验条件下NaClO3、Fe3+不能氧化Ni2+。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
③反萃取的反应原理为NiR2+2H+ Ni2++2HR
Ni2++2HR
(1)“预处理”的操作可以选择用_______ (填标号)来除去镍废料表面的矿物油污。
A.纯碱溶液浸泡 B.NaOH溶液浸泡 C.酒精清洗
(2)“氧化”时主要反应的离子方程式是_______ ,实际生产中为了减少杂质离子的引入,可以用来替代NaClO3的试剂是_______ (填化学式)。
(3)利用上述表格数据,计算Al(OH)3的Ksp=_______ (列出计算式),若“氧化”后的溶液中Ni2+浓度为0.1mol·L-1,则“调pH”应控制的pH范围是_______ 。
(4)向有机相中加入H2SO4溶液能进行反萃取的原因为_______ (结合平衡移动原理解释)。
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
从NiSO4溶液获得稳定的NiSO4·6H2O晶体的操作依次是_______ 。
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为_______ 。

已知:①在该实验条件下NaClO3、Fe3+不能氧化Ni2+。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | A13+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.010 mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀时(c=1.0×10-5 mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
 Ni2++2HR
Ni2++2HR(1)“预处理”的操作可以选择用
A.纯碱溶液浸泡 B.NaOH溶液浸泡 C.酒精清洗
(2)“氧化”时主要反应的离子方程式是
(3)利用上述表格数据,计算Al(OH)3的Ksp=
(4)向有机相中加入H2SO4溶液能进行反萃取的原因为
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 | NiSO4·7H2O | NiSO4·6H2O | 多种结晶水合物 | NiSO4 |
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为
您最近一年使用:0次
2022-03-28更新
|
399次组卷
|
3卷引用:安徽省示范高中皖北协作区2021-2022学年高三下学期3月联考理科综合化学试题
名校
7 . 化学与生产生活息息相关,下列说法不正确 的是
| A.泡沫灭火器喷出的主要物质是Al(OH)3和CO2 |
| B.长期使用(NH4)2SO4作化肥会使土壤酸化 |
| C.电解饱和食盐水可以得到金属钠和氯气 |
| D.合成氨工业中,将NH3及时液化分离有利于提高反应物的利用率 |
您最近一年使用:0次
2022-03-23更新
|
227次组卷
|
4卷引用:安徽省桐城中学2022-2023学年高二上学期月考(1)化学试题
8 . 还原法处理氮的氧化物是环境科学研究的热点课题
(1)汽车尾气中CO、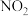 在一定条件下可以发生反应:
在一定条件下可以发生反应: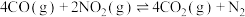
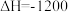
 。在一定温度下,向容积固定为2 L的密闭容器中充入1.2 mol CO和一定量的
。在一定温度下,向容积固定为2 L的密闭容器中充入1.2 mol CO和一定量的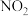 ,
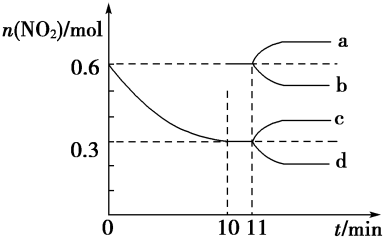
,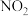 的物质的量随时间的变化曲线如图所示。
的物质的量随时间的变化曲线如图所示。
①恒温恒容条件下,不能说明该反应已达到平衡状态的是_______ (填标号)。
A.容器内混合气体颜色不再变化 B.
C.容器内的压强保持不变 D.容器内混合气体密度保持不变
②0~10 min内该反应的平均速率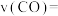
_______ ,从11 min起其他条件不变,压缩容器的容积变为1 L,则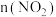 的变化曲线可能为图中的
的变化曲线可能为图中的_______ (填字母)。
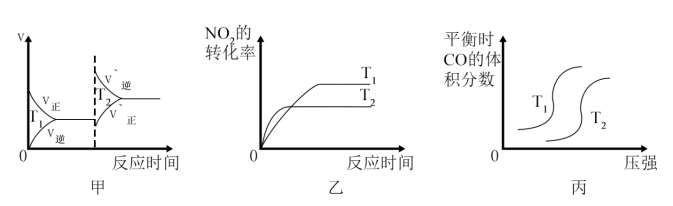
③对于该反应,温度不同( )、其他条件相同时,下列图象表示正确的是
)、其他条件相同时,下列图象表示正确的是_______ (填序号)。
(2)碳单质可应用于脱硝。向容积为2 L的密闭容器中加入炭(足量)和2.0 mol NO,模拟发生脱硝反应: ,测得不同温度下,NO的物质的量随时间的变化如下图所示。
,测得不同温度下,NO的物质的量随时间的变化如下图所示。

① 温度时,若起始向容器中充入
温度时,若起始向容器中充入 (g)和
(g)和 (g)各1 mol,平衡时,NO的体积分数为
(g)各1 mol,平衡时,NO的体积分数为_______ 。
② 温度时该反应的平衡常数为
温度时该反应的平衡常数为_______ 。
③ 温度下,向平衡后的容器内再加入2 mol
温度下,向平衡后的容器内再加入2 mol  和2 mol NO,则平衡
和2 mol NO,则平衡_______ (填“向右移动”“向左移动”或“不移动”)。
(1)汽车尾气中CO、
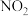 在一定条件下可以发生反应:
在一定条件下可以发生反应: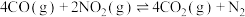
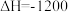
 。在一定温度下,向容积固定为2 L的密闭容器中充入1.2 mol CO和一定量的
。在一定温度下,向容积固定为2 L的密闭容器中充入1.2 mol CO和一定量的 ,
, 的物质的量随时间的变化曲线如图所示。
的物质的量随时间的变化曲线如图所示。
①恒温恒容条件下,不能说明该反应已达到平衡状态的是
A.容器内混合气体颜色不再变化 B.

C.容器内的压强保持不变 D.容器内混合气体密度保持不变
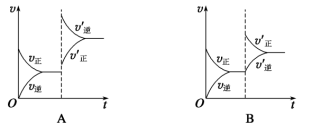
②0~10 min内该反应的平均速率
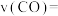
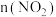 的变化曲线可能为图中的
的变化曲线可能为图中的③对于该反应,温度不同(
 )、其他条件相同时,下列图象表示正确的是
)、其他条件相同时,下列图象表示正确的是
(2)碳单质可应用于脱硝。向容积为2 L的密闭容器中加入炭(足量)和2.0 mol NO,模拟发生脱硝反应:
 ,测得不同温度下,NO的物质的量随时间的变化如下图所示。
,测得不同温度下,NO的物质的量随时间的变化如下图所示。
①
 温度时,若起始向容器中充入
温度时,若起始向容器中充入 (g)和
(g)和 (g)各1 mol,平衡时,NO的体积分数为
(g)各1 mol,平衡时,NO的体积分数为②
 温度时该反应的平衡常数为
温度时该反应的平衡常数为③
 温度下,向平衡后的容器内再加入2 mol
温度下,向平衡后的容器内再加入2 mol  和2 mol NO,则平衡
和2 mol NO,则平衡
您最近一年使用:0次
名校
9 . 下列事实不能用勒夏特列原理解释的是
| A.打开可乐瓶盖后看到有大量气泡逸出 |
| B.H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深 |
| C.新制的氯水在光照条件下颜色变浅,溶液的pH减小 |
| D.实验室可用向浓氨水中加入一定量的氢氧化钠固体来快速制取氨气 |
您最近一年使用:0次
2022-01-23更新
|
393次组卷
|
3卷引用:安徽省合肥市肥东县综合高中2021-2022学年高二下学期5月月考化学试题
名校
10 . 某温度下,在恒容密闭容器中SO2、O2、SO3三种气态物质建立化学平衡:2SO2(g)+O2(g) 2SO3(g) ΔH<0,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法不正确的是
2SO3(g) ΔH<0,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法不正确的是
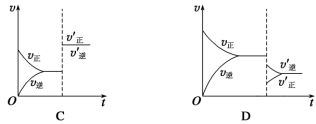
 2SO3(g) ΔH<0,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法不正确的是
2SO3(g) ΔH<0,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法不正确的是

| A.压缩容器体积 | B.通入O2 |
| C.通入稀有气体He | D.减低温度 |
您最近一年使用:0次
2021-11-15更新
|
202次组卷
|
2卷引用:安徽省宣城中学2022-2023学年高二上学期10月月考化学试题



