名校
1 . 1776年,法国化学家LaVoisier首次确定硫元素。自然界天然的硫单质主要存在于火山区,发生反应如下(a、b均大于0):ⅰ.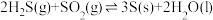
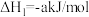 ;
;
ⅱ. 。回答下列问题:
。回答下列问题:
(1)根据上述信息,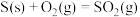 )
) 
_______ kJ/mol。推测a____ b或(填“>”“<”或“=”)。
(2)一定温度下,在恒容密闭容器中充入适量的 、
、 和
和 气体,仅发生上述反应。下列叙述正确的是_______(填字母)。
气体,仅发生上述反应。下列叙述正确的是_______(填字母)。
(3)一定温度下,向2L密闭容器中充入 和
和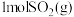 ,仅发生反应①,达到平衡后,测得
,仅发生反应①,达到平衡后,测得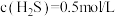 。温度保持不变,压缩容器至1L且保持体积不变,达到新平衡时
。温度保持不变,压缩容器至1L且保持体积不变,达到新平衡时
_______ mol/L。
(4)在恒容密闭容器中充入一定量 和
和 气体,测得
气体,测得 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比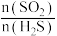 关系如图所示。
关系如图所示。
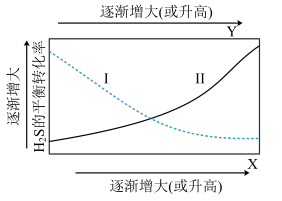
①代表 的平衡转化率随温度变化的曲线为
的平衡转化率随温度变化的曲线为_______ 。
②解释曲线Ⅱ变化趋势:_______ 。
(5)一定温度下,向密闭容器中充入 、
、 和
和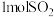 ,达到平衡时测得平衡体系中有
,达到平衡时测得平衡体系中有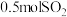 和
和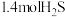 ,平衡时总压强为21kPa。该温度下,反应②的平衡常数
,平衡时总压强为21kPa。该温度下,反应②的平衡常数
_______ 。(不要求带单位,可用分数表示,提示:用分压计算的平衡常数为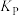 ,分压等于总压×物质的量分数)。
,分压等于总压×物质的量分数)。
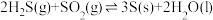
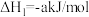 ;
;ⅱ.
 。回答下列问题:
。回答下列问题:(1)根据上述信息,
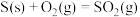 )
) 
(2)一定温度下,在恒容密闭容器中充入适量的
 、
、 和
和 气体,仅发生上述反应。下列叙述正确的是_______(填字母)。
气体,仅发生上述反应。下列叙述正确的是_______(填字母)。| A.混合气体密度不再随时间变化时达到平衡状态 |
| B.增大硫单质的质量,逆反应速率会增大 |
C.达到平衡后,适当升温, 的平衡转化率减小 的平衡转化率减小 |
| D.平衡后充入少量惰性气体(不反应),平衡向左移动 |
 和
和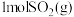 ,仅发生反应①,达到平衡后,测得
,仅发生反应①,达到平衡后,测得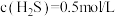 。温度保持不变,压缩容器至1L且保持体积不变,达到新平衡时
。温度保持不变,压缩容器至1L且保持体积不变,达到新平衡时
(4)在恒容密闭容器中充入一定量
 和
和 气体,测得
气体,测得 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比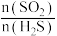 关系如图所示。
关系如图所示。
①代表
 的平衡转化率随温度变化的曲线为
的平衡转化率随温度变化的曲线为②解释曲线Ⅱ变化趋势:
(5)一定温度下,向密闭容器中充入
 、
、 和
和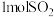 ,达到平衡时测得平衡体系中有
,达到平衡时测得平衡体系中有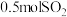 和
和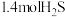 ,平衡时总压强为21kPa。该温度下,反应②的平衡常数
,平衡时总压强为21kPa。该温度下,反应②的平衡常数
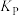 ,分压等于总压×物质的量分数)。
,分压等于总压×物质的量分数)。
您最近一年使用:0次
2022-12-15更新
|
356次组卷
|
3卷引用:江西省2022-2023学年高二上学期12月统一调研测试(联考)化学试题
名校
解题方法
2 . 两个容积均为2 L的密闭容器Ⅰ和Ⅱ中充入NO和CO气体,发生反应:
 ,各物质的起始物质的量见表。实验测得两容器在不同温度下达到平衡时
,各物质的起始物质的量见表。实验测得两容器在不同温度下达到平衡时 的物质的量如图所示。下列说法正确的是
的物质的量如图所示。下列说法正确的是
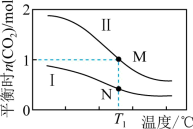

 ,各物质的起始物质的量见表。实验测得两容器在不同温度下达到平衡时
,各物质的起始物质的量见表。实验测得两容器在不同温度下达到平衡时 的物质的量如图所示。下列说法正确的是
的物质的量如图所示。下列说法正确的是
| 容器 | 起始物质的量 | |
| NO | CO | |
| Ⅰ | 1 mol | 3 mol |
| Ⅱ | 2 mol | 6 mol |
A.M、N两点容器内的压强: |
| B.N点的平衡常数为0.08 |
C.若将容器Ⅰ的容积改为1 L, 温度下达到平衡时NO的转化率为25% 温度下达到平衡时NO的转化率为25% |
D.图中M点所示条件下,再通入CO、 各2 mol,此时v(正)<v(逆) 各2 mol,此时v(正)<v(逆) |
您最近一年使用:0次
22-23高二上·北京西城·期中
3 . 下列实验方案不能达到相应目的的是
| 目的 | A.验证Fe是否被氧化 | B.研究浓度对FeCl3水解平衡的影响 |
| 实验方案 | 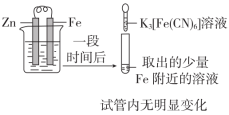 |  |
| 目的 | C.比较CH3COOH和H3BO3(硼酸,一元弱酸)酸性的强弱 | D.比较AgCl和AgI溶解度的大小 |
| 实验方案 |  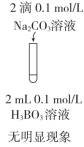 | 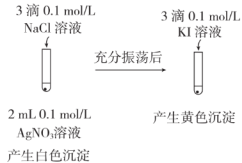 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应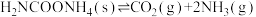 ,下列不能说明反应达到平衡的是
,下列不能说明反应达到平衡的是
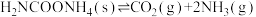 ,下列不能说明反应达到平衡的是
,下列不能说明反应达到平衡的是| A.混合气体的密度保持不变 | B.混合气体的平均摩尔质量保持不变 |
| C.二氧化碳体积分数保持不变 | D.混合气体的压强保持不变 |
您最近一年使用:0次
名校
5 . 在一定温度下,只改变反应物中n(SO2),对反应2SO2+O2 2SO3的影响如图所示,下列说法正确的是
2SO3的影响如图所示,下列说法正确的是
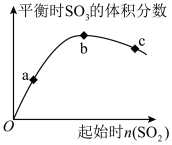
 2SO3的影响如图所示,下列说法正确的是
2SO3的影响如图所示,下列说法正确的是
| A.a、b、c点均为平衡点,且b点时SO2的转化率最大 |
| B.三点O2体积分数,a>b>c |
| C.三点平衡常数:Kb>Kc>Ka |
| D.随着 SO2的物质的量增加,平衡先向正向移动,后向逆向移动 |
您最近一年使用:0次
2022-10-18更新
|
351次组卷
|
2卷引用:江西省抚州市临川第二中学2022-2023学年高二上学期第一次月考化学试题
名校
6 . 已知反应:mX(g)+nY(?) pQ(s)+2mZ(g),反应达平衡时,c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的
pQ(s)+2mZ(g),反应达平衡时,c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的 ,c(X)=0.5mol/L,下列说法正确的是
,c(X)=0.5mol/L,下列说法正确的是
 pQ(s)+2mZ(g),反应达平衡时,c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的
pQ(s)+2mZ(g),反应达平衡时,c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的 ,c(X)=0.5mol/L,下列说法正确的是
,c(X)=0.5mol/L,下列说法正确的是| A.反应向逆方向移动 | B.Y可能是固体或液体 |
| C.系数n<m | D.Z的体积分数增大 |
您最近一年使用:0次
名校
7 . 工业制硫酸中的一步重要反应是SO2在400~500℃下发生的催化氧化反应2SO2+O2 2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是
2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是
 2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是
2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.达到平衡时,SO2的浓度与SO3的浓度一定相等 |
| C.为了提高SO2的转化率,可适当提高SO2的浓度 |
| D.在上述条件下,SO2不可能100%地转化为SO3 |
您最近一年使用:0次
解题方法
8 . 兴趣小组同学为探究影响化学反应速率及化学平衡的因素,设计以下实验:

(1)利用实验I探究锌与稀硫酸反应的速率,需要记录的实验数据有:___________ 。
(2)利用实验II探究浓度对化学平衡的影响。已知: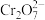 (橙色)
(橙色)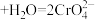 (黄色)
(黄色)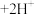 ,推测B试管中的实验现象为:
,推测B试管中的实验现象为:___________ ,用平衡移动原理解释其原因:___________ 。
(3)该小组同学继续用酸性 溶液和草酸(
溶液和草酸( )溶液进行实验,设计实验方案如表所示。请回答相关问题:
)溶液进行实验,设计实验方案如表所示。请回答相关问题:
①实验时,分别量取 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定___________ 来判断反应的快慢。
②实验a、b、c所加的 溶液均要过量。理由是
溶液均要过量。理由是___________ 。
③实验a和b是探究___________ 对化学反应速率的影响。实验b和c是探究___________ 对化学反应速率的影响。
④实验a和b起初反应均很慢,过了一会儿速率突然增大,可能原因是___________ 。

(1)利用实验I探究锌与稀硫酸反应的速率,需要记录的实验数据有:
(2)利用实验II探究浓度对化学平衡的影响。已知:
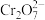 (橙色)
(橙色)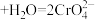 (黄色)
(黄色)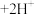 ,推测B试管中的实验现象为:
,推测B试管中的实验现象为:(3)该小组同学继续用酸性
 溶液和草酸(
溶液和草酸( )溶液进行实验,设计实验方案如表所示。请回答相关问题:
)溶液进行实验,设计实验方案如表所示。请回答相关问题:| 编号 | 温度℃ |  溶液 溶液 | 酸性 溶液 溶液 | ||
浓度/( ) ) | 体积/mL | 浓度/( ) ) | 体积/mL | ||
| a | 25 | 0.10 | 2.0 | 0.010 | 4.0 |
| b | 25 | 0.20 | 2.0 | 0.010 | 4.0 |
| c | 50 | 0.20 | 2.0 | 0.010 | 4.0 |
 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定②实验a、b、c所加的
 溶液均要过量。理由是
溶液均要过量。理由是③实验a和b是探究
④实验a和b起初反应均很慢,过了一会儿速率突然增大,可能原因是
您最近一年使用:0次
9 . 血红蛋白分子(Hb)在人体中存在如下过程:①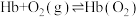
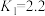 ;
;
②
 。下列说法错误的是
。下列说法错误的是
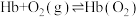
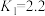 ;
;②

 。下列说法错误的是
。下列说法错误的是A.相比于 ,血红蛋白分子更易与CO结合 ,血红蛋白分子更易与CO结合 |
B.CO中毒时,需立即阻隔(或切断)CO源,使 变小 变小 |
| C.高原地区含氧量低,因此该地区人体内的Hb数量普遍较高 |
| D.CO中毒时,可将病人移入高压氧舱,使平衡②逆向移动 |
您最近一年使用:0次
2022-10-12更新
|
601次组卷
|
8卷引用:江西省重点校2022-2023学年高二上学期第一次月考化学试题
名校
10 . 下列事实中不能用勒夏特列原理解释的是
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.夏天喝碳酸饮料打开瓶盖大量气泡冒出 |
| C.实验室常用排饱和食盐水法收集氯气 |
| D.N2 + 3H2⇌2NH3 ΔH<0 工业上采用高温条件更有利于合成氨 |
您最近一年使用:0次
2022-10-10更新
|
245次组卷
|
3卷引用:江西省赣州市赣县第三中学2022-2023学年高二上学期9月月考化学试题



