名校
1 . 工业生产硫酸的一步重要反应是SO2在400℃到500℃下的催化氧化:2SO2(g)+O2(g) 2SO3(g) △H<0,如果反应在密闭容器中进行,下列有关说法不正确的是
2SO3(g) △H<0,如果反应在密闭容器中进行,下列有关说法不正确的是
 2SO3(g) △H<0,如果反应在密闭容器中进行,下列有关说法不正确的是
2SO3(g) △H<0,如果反应在密闭容器中进行,下列有关说法不正确的是| A.实际生产中选定400℃到500℃作为操作温度,其原因是在此温度下催化剂的活性最高 |
| B.使用催化剂可加快反应速率,SO3产率不变 |
| C.增大压强可以提高SO3产率,但高压对动力和设备要求太高,会增加生产成本 |
| D.其他条件保持不变,温度越高,速率越快,生产效益越好 |
您最近一年使用:0次
名校
2 . 下列能用勒夏特列原理解释的有几个
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②棕红色NO2加压后颜色先变深后变浅
③氯水宜保存在低温、避光条件下
④实验室用排饱和食盐水的方法收集氯气
⑤由H2(g)、I2(g)、HI(g)组成的平衡体系加压(缩小体积)后颜色变深
⑥合成氨时将氨液化分离,可提高原料的利用率
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②棕红色NO2加压后颜色先变深后变浅
③氯水宜保存在低温、避光条件下
④实验室用排饱和食盐水的方法收集氯气
⑤由H2(g)、I2(g)、HI(g)组成的平衡体系加压(缩小体积)后颜色变深
⑥合成氨时将氨液化分离,可提高原料的利用率
| A.6 | B.5 | C.4 | D.3 |
您最近一年使用:0次
2022-11-18更新
|
262次组卷
|
2卷引用:辽宁省六校协作体2022-2023学年高二上学期期中考试化学试题
名校
3 . 一定温度下,密闭容器中发生反应: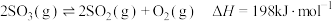 。当反应达到平衡后,下列各项措施不能提高SO3转化率的是
。当反应达到平衡后,下列各项措施不能提高SO3转化率的是
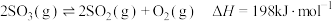 。当反应达到平衡后,下列各项措施不能提高SO3转化率的是
。当反应达到平衡后,下列各项措施不能提高SO3转化率的是| A.升高反应的温度 | B.增大容器的体积 |
| C.分离出部分氧气 | D.容积不变,通入气体He |
您最近一年使用:0次
2022-11-17更新
|
250次组卷
|
2卷引用:辽宁省沈阳市东北育才学校高中部2022-2023学年高二上学期第二次月考化学试题
名校
解题方法
4 . 下列实验目的对应的方案设计、现象和结论都正确的是
选项 | 实验目的 | 方案设计 | 现象和结论 |
A | 比较 | 向 | 白色沉淀转化为红褐色沉淀,证明 |
B | 探究压强对平衡移动的影响 | 密闭容器中盛 | 气体颜色加深,说明平衡向生成 |
C | 比较 | 向等体积饱和 | 得到沉淀 |
D | 比较 | 用 |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 下列有关反应原理的说法正确的是
A.反应 △H>0若能自发进行,其原因是△S>0 △H>0若能自发进行,其原因是△S>0 |
B.工业合成氨气 △H<0高温高压的条件都是为了提高平衡转化率 △H<0高温高压的条件都是为了提高平衡转化率 |
| C.向新制氯水中加适量石灰石不能增大溶液中的c平(HClO) |
| D.反应物分子间的碰撞都能使化学反应发生,碰撞越多,反应速率越高 |
您最近一年使用:0次
名校
6 . 对于可逆反应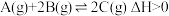 ,下列图像中正确的是
,下列图像中正确的是
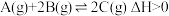 ,下列图像中正确的是
,下列图像中正确的是A.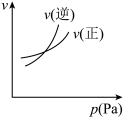 | B.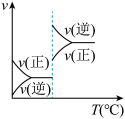 | C.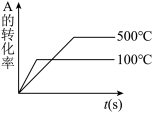 | D.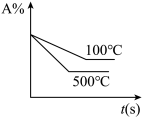 |
您最近一年使用:0次
2022-11-13更新
|
151次组卷
|
76卷引用:辽宁省庄河市高级中学2017-2018学年高二上学期开学考试化学试题
辽宁省庄河市高级中学2017-2018学年高二上学期开学考试化学试题(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2011-2012学年湖北省襄阳市四校高二上学期期中考试化学试卷(已下线)2011-2012学年四川省金堂中学高二下学期期中考试化学试卷 (已下线)2012-2013学年广东东莞第七高级中学高二上期中考试化学试卷(已下线)2013-2014学年广东省肇庆市高二上学期末考试化学试卷(已下线)2013-2014北京市房山区下学期高二期末测验化学试卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷(已下线)2014-2015学年吉林省汪清县第六中学高二上学期期中考试化学试卷2014-2015学年重庆复旦中学高二上学期期中化学试卷2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷2015-2016学年河南省鄢陵高级中学高二上学期第二次月考化学试卷2015-2016北京大学附中宇华教育集团高二12月化学卷2015-2016北京大学附中宇华教育集团高一12月化学卷2015-2016学年安徽省钱桥中学、泥河中学高二上12月联考化学试卷2015-2016学年安徽省六安一中高二上第一阶段测化学试卷2015-2016学年宁夏吴忠中学高二下开学考试化学试卷2015-2016学年贵州省大方一中高二上学期期末化学试卷2015-2016学年河北省邢台一中高一下期中化学试卷2015-2016学年广西南宁市二十六中高二下学期期中化学试卷2015-2016学年云南省云天化中学高二下期中理综化学试卷2016-2017学年浙江省温州中学高二上10月月考化学试卷2016-2017学年贵州省思南中学高二上半期考试化学卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷2016-2017学年西藏山南二中高二上学期期中化学试卷浙江省2018版考前特训(2017年10月)学考70快练:化学反应速率及反应限度吉林省长春外国语学校2017-2018学年高一上学期开学测试化学试题贵州省思南中学2017-2018学年高二上学期第一次月考化学试题甘肃省武威市第六中学2017-2018学年高二上学期第一次学段考试化学试题云南省德宏州芒市第一中学2017-2018学年高二上学期期中考试化学试题陕西省渭南市尚德中学2017-2018学年高二上学期期中考试化学试卷山东省枣庄市第三中学2017-2018学年高二第六学段学情调查(1月)化学试题贵州省毕节市实验高级中学2017-2018学年高二上学期期末考试化学试题安徽省滁州市民办高中2017-2018学年高一下学期第二次月考化学试题【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高一下学期期末考试化学试题云南省腾冲市第八中学2017-2018学年高二下学期期末考试化学试题广东省蓝精灵中学2018-2019学年高二上学期联考化学试题2017-2018学年鲁科版高二化学选修4第二章第一节化学反应的方向作业题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区伊宁市生产建设兵团四师一中2018-2019学年高二上学期期中考试化学试题吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题江苏省邗江中学2018-2019学年高二下学期期中考试化学试题甘肃省张掖市山丹县第一中学2017—2018学年高二上学期期末质量检测化学试题安徽省芜湖市城南实验中学2019-2020学年高二上学期期中考试化学试题湖南省常德市石门县第二中学2019-2020学年高二上学期第二次月考化学试题贵州省金沙中学2019年普通高中学生学业基础水平测试化学试题(已下线)【南昌新东方】江西省九江一中2014-2015学年高二上学期期中化学试卷河北省邢台市第二中学2019-2020学年高二下学期开学考试化学试题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(精练)-2021年高考化学一轮复习讲练测河南省安阳县第三高级中学2020-2021学年高二上学期第一次阶段考试化学试题广东省佛山市第一中学2020-2021学年高二上学期第一次段考化学(选考)试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题黑龙江省绥化地区肇东第四中学2020-2021学年高二上学期期末考试化学试题西藏日喀则市上海实验学校2019-2020学年高二上学期期末考试化学试题新疆维吾尔自治区呼图壁县第一中学2020-2021学年高二下学期期初考试化学试题江苏省宿迁市沭阳县潼阳中学2020-2021学年高二下学期第一次月考化学试题福建省南安市柳城中学2020-2021学年高二上学期第二次月考化学试题青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题新疆乌鲁木齐市第二十中学2020-2021学年高二上学期段考(期中)化学试题吉林省延边第二中学2020-2021学年高二上学期第一次考试月考化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期第一次月考化学试题广东省广州市北师大附中为明学校2021-2022学年高二10月月考化学试题河南省平顶山九校联盟2021-2022学年高二上学期期中考试化学试题广东省珠海市第二中学2021-2022学年高二上学期期中考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题黑龙江省饶河县高级中学2021-2022学年上学期期末考试化学试题湖北省部分高中联考协作体2022-2023学年高二上学期期中考试化学试题(已下线)第七章 化学反应速率与化学平衡 第44练 化学反应速率、平衡的常规图像河南省南阳市2022-2023学年高二下学期期末考试化学试题(已下线)第4讲 化学反应速率及平衡图像江西省南昌市第一中学2023-2024学年高二上学期10月月考化学试题浙江省湖州市吴兴高级中学2023-2024学年高二上学期10月阶段性测试化学试题浙江省杭州东方中学2023-2024学年高二上学期期中考试化学试题河南省郑州学森实验学校2023-2024学年高二上学期期中考试 化学试题广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
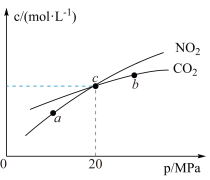
7 . 在恒温的密闭容器中,加入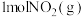 和足量活性炭发生反应
和足量活性炭发生反应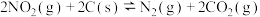 ,测得平衡时
,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示(
的物质的量浓度与平衡总压的关系如图所示( 为以分压表示的平衡常数,分压
为以分压表示的平衡常数,分压 总压
总压 物质的量分数)。下列说法错误的是
物质的量分数)。下列说法错误的是
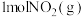 和足量活性炭发生反应
和足量活性炭发生反应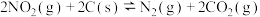 ,测得平衡时
,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示(
的物质的量浓度与平衡总压的关系如图所示( 为以分压表示的平衡常数,分压
为以分压表示的平衡常数,分压 总压
总压 物质的量分数)。下列说法错误的是
物质的量分数)。下列说法错误的是
A.图示的三个点中,a点 的转化率最高 的转化率最高 |
B.该温度下, 点的 点的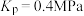 |
| C.减小容器体积可实现从c点到b点的移动 |
D.a、b、c三点的 大小相同 大小相同 |
您最近一年使用:0次
2022-11-12更新
|
343次组卷
|
12卷引用:辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期1月月考化学试题
辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期1月月考化学试题辽宁省抚顺市六校协作体2022-2023学年高二上学期期中考试化学试题辽宁省东北育才中学少儿部2023-2024学年高二上学期第一次月考化学试题湖南省部分学校2022-2023学年高二上学期期中考试化学试题江西省赣州市十六县(市)二十校2022-2023学年高二上学期期中联考化学试题河北省邢台市南和区第一中学2022-2023学年高二上学期期中考试化学试题江西省赣州市重点中学六校2022-2023学年高二上学期期中联考化学试题河北省部分学校2022-2023学年高二上学期期中考试化学试题湖北省部分学校2022-2023学年高二上学期期中考试化学试题河南省新乡市长垣市2022-2023学年高二上学期11月期中考试化学试题江西省宜春市上高二中2023-2024学年高二上学期第二次月考化学试题河南省获嘉县第一中学2023-2024学年高二上学期第一次月考化学试卷
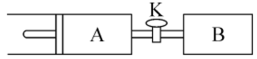
8 . 如图所示,向A、B中均充入 ,起始时A、B的体积都等于
,起始时A、B的体积都等于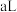 。在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生反应:
。在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生反应: 。达到平衡时,A的体积为
。达到平衡时,A的体积为 。下列说法不正确的是
。下列说法不正确的是
 ,起始时A、B的体积都等于
,起始时A、B的体积都等于 。在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生反应:
。在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生反应: 。达到平衡时,A的体积为
。达到平衡时,A的体积为 。下列说法不正确的是
。下列说法不正确的是
A.反应速率: | B.A容器中X的转化率为 |
| C.该反应是一个嫡增的反应 | D.平衡时Y的体积分数: |
您最近一年使用:0次
2022-11-11更新
|
147次组卷
|
2卷引用:辽宁省沈阳市重点高中联盟2022-2023学年高三上学期期中检测化学试题
9-10高二下·江西·期中
名校
9 . 有一处于平衡状态的反应:X(s)+3Y(g) 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
您最近一年使用:0次
2022-11-09更新
|
937次组卷
|
65卷引用:2013-2014学年辽宁省抚顺市六校联合体高一下学期期末考试化学试卷
(已下线)2013-2014学年辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(已下线)09~10年江西四校高二下学期期中联考化学卷(已下线)2011届黑龙江省哈六中高三上学期期中考试化学试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期末考试化学试卷(已下线)2012-2013学年黑龙江省庆安三中高二上学期期中考试化学试卷(已下线)2012-2013学年广东省广州六中高二上学期期末考试理科化学试卷(已下线)2014年高中化学人教版选修四模块质量检测练习卷(已下线)2014-2015学年河南周口市沈丘县县直高级中学高二上第一次月考化学2015-2016学年河北省望都中学高二上学期第二次月考化学试卷2015-2016学年甘肃省张掖二中高二上学期10月月考化学试卷2015-2016学年海南省嘉积中学高二上12月段考化学试卷2015-2016学年四川阆中中学校高二下第一次段考化学试卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷2015-2016学年甘肃省白银市靖远一中高二上期中化学试卷2016-2017学年湖南省长沙一中高一上月考三化学试卷天津市武清区2017-2018学年高二上学期期中考试化学试题河北省唐山一中2017-2018学年高二上学期期中考试化学试题山东省日照黄海高级中学2017-2018学年高二上学期期中考试(理)化学试题【全国百强校】内蒙古鄂尔多斯市第一中学2017-2018学年高一下学期期末考试化学试题2018-2019学年鲁科版高中化学选修四:第2章检测题山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】广东省汕头市金山中学2018-2019学年高二上学期10月月考化学试题【全国百强校】陕西省西安市第一中学2018-2019学年高二上学期10月月考化学试题湖北省利川市第五中学2018-2019学年高二上学期期中模拟考试化学试题广东省揭阳市揭西县河婆中学2018-2019学年高二上学期期末化学试题宁夏长庆高级中学2019-2020学年高二上学期第一次月考化学试题四川省北大附中成都为明学校2019-2020学年高二9月月考化学试题河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题山东省济南外国语学校三箭分校2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期中考试化学试题四川省自贡市田家炳中学2019-2020学年高二上学期期中考试化学试题河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题海南省海口市第四中学2019-2020学年高二上学期期末考试化学试题吉林省长春市第七中学2020-2021学年高二上学期第一次月考化学试题海南省琼山中学2019-2020学年高二上学期期末考试化学试题黑龙江省大庆中学2020-2021学年高二10月月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时2 反应条件对化学平衡的影响甘肃省庆阳市第六中学2020-2021学年高二上学期期中考试化学(理)试题广西壮族自治区贺州市平桂高级中学(贺州市第五高级中学)2020-2021学年高二上学期第一次月考化学试题浙江省台州市七校联盟2019-2020学年高二上学期期中联考化学试题重庆市沙坪坝区重庆市第七中学2020-2021高二上学期中考试化学试题宁夏海原第一中学2020-2021学年高二上学期第二次月考化学试题湖北省老河口市一中2020-2021学年高二12月阶段性考试化学试题广东省雷州市第二中学2020-2021学年高二上学期期中考试化学试题内蒙古自治区土默特左旗第三中学2020-2021学年高二上学期期末考试化学试题内蒙古集宁新世纪中学2020-2021学年高二上学期期中考试化学试题新疆阿克苏地区新和县实验中学2020-2021学年高二下学期期末考试化学试题广东省广州市北师大附中为明学校2021-2022学年高二10月月考化学试题云南省弥勒市第二中学2020-2021学年高二下学期期中考试化学试题(已下线)2.2.3 影响化学平衡的因素(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)广东省揭阳市惠来县第一中学2021-2022学年高二上学期第二次阶段考试化学试题内蒙古自治区第二地质中学2020-2021学年高二下学期第二次阶段检测化学试题河北省衡水市武强中学2021-2022学年高二上学期第三次月考化学试题(已下线)第二章 化学反应速率与化学平衡(A卷·知识通关练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)山东省潍坊瀚声学校2021-2022学年高一下学期4月月考化学试题福建省永安市第九中学2022-2023学年高二上学期期中考试化学(选考)试题黑龙江省哈尔滨市第一六二中学校2022-2023学年高二上学期第一次月考化学试题广东省揭阳普宁市普师高级中学2021-2022学年高二上学期期中考试化学试题天津市第八中学2021-2022学年高二上学期12月月考化学试题山东省滕州市第五中学2022-2023学年高一下学期5月月考化学试题陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题安徽省合肥市肥东县综合高中2022-2023学年高二上学期11月期中考试化学试题陕西省渭南市蒲城县蒲城中学2023-2024学年高二上学期期中考试化学试题天津市蓟州中学2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
10 . “碳中和”是指企业、团体或个人测算在一定时间内,直接或间接产生的温室气体排放总量,通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放,实现二氧化碳的“零排放”。简单地说,也就是让二氧化碳排放量“收支相抵”。利用CO2合成二甲醚在近年来深受人们的关注,可以很大程度地帮助实现“碳中和”,其合成过程由两种工艺组成。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
Ⅱ.逆水汽变换:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
请回答:
(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式为_______ 。
(2)向一绝热恒容密闭容器中充入等物质的量的CO2和H2进行反应Ⅱ,下面不能判断该反应已达到平衡状态的是_______ ;
A.混合气体的密度保持不变
B.总压强不变
C.平衡常数不变
D.容器中n(CO2)/n(H2O)的值保持不变
E.CO2和H2的体积比保持不变
(3)①工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

下列说法正确的是_______ 。
A.图甲纵坐标表示CH3OH的平衡产率
B.P1<P2<P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
②解释图乙不同压强下CO2的平衡转化率在550℃后趋于相等的原因_______ 。
(4)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应II,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
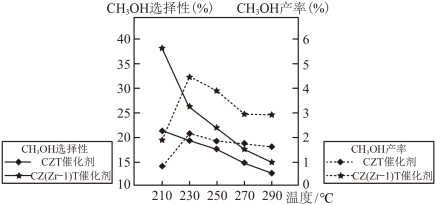
其中:CH3OH的选择性=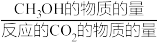 ×100%
×100%
在上述条件下合成甲醇的工业条件是_______。
(5)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应I和反应II,初始压强为p0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小20%。则达到平衡时H2的转化率为_______ ,反应II的平衡常数K=_______ (保留两位有效数字)。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1Ⅱ.逆水汽变换:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
请回答:
(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式为
(2)向一绝热恒容密闭容器中充入等物质的量的CO2和H2进行反应Ⅱ,下面不能判断该反应已达到平衡状态的是
A.混合气体的密度保持不变
B.总压强不变
C.平衡常数不变
D.容器中n(CO2)/n(H2O)的值保持不变
E.CO2和H2的体积比保持不变
(3)①工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

下列说法正确的是
A.图甲纵坐标表示CH3OH的平衡产率
B.P1<P2<P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
②解释图乙不同压强下CO2的平衡转化率在550℃后趋于相等的原因
(4)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应II,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。

其中:CH3OH的选择性=
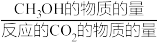 ×100%
×100%在上述条件下合成甲醇的工业条件是_______。
| A.210℃ | B.230℃ | C.催化CZT | D.催化剂CZ(Zr-1)T |
您最近一年使用:0次
2022-11-05更新
|
404次组卷
|
3卷引用:辽宁省朝阳市部分学校2022-2023学年高二下学期期末考试化学试题

 和
和 的
的 相对大小
相对大小 的
的 溶液中滴加
溶液中滴加 的
的 溶液,再滴加
溶液,再滴加 溶液
溶液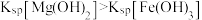
 ,一段时间后反应达平衡,压缩体积至原来的一半
,一段时间后反应达平衡,压缩体积至原来的一半 和
和 的
的 溶液
溶液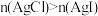 ,则
,则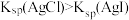
 与
与 的酸性
的酸性 计测定
计测定 溶液②
溶液② 溶液
溶液

