解题方法
1 . A:一定条件下,某可逆反应在密闭容器中建立化学平衡,在 时刻改变某一个条件,建立新的平衡,其
时刻改变某一个条件,建立新的平衡,其 图像如下:
图像如下:
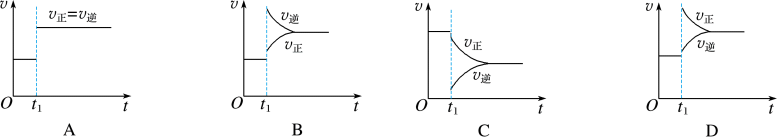
(1)对于反应: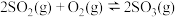 ,
, 时刻缩小容器体积,其图像为
时刻缩小容器体积,其图像为___________ (填字母,下同),平衡___________ (填“向正反应方向”“向逆反应方向”或“不”,下同)移动。
(2)对于反应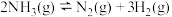 ,
, 时刻增大容器体积,其图像为
时刻增大容器体积,其图像为___________ ,平衡___________ 移动。
(3)对于反应 ,
, 时刻缩小容器体积,其图像为
时刻缩小容器体积,其图像为___________ ,平衡___________ 移动。
B:可逆反应 在不同温度(和)及压强(和)下,产生Z的物质的量n和反应时间t的关系如图所示,根据图像回答下列问题:
在不同温度(和)及压强(和)下,产生Z的物质的量n和反应时间t的关系如图所示,根据图像回答下列问题:
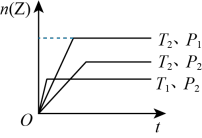
(4)温度 和
和 的关系为
的关系为
___________ (填“>”、“<”或“=”,下同) ,压强
,压强 和
和 的关系为
的关系为
___________  。
。
(5)a___________ 1。
(6)该反应的正反应为___________ (填“吸热”或“放热”反应)。
 时刻改变某一个条件,建立新的平衡,其
时刻改变某一个条件,建立新的平衡,其 图像如下:
图像如下:
(1)对于反应:
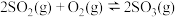 ,
, 时刻缩小容器体积,其图像为
时刻缩小容器体积,其图像为(2)对于反应
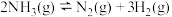 ,
, 时刻增大容器体积,其图像为
时刻增大容器体积,其图像为(3)对于反应
 ,
, 时刻缩小容器体积,其图像为
时刻缩小容器体积,其图像为B:可逆反应
 在不同温度(和)及压强(和)下,产生Z的物质的量n和反应时间t的关系如图所示,根据图像回答下列问题:
在不同温度(和)及压强(和)下,产生Z的物质的量n和反应时间t的关系如图所示,根据图像回答下列问题: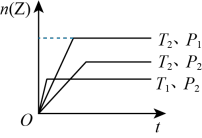
(4)温度
 和
和 的关系为
的关系为
 ,压强
,压强 和
和 的关系为
的关系为
 。
。(5)a
(6)该反应的正反应为
您最近半年使用:0次
2 . 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
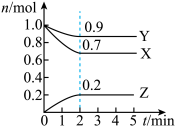
(1)该反应的化学方程式为___________ 。
(2)反应开始至2min,气体Z的平均反应速率为___________ 。
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的___________ 倍;
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为___________ 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时___________ (填增大、减小或相等)。

(1)该反应的化学方程式为
(2)反应开始至2min,气体Z的平均反应速率为
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为
您最近半年使用:0次
名校
3 . 化学反应通过改变条件可以调控反应速率及反应限度,工业合成氨反应
 ,在400-500℃、10MPa-30MPa、铁触媒为催化剂条件下,实现了氨的高效生产。以合成氨为情境,完成下列填空:
,在400-500℃、10MPa-30MPa、铁触媒为催化剂条件下,实现了氨的高效生产。以合成氨为情境,完成下列填空:
(1)其他条件不变的情况下,缩小容器体积以增大反应体系的压强,逆反应速率v逆___________ (选填“增大”、“减小”、“不变”),平衡___________ 移动(选填“向正反应方向”、“向逆反应方向”、“不影响”)。
(2)其他条件不变的情况下,高温条件下___________ (选填“有利”、“不利”)平衡向正反应方向移动。
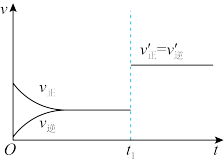
(3)如图为反应速率(v)与时间(t)关系的示意图,由图判断,在 时刻曲线发生变化后,平衡混合物中
时刻曲线发生变化后,平衡混合物中 的百分含量
的百分含量___________ (选填“增大”、“减小”、“不变”)。
(4)若达到平衡时, 、
、 、
、 的物质的量分别为2mol、2mol、1mol。保持温度不变,再充入
的物质的量分别为2mol、2mol、1mol。保持温度不变,再充入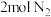 、
、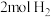 、
、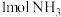 ,则平衡
,则平衡___________ 移动(选填“向正反应方向”、“向逆反应方向”、“不影响”)

 ,在400-500℃、10MPa-30MPa、铁触媒为催化剂条件下,实现了氨的高效生产。以合成氨为情境,完成下列填空:
,在400-500℃、10MPa-30MPa、铁触媒为催化剂条件下,实现了氨的高效生产。以合成氨为情境,完成下列填空:(1)其他条件不变的情况下,缩小容器体积以增大反应体系的压强,逆反应速率v逆
(2)其他条件不变的情况下,高温条件下
(3)如图为反应速率(v)与时间(t)关系的示意图,由图判断,在
 时刻曲线发生变化后,平衡混合物中
时刻曲线发生变化后,平衡混合物中 的百分含量
的百分含量
(4)若达到平衡时,
 、
、 、
、 的物质的量分别为2mol、2mol、1mol。保持温度不变,再充入
的物质的量分别为2mol、2mol、1mol。保持温度不变,再充入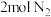 、
、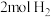 、
、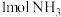 ,则平衡
,则平衡
您最近半年使用:0次
名校
4 . 2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。已知:3H2(g)+CO2(g)⇌CH3OH(g)+H2O(g) ΔH=-48.9kJ/mol
(1)为提高CH3OH转化率,理论上应采用的条件是________ (填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[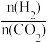 ]时某反应物X平衡转化率变化曲线。
]时某反应物X平衡转化率变化曲线。
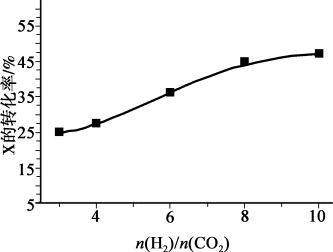
反应物X是_________ (填“CO2”或“H2”),理由是_________ 。
(3)250℃、在体积为2.0L的恒容密闭容器中加入6molH2、2molCO2和催化剂,10min时反应达到平衡,测得n(CH3OH)=1.5mol,这段时间内H2的平均速率为______ ,化学平衡常数K=___ 。
(1)为提高CH3OH转化率,理论上应采用的条件是
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[
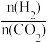 ]时某反应物X平衡转化率变化曲线。
]时某反应物X平衡转化率变化曲线。
反应物X是
(3)250℃、在体积为2.0L的恒容密闭容器中加入6molH2、2molCO2和催化剂,10min时反应达到平衡,测得n(CH3OH)=1.5mol,这段时间内H2的平均速率为
您最近半年使用:0次
名校
解题方法
5 . 在恒容的密闭容器内,使1 mol N2和3 mol H2混合发生下列反应:3H2(g)+N2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
(1)升高温度时,混合气体的密度____ (填“增大”“减小”或“不变”,下同),N2的转化率________ 。
(2)当达到平衡时,充入N2,平衡将____ (填“正向”“逆向”或“不”,下同)移动。
(3)当达到平衡时,充入Ar,平衡将____ 移动。
(4)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将____ 移动。
 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。(1)升高温度时,混合气体的密度
(2)当达到平衡时,充入N2,平衡将
(3)当达到平衡时,充入Ar,平衡将
(4)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将
您最近半年使用:0次
名校
解题方法
6 . 工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%)。
(1)SO2的氧化反应是___ 反应(填“吸热”或“放热”)。
(2)根据图中所给信息,你认为工业上将SO2转化为SO3的适宜条件是___ 。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?___ (填“是”或“否”)。
(4)若保持温度和容积不变,平衡后通入氧气,再达平衡时则SO2浓度___ 。(填“增大”或“减小”)
(5)若保持温度和压强不变,平衡后通入He气,SO3的含量___ 。(填“增大”或“减小”)
 | 0.1个大气压 | 0.5个大气压 | 1个大气压 | 10个大气压 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(2)根据图中所给信息,你认为工业上将SO2转化为SO3的适宜条件是
(3)选择适宜的催化剂,是否可以提高SO2的转化率?
(4)若保持温度和容积不变,平衡后通入氧气,再达平衡时则SO2浓度
(5)若保持温度和压强不变,平衡后通入He气,SO3的含量
您最近半年使用:0次
2020-01-17更新
|
136次组卷
|
2卷引用:海南省海南中学2019-2020学年高二上学期期末考试化学试题
真题
7 . 溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入_______ ,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO ,其离子方程式为
,其离子方程式为_______ 。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中,_______ 显正电性。BrCl与水发生反应的化学方程式为_______ 。
(3)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+ Br2(g) ∆H=+105.4kJ/mol在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会_______ (填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为_______ 。
(1)海水提溴过程中,向浓缩的海水中通入
 ,其离子方程式为
,其离子方程式为(2)溴与氯能以共价键结合形成BrCl。BrCl分子中,
(3)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+ Br2(g) ∆H=+105.4kJ/mol在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为
您最近半年使用:0次
2019-01-30更新
|
1453次组卷
|
4卷引用:2013年全国普通高等学校招生统一考试化学(海南卷)



