解题方法
1 . 在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
(1)该反应为_______ (填“吸热”或“放热”)反应。
(2)当反应达到平衡时,N2和H2的浓度比是_______ ;N2和H2的转化率之比是_______ 。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_______ ,密度_______ 。(填“增大”“减小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将_______ (填“正向”“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_______ (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_______ (填“大于”“小于”或“等于”)原来的2倍。
 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。(1)该反应为
(2)当反应达到平衡时,N2和H2的浓度比是
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将
您最近半年使用:0次
名校
解题方法
2 . 在一定条件下,可逆反应mA+nB pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡正向移动,则m+n和p的关系是___ 。
(2)A、C是气体,增加B的量,平衡不移动,则B为___ 。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是___ 。
(4)加热后,可使 的质量增加,则正反应是
的质量增加,则正反应是___ (填“放热”或“吸热”)反应。
 pC达到平衡,若:
pC达到平衡,若:(1)A、B、C都是气体,减小压强,平衡正向移动,则m+n和p的关系是
(2)A、C是气体,增加B的量,平衡不移动,则B为
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是
(4)加热后,可使
 的质量增加,则正反应是
的质量增加,则正反应是
您最近半年使用:0次
2021-10-24更新
|
108次组卷
|
31卷引用:西藏自治区拉萨市第二高级中学2019-2020学年高二上学期期末考试化学试题
西藏自治区拉萨市第二高级中学2019-2020学年高二上学期期末考试化学试题(已下线)09~10年鹤岗一中高一下学期期末考试化学卷(已下线)2010年江苏省启东中学高二上学期期中考试化学卷(已下线)2010-2011学年广东省深圳高级中学高二下学期期中考试化学试卷(已下线)2010-2011学年江苏省启东中学高二上学期期中考试化学试题(理)(已下线)2011-2012年河北省南宫中学高二上学期9月份月考化学(理)试卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高二上学期期末考试化学试卷(已下线)2011-2012年安徽红星中安工大附中高二下学期期中联考理科化学试卷(已下线)2011-2012学年广东始兴县风度中学高二下学期期中考试理综化学试卷(已下线)2011-2012学年广东省始兴县风度中学高二下学期期末考试理综化学卷(已下线)2012-2013学年甘肃省兰州一中高二上学期期末考试化学试卷(已下线)2012-2013学年山东省临沂市高二上学期期中考试化学试卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷2014-2015学年天津市宝坻区四校高二11月联考化学试卷2014-2015学年辽宁实验分校高一下6月阶段测试化学试卷2015-2016学年陕西省西安一中高二上10月月考化学试卷2015-2016学年湖南省株洲十八中高二上学期期中(理)化学试卷2015-2016学年天津市和平区高二上学期期末考试化学试卷2015-2016学年湖南省怀化市会同三中高二上12月月考化学试卷2016-2017学年吉林省汪清六中高二上第一次月考化学试卷内蒙古阿拉善左旗高级中学2017-2018学年高二上学期期末考试化学试题甘肃省武威第五中学2017-2018学年高二下学期第二次月考化学试题甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题黑龙江省齐齐哈尔市龙江二中2019-2020学年高二12月月考化学试题湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期9月月考化学试题河北省衡水市武邑武罗学校2020-2021学年高二上学期期中考试化学试题黑龙江省绥化市望奎县第一中学2021-2022学年高二上学期第一次月考化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题甘肃省兰州市西固区三校2021-2022学年高二上学期期中联考化学(理科)试题陕西省汉滨区五里高级中学2022-2023学年高二上学期期中考试化学试题河南省许昌市鄢陵县职业教育中心2021-2022学年高二上学期第一次月考化学试题
名校
3 . 在一定条件下,xA+yB⇌zC的反应达到平衡.
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是___ 。
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则向____ 移动.(填“正向”、“逆向”、“无法判断”)
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是_____ 态.(填“气”、“液”、“固”)
(4)加热后C的质量分数减少,则正反应是_____ 热反应。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则向
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是
(4)加热后C的质量分数减少,则正反应是
您最近半年使用:0次
2021-01-09更新
|
146次组卷
|
5卷引用:西藏拉萨市第二高级中学2019-2020学年高二上学期期中考试化学试题
4 . 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___ 。
(2)该反应为__ 反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为__ 。
(4)若830℃时,向容器中充入1molCO、5molH2O,反应达到平衡后,则其化学平衡常数K__ 1.0(选填“大于”、“小于”或“等于”)。
(5)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。试用平衡常数判断平衡___ 移动(填“发生”或“不发生”)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为
(4)若830℃时,向容器中充入1molCO、5molH2O,反应达到平衡后,则其化学平衡常数K
(5)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。试用平衡常数判断平衡
您最近半年使用:0次
名校
5 . 在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g) CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
(1)K的表达式为:___ ;
(2)该反应的正反应为__ 反应(“吸热”或“放热”);
(3)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
此时上述的反应中正、逆反应速率的关系式是__ (填代号)。
A.υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
(4)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率___ (“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因___ 。
 CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
CO(g) +H2O(g)其平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:
(2)该反应的正反应为
(3)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是
A.υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
(4)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率
您最近半年使用:0次
2019-11-15更新
|
75次组卷
|
3卷引用:西藏自治区日喀则市第二高级中学2020-2021学年高二上学期期中考试化学试题
名校
6 . 以天然气代替石油生产液体燃料和基础化学品是当前化学研究和发展的重点。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y的相对分子质量分别为78,其一氯代物有1种。有关化学键键能数据如表中所示:
写出甲烷一步生成乙烯的热化学方程式______________________ ,反应中硅化物晶格限域的单中心铁催化剂的作用是___________________________ ;
(2)如图为乙烯气相直接水合法制备乙醇中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1)。
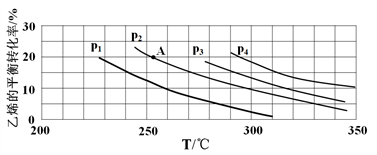
①若p2=8.0 MPa,计算A点的平衡常数Kp=____________ (用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位不写单位);
②该反应为___________ (填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为_____________ ,理由是_______________________ ;
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9 MPa,n(H2O):n(C2H4)=0.6:1。乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_______________ (任写两条)。
(3)乙烯可以作为燃料电池的负极燃料,请写出以熔融碳酸盐作为电解质时,负极的电极反应式_____________________________________ 。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y的相对分子质量分别为78,其一氯代物有1种。有关化学键键能数据如表中所示:
化学键 | H-H | C=C | C-C | C≡C | C-H |
E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
写出甲烷一步生成乙烯的热化学方程式
(2)如图为乙烯气相直接水合法制备乙醇中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1)。

①若p2=8.0 MPa,计算A点的平衡常数Kp=
②该反应为
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9 MPa,n(H2O):n(C2H4)=0.6:1。乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有
(3)乙烯可以作为燃料电池的负极燃料,请写出以熔融碳酸盐作为电解质时,负极的电极反应式
您最近半年使用:0次



