名校
1 . 研究 之间的转化具有重要意义。
之间的转化具有重要意义。
已知:

将一定量 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为 。
。
(1)下列可以作为反应达到平衡的判据是___________(填编号)。
(2)反应温度 时,体系中
时,体系中 、
、 随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为
随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为 ,
, 随t(时间)变化曲线如图虚线所示。
随t(时间)变化曲线如图虚线所示。
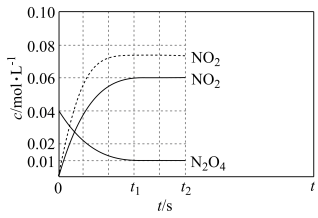
①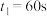 ,在0~60s时段,反应速率
,在0~60s时段,反应速率 为
为___________ 
②反应温度为
___________ (填“大于”或“小于”) 。
。
③温度 时反应达平衡后,将反应容器的容积减少一半,平衡向
时反应达平衡后,将反应容器的容积减少一半,平衡向___________ (填“正反应”或“逆反应”)方向移动。
④ 时刻反应达到平衡,混合气体平衡总压强为p,
时刻反应达到平衡,混合气体平衡总压强为p, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应 的平衡常数
的平衡常数
___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)NO氧化反应: 分两步进行,其反应过程能量变化示意图如图。
分两步进行,其反应过程能量变化示意图如图。
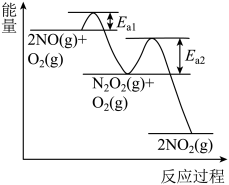
Ⅰ.

Ⅱ.

决定NO氧化反应速率的步骤是___________ (填“Ⅰ”或“Ⅱ”)。
 之间的转化具有重要意义。
之间的转化具有重要意义。已知:


将一定量
 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为 。
。(1)下列可以作为反应达到平衡的判据是___________(填编号)。
| A.气体的压强不变 | B. |
| C.K不变 | D.容器内颜色不变 |
(2)反应温度
 时,体系中
时,体系中 、
、 随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为
随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为 ,
, 随t(时间)变化曲线如图虚线所示。
随t(时间)变化曲线如图虚线所示。
①
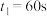 ,在0~60s时段,反应速率
,在0~60s时段,反应速率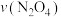 为
为
②反应温度为

 。
。③温度
 时反应达平衡后,将反应容器的容积减少一半,平衡向
时反应达平衡后,将反应容器的容积减少一半,平衡向④
 时刻反应达到平衡,混合气体平衡总压强为p,
时刻反应达到平衡,混合气体平衡总压强为p, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应 的平衡常数
的平衡常数
(3)NO氧化反应:
 分两步进行,其反应过程能量变化示意图如图。
分两步进行,其反应过程能量变化示意图如图。
Ⅰ.


Ⅱ.


决定NO氧化反应速率的步骤是
您最近半年使用:0次
名校
2 . 氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ•mol-1。
2NH3(g) △H=-92.4kJ•mol-1。
(1)在密闭容器中,投入1molN2和3molH2在催化剂作用下发生反应,测得反应放出的热量_______ 92.4kJ(填“小于”、“大于”或“等于”)。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_______ (填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_______ (填“正向”、“逆向”或“不移动”)。
(4)若容器恒容绝热,加热使容器内温度迅速升至原来的2倍,平衡将_______ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________ (填“大于”、“小于”或“等于”)原来的2倍。
(5)若该反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。
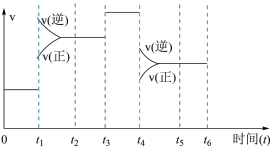
t1、t3、t4时刻体系中反应条件分别发生了什么变化?
t1:________ 。
t3:________ 。
t4:________ 。
 2NH3(g) △H=-92.4kJ•mol-1。
2NH3(g) △H=-92.4kJ•mol-1。(1)在密闭容器中,投入1molN2和3molH2在催化剂作用下发生反应,测得反应放出的热量
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将
(4)若容器恒容绝热,加热使容器内温度迅速升至原来的2倍,平衡将
(5)若该反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。

t1、t3、t4时刻体系中反应条件分别发生了什么变化?
t1:
t3:
t4:
您最近半年使用:0次
名校
3 . 工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。
反应1: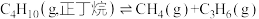

反应2: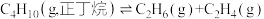

已知几种共价键的键能如下表:
(1)根据上述数据估算, =
=_______ kJ·mol-1。
(2)正丁烷和异丁烷之间转化的能量变化如图所示。
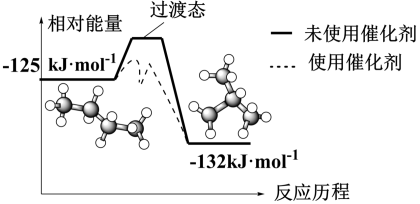
①正丁烷气体转化成异丁烷气体的热化学方程式为_______ 。
②下列有关催化剂的叙述错误的是_______ (填标号)。
A.能改变反应途径 B.能降低反应焓变
C.能加快反应速率 D.能增大平衡常数
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率(α)与压强(p)、温度(T)的关系如图所示。
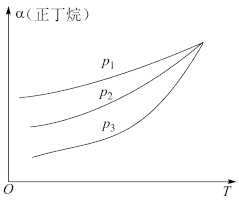
① 、
、 、
、 由小到大的顺序为
由小到大的顺序为_______ 。
②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是_______ 。
(4)在一定温度下,向密闭容器中投入正丁烷,同时发生反应1和反应2。测得部分物质的浓度与时间的关系如图,平衡时压强为17akPa。
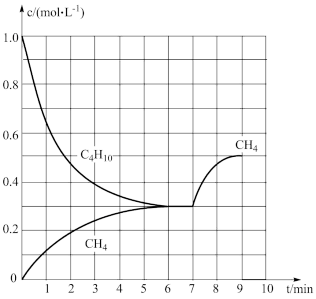
①7min时改变的条件可能是_______ (填标号)。
A.增大压强 B.增大正丁烷的浓度 C.加入催化剂
②该温度下,反应1的平衡常数
_______ kPa。(提示:组分分压=总压×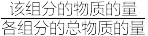 )
)
(5)以惰性材料为电极,正丁烷、空气在熔融盐(以MCO3为电解质)中构成的燃料电池的能量转化率高,通入空气的电极为_______ (填“正极”或“负极”)。
反应1:
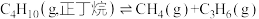

反应2:
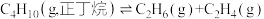

已知几种共价键的键能如下表:
| 共价键 | C—H |  | C—C |
| 键能/(kJ·mol-1) | 413 | 614 | 347 |
(1)根据上述数据估算,
 =
=(2)正丁烷和异丁烷之间转化的能量变化如图所示。

①正丁烷气体转化成异丁烷气体的热化学方程式为
②下列有关催化剂的叙述错误的是
A.能改变反应途径 B.能降低反应焓变
C.能加快反应速率 D.能增大平衡常数
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率(α)与压强(p)、温度(T)的关系如图所示。

①
 、
、 、
、 由小到大的顺序为
由小到大的顺序为②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是
(4)在一定温度下,向密闭容器中投入正丁烷,同时发生反应1和反应2。测得部分物质的浓度与时间的关系如图,平衡时压强为17akPa。

①7min时改变的条件可能是
A.增大压强 B.增大正丁烷的浓度 C.加入催化剂
②该温度下,反应1的平衡常数

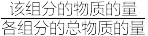 )
)(5)以惰性材料为电极,正丁烷、空气在熔融盐(以MCO3为电解质)中构成的燃料电池的能量转化率高,通入空气的电极为
您最近半年使用:0次
2021-12-03更新
|
884次组卷
|
10卷引用:广东省2021-2022学年高三11月联考化学试题
广东省2021-2022学年高三11月联考化学试题广东省韶关市2021-2022学年高三上学期期中考试化学试题河南省名校联盟2021-2022学年高三上学期11月联考化学试题湖南省百所学校大联考2021-2022学年高三11月联考化学试题(已下线)第19周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)押新高考卷17题 化学反应原理综合题-备战2022年高考化学临考题号押题(新高考通版)辽宁省抚顺市第二中学2022届高三下学期高考预测化学试题浙江省舟山市普陀中学2023届高三返校考试化学试题河北省保定市部分学校2021-2022学年高三上学期期中考试化学试题(已下线)专题十 化学能与热能-实战高考·二轮复习核心突破
9-10高一下·黑龙江鹤岗·期末
名校
解题方法
4 . 在一定条件下,可逆反应mA+nB pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡正向移动,则m+n和p的关系是___ 。
(2)A、C是气体,增加B的量,平衡不移动,则B为___ 。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是___ 。
(4)加热后,可使 的质量增加,则正反应是
的质量增加,则正反应是___ (填“放热”或“吸热”)反应。
 pC达到平衡,若:
pC达到平衡,若:(1)A、B、C都是气体,减小压强,平衡正向移动,则m+n和p的关系是
(2)A、C是气体,增加B的量,平衡不移动,则B为
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是
(4)加热后,可使
 的质量增加,则正反应是
的质量增加,则正反应是
您最近半年使用:0次
2021-10-24更新
|
108次组卷
|
31卷引用:2010-2011学年广东省深圳高级中学高二下学期期中考试化学试卷
(已下线)2010-2011学年广东省深圳高级中学高二下学期期中考试化学试卷(已下线)2011-2012学年广东始兴县风度中学高二下学期期中考试理综化学试卷(已下线)2011-2012学年广东省始兴县风度中学高二下学期期末考试理综化学卷(已下线)09~10年鹤岗一中高一下学期期末考试化学卷(已下线)2010年江苏省启东中学高二上学期期中考试化学卷(已下线)2010-2011学年江苏省启东中学高二上学期期中考试化学试题(理)(已下线)2011-2012年河北省南宫中学高二上学期9月份月考化学(理)试卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高二上学期期末考试化学试卷(已下线)2011-2012年安徽红星中安工大附中高二下学期期中联考理科化学试卷(已下线)2012-2013学年甘肃省兰州一中高二上学期期末考试化学试卷(已下线)2012-2013学年山东省临沂市高二上学期期中考试化学试卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷2014-2015学年天津市宝坻区四校高二11月联考化学试卷2014-2015学年辽宁实验分校高一下6月阶段测试化学试卷2015-2016学年陕西省西安一中高二上10月月考化学试卷2015-2016学年湖南省株洲十八中高二上学期期中(理)化学试卷2015-2016学年天津市和平区高二上学期期末考试化学试卷2015-2016学年湖南省怀化市会同三中高二上12月月考化学试卷2016-2017学年吉林省汪清六中高二上第一次月考化学试卷内蒙古阿拉善左旗高级中学2017-2018学年高二上学期期末考试化学试题甘肃省武威第五中学2017-2018学年高二下学期第二次月考化学试题甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题黑龙江省齐齐哈尔市龙江二中2019-2020学年高二12月月考化学试题湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期9月月考化学试题西藏自治区拉萨市第二高级中学2019-2020学年高二上学期期末考试化学试题河北省衡水市武邑武罗学校2020-2021学年高二上学期期中考试化学试题黑龙江省绥化市望奎县第一中学2021-2022学年高二上学期第一次月考化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题甘肃省兰州市西固区三校2021-2022学年高二上学期期中联考化学(理科)试题陕西省汉滨区五里高级中学2022-2023学年高二上学期期中考试化学试题河南省许昌市鄢陵县职业教育中心2021-2022学年高二上学期第一次月考化学试题
名校
5 . 在一定条件下,xA+yB⇌zC的反应达到平衡.
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是___ 。
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则向____ 移动.(填“正向”、“逆向”、“无法判断”)
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是_____ 态.(填“气”、“液”、“固”)
(4)加热后C的质量分数减少,则正反应是_____ 热反应。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则向
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是
(4)加热后C的质量分数减少,则正反应是
您最近半年使用:0次
2021-01-09更新
|
146次组卷
|
5卷引用:2015-2016学年广东省清远市第一中学高二上学期10月月考化学试卷
名校
解题方法
6 . 现有反应mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)若加入B(容器体积不变),则A的转化率______ (填增大、减小或不变,下同),B的转化率______ 。
(2)若升高温度,则平衡时B、C的浓度之比c(B)/c(C)将______ (填增大、减小或不变)。
(3)若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色________ (填变深、变浅或不变,下同),而维持容器内压强不变,充入Ne时,混合物的颜色_________ 。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)若加入B(容器体积不变),则A的转化率
(2)若升高温度,则平衡时B、C的浓度之比c(B)/c(C)将
(3)若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色
您最近半年使用:0次
名校
7 . 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g) CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__ ;根据图,升高温度,K值将__ (填“增大”、“减小”或“不变”)。
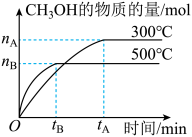
(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__ (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__ (填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是____ 。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时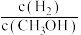 减小
减小
 CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。(1)该反应的平衡常数表达式K=

(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是
(3)判断该可逆反应达到化学平衡状态的标志是
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的
 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时
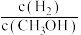 减小
减小
您最近半年使用:0次
2019-11-26更新
|
642次组卷
|
22卷引用:2017届广东省韶关市六校高三上10月联考化学试卷
2017届广东省韶关市六校高三上10月联考化学试卷2015-2016学年湖南省常德一中高二上学期期末理化学试卷辽宁省瓦房店市高级中学2016-2017学年高一6月基础知识竞赛化学试题山西省朔州市第一中学2017-2018学年高二8月月考化学试题2018-2019学年鲁科版高中化学选修四:第2章检测题山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】内蒙古集宁一中(西校区)2018-2019学年高二上学期第一次月考理科综合化学试题山东省济宁市邹城市兖矿第一中学2018-2019学年高二上学期期中模拟考化学试题新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题山东省济南外国语学校三箭分校2019-2020学年高二上学期期中考试化学试题重庆市北碚区2019-2020学年高二11月联合性测试化学试题福建省建瓯市芝华中学2019-2020学年高二上学期期中考试化学(1-2班)试题内蒙古自治区通辽市开鲁县第一中学2019-2020学年高一下学期期末考试化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学试题(普通版)(已下线)第10单元 化学反应速率与化学平衡(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河南省安阳县第三高级中学2020-2021学年高二上学期第一次阶段考试化学试题四川省苍溪实验中学校2020-2021学年高二上学期期中质量检测化学试题湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题安徽省安庆市九一六学校2020-2021学年高二3月月考化学试题四川省广元市八二一中学2021-2022学年高二上学期期中考试化学试题新疆疏勒县实验学校2021-2022学年高二上学期期末考试化学试题陕西省渭南市华州区咸林中学2023-2024学年高二上学期第二次月考化学试卷
名校
解题方法
8 . 在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),2min末反应达到平衡状态,此时测得D、C的浓度均为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,此时测得D、C的浓度均为0.4mol/L,请填写下列空白:
(1)x值等于_____________ 。
(2)A的转化率为_______________ 。
(3)生成D的反应速率为_____________ 。
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________ (增大、减小或不变)。
(5)在此温度下,该化学反应的平衡常数k=__________
 xC(g)+2D(g),2min末反应达到平衡状态,此时测得D、C的浓度均为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,此时测得D、C的浓度均为0.4mol/L,请填写下列空白:(1)x值等于
(2)A的转化率为
(3)生成D的反应速率为
(4)如果增大反应体系的压强,则平衡体系中C的质量分数
(5)在此温度下,该化学反应的平衡常数k=
您最近半年使用:0次
名校
9 . 工业上可利用“甲烷蒸气转化法”生产氢气,反应的热化学方程式为CH4(g)+H2O(g)⇌CO2(g)+3H2(g) △H=+161.1kJ·mol-1
(1)已知温度、压强对甲烷平衡时的体积分数的影响如图1,请回答:
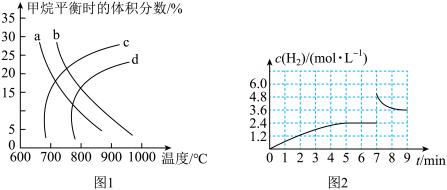
①图1中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷体积分数的曲线,其中表示1MPa的是_____ 。
②该反应的平衡常数:K(600℃)___ (填“>”“<”或“=”)K(700℃)。
(2)①已知:在700℃、1MPa时,1molCH4与1molH2O在1L的密闭容器中反应,6min时达到平衡(如图2),此时CH4的转化率为__ ,该温度下反应的平衡常数为____ (结果保留小数点后一位数字)。
②从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是____ (填“向正反应方向”或“向逆反应方向”)移动,采取的措施可能是____ 。
(1)已知温度、压强对甲烷平衡时的体积分数的影响如图1,请回答:

①图1中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷体积分数的曲线,其中表示1MPa的是
②该反应的平衡常数:K(600℃)
(2)①已知:在700℃、1MPa时,1molCH4与1molH2O在1L的密闭容器中反应,6min时达到平衡(如图2),此时CH4的转化率为
②从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是
您最近半年使用:0次
2019-06-11更新
|
412次组卷
|
3卷引用:广东省中山市第一中学2018-2019学年高二上学期第一次段考化学试题
10 . 已知SO3分解反应为2SO3(g)⇌2SO2(g)+O2(g)。在1.0L密闭容器中加入10mol SO3(g),在一定温度进行上述反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)欲提高SO3的平衡转化率,应采取的措施为_____ (填字母)。
a.增大压强 b.通入SO3 c.降低压强
(2)平衡时SO3的转化率为_____ ,该温度下的平衡常数Kw=_____
(3)研究表明,SO3(g)分解速率v=4×10﹣3×pSO3(kPa•min﹣1),t=6h时,测得体系中pO2=55kPa,则此时的pSO3=_____ kPa,v(SO3)=_____ kPa•min﹣1。
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/kPa | 400 | 412 | 422 | 440 | 469 | 518 | 538 | 560 | 560 |
回答下列问题:
(1)欲提高SO3的平衡转化率,应采取的措施为
a.增大压强 b.通入SO3 c.降低压强
(2)平衡时SO3的转化率为
(3)研究表明,SO3(g)分解速率v=4×10﹣3×pSO3(kPa•min﹣1),t=6h时,测得体系中pO2=55kPa,则此时的pSO3=
您最近半年使用:0次



