1 . 请参考题中图表,已知E1=134kJ•mol﹣1、E2=368kJ•mol﹣1,根据要求回答下列问题:
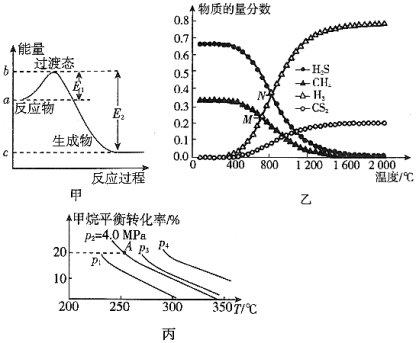
(1)图甲是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:___________ 。
(2)在一2L密闭容器中,起始时向该容器中充入H2S和CH4,n(H2S):n(CH4)=2:1,起始的n(CH4)=3mol,发生反应:CH4(g)+2H2S(g) CS2(g)+4H2(g)。温度变化对平衡时产物的物质的量分数的影响如图乙所示,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是
CS2(g)+4H2(g)。温度变化对平衡时产物的物质的量分数的影响如图乙所示,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是___________ 。(列举一条)。N点对应温度下,化学反应经过了10min建立了平衡,该反应的v(H2S)=___________ 。
(3)反应CH4(g)+H2O(g) CO(g)+3H2(g)的平衡转化率与温度、压强关系如图丙所示[其中n(CH4):n(H2O)=1:1]。该反应在图中A点的平衡常数Kp=
CO(g)+3H2(g)的平衡转化率与温度、压强关系如图丙所示[其中n(CH4):n(H2O)=1:1]。该反应在图中A点的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________ 。
(4)瑞典化学家阿累尼乌斯的化学反应速率经验定律为k=Ae ,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是___________ (填序号,k正、k逆为正、逆反应速率常数)。
A.其他条件不变,升高温度,k正增大、k逆变小
B.其他条件不变,使用催化剂,k正、k逆同等倍数增大
C.其他条件不变,增大反应物浓度,k正增大、k逆不变
D.其他条件不变,减小压强,k正、k逆都变小

(1)图甲是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)在一2L密闭容器中,起始时向该容器中充入H2S和CH4,n(H2S):n(CH4)=2:1,起始的n(CH4)=3mol,发生反应:CH4(g)+2H2S(g)
 CS2(g)+4H2(g)。温度变化对平衡时产物的物质的量分数的影响如图乙所示,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是
CS2(g)+4H2(g)。温度变化对平衡时产物的物质的量分数的影响如图乙所示,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是(3)反应CH4(g)+H2O(g)
 CO(g)+3H2(g)的平衡转化率与温度、压强关系如图丙所示[其中n(CH4):n(H2O)=1:1]。该反应在图中A点的平衡常数Kp=
CO(g)+3H2(g)的平衡转化率与温度、压强关系如图丙所示[其中n(CH4):n(H2O)=1:1]。该反应在图中A点的平衡常数Kp=(4)瑞典化学家阿累尼乌斯的化学反应速率经验定律为k=Ae
 ,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是A.其他条件不变,升高温度,k正增大、k逆变小
B.其他条件不变,使用催化剂,k正、k逆同等倍数增大
C.其他条件不变,增大反应物浓度,k正增大、k逆不变
D.其他条件不变,减小压强,k正、k逆都变小
您最近一年使用:0次
名校
2 . 25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,说法错误的是
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
| A.反应达到平衡时,X的转化率为50% |
| B.方程式为X+3Y⇌2Z,平衡常数为1600 |
| C.增大压强使平衡正向方向移动,平衡常数增大 |
| D.改变温度可以改变此反应的平衡常数 |
您最近一年使用:0次
2021-12-29更新
|
222次组卷
|
11卷引用:广西玉林市市直六所普通高中2021-2022学年高二上学期期中考试理科综合化学试题
广西玉林市市直六所普通高中2021-2022学年高二上学期期中考试理科综合化学试题河南省济源市第五中学2020-2021学年高二下学期6月月考化学试题(已下线)第二章 第三节化学平衡(第3课时 化学平衡常数)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)安徽省六安市新安中学2021-2022学年高二上学期期中考试化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题安徽省六安市新安中学2021-2022学年高二上学期12月月考化学试题河南省范县第一中学等学校2021-2022学年高二上学期联考检测化学试题 河南省安阳市滑县实验学校2020-2021学年高二上学期期中考试化学试题(普通班)内蒙古集宁新世纪中学2020-2021学年高二上学期期中考试化学试题(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)四川省泸县第四中学2022-2023学年高二上学期期中考试化学试题
3 . 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ⇌2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列见表,下列说法错误的是
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3 mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大 |
| B.当混合气体平均相对分子质量为26时说明该反应已达平衡 |
| C.根据表中数据,计算25.0 ℃时分解的浓度平衡常数约为1.6×10-8 mol3/L3 |
| D.若保持温度和容器体积不变,平衡后再充入n(NH3)∶n(CO2)=2∶1,则再次达到平衡时c(NH3)不变 |
您最近一年使用:0次
2021-04-07更新
|
437次组卷
|
3卷引用:广西南宁市第三中学2020-2021学年高二下学期第一次月考化学(理)试题



