1 . 已知一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)。该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。
2Fe(s)+3CO2(g)。该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。
(1)根据题干信息,计算出10min内CO的平均反应速率为_______ 。
(2)保持温度不变,待密闭容器中反应达到平衡后,再向容器中通入1molCO气体,重新平衡后,平衡体系中CO所占的体积分数_______。
(3)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:①_______ ②_______ 。
 2Fe(s)+3CO2(g)。该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。
2Fe(s)+3CO2(g)。该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。(1)根据题干信息,计算出10min内CO的平均反应速率为
(2)保持温度不变,待密闭容器中反应达到平衡后,再向容器中通入1molCO气体,重新平衡后,平衡体系中CO所占的体积分数_______。
| A.增大 | B.减小 | C.不变 | D.无法判断 |
您最近一年使用:0次
名校
2 . 某温度下,反应2A(g)⇌B(g)-Q(Q>0)在密闭容器中达到平衡,平衡后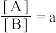 ,若改变某一条件,足够时间后反应再次达到平衡状态,此时
,若改变某一条件,足够时间后反应再次达到平衡状态,此时 ,下列叙述正确的是
,下列叙述正确的是
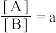 ,若改变某一条件,足够时间后反应再次达到平衡状态,此时
,若改变某一条件,足够时间后反应再次达到平衡状态,此时 ,下列叙述正确的是
,下列叙述正确的是| A.若其他条件不变,升高温度,则a<b |
| B.若保持温度、压强不变,充入惰性气体,则a>b |
| C.若保持温度、容积不变,充入少量B气体,则a<b |
| D.若保持温度、压强不变,充入B气体,则a=b |
您最近一年使用:0次
2021-10-23更新
|
201次组卷
|
2卷引用:上海市复旦大学附属中学2021-2022学年高三上学期第一次月考化学试题
3 . 一定温度下,在3个体积均为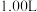 的恒容密闭容器中发生反应
的恒容密闭容器中发生反应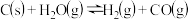
 ,相关数据如下表(已知:炭粉足量)。
,相关数据如下表(已知:炭粉足量)。
下列说法错误的是
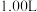 的恒容密闭容器中发生反应
的恒容密闭容器中发生反应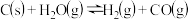
 ,相关数据如下表(已知:炭粉足量)。
,相关数据如下表(已知:炭粉足量)。| 容器 | T/℃ | 物质的起始浓度/( ) ) | 物质的平衡浓度
| ||
 |  | 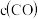 | |||
| Ⅰ |  | 1.00 | 0 | 0 | 0.85 |
| Ⅱ |  | 0 | 1.00 | 1.00 | x |
| Ⅲ |  | 2.00 | 0 | 0 | 1.60 |
A. | B.达到平衡所需时间: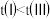 |
C.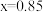 | D. ℃,该反应的化学平衡常数 ℃,该反应的化学平衡常数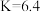 |
您最近一年使用:0次
2021-01-10更新
|
2106次组卷
|
5卷引用:上海市金山区2021-2022学年高三下学期质量监考(二模)化学试题
2013·上海长宁·一模
4 . 温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
以下对反应过程的分析和判断正确的是
 PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
以下对反应过程的分析和判断正确的是
| A.反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L−1·s−1 |
| B.保持其他条件不变,若升高温度,平衡时,c(PCl3)=0.11 mol·L−1,则反应为放热反应 |
| C.相同温度下,若起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,则达平衡前v(正)>v(逆) |
| D.相同温度下,若起始时向容器中充入2.0molPCl3、2.0molCl2,则达平衡时,PCl3的转化率大于80% |
您最近一年使用:0次
12-13高三上·上海虹口·阶段练习
解题方法
5 . 温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
下列说法正确的是
 PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A.反应在前50s的平均速率,v(PCl3)=0.0032mol·L-1·s-1 |
| B.保持其他条件不变,升温,平衡时c(PCl3)= 0.11mol/L,则该反应是放热反应 |
| C.相同条件下,起始充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
| D.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前v(正)>v(逆) |
您最近一年使用:0次
2014·上海松江·三模
6 . 在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)⇌2Z(g)+Q,一段时间后达到平衡,反应过程中测定的数据如下表:
下列说法正确的是
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A.反应前2min的平均速率ν(Z)=2.0×10-3 mol/(L·min) |
| B.其他条件不变,升高温度,反应达到新平衡前ν(逆)>ν(正) |
| C.若无表中数据,可以计算出平衡混合气体的平均相对分子质量 |
| D.其他条件不变,再各充入0.16 mol气体X和气体Y,平衡时Z的体积分数增大 |
您最近一年使用:0次
名校
解题方法
7 . 相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)  2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
下列判断中正确的是
 2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:| 容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/kJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中正确的是
| A.两容器中反应的平衡常数不相等 |
| B.达到平衡时SO2的体积分数:甲<乙 |
| C.197>Q1>Q2 |
| D.生成1molSO3(l)时放出的热量等于98.5kJ |
您最近一年使用:0次
2019-12-22更新
|
250次组卷
|
4卷引用:【全国百强校】上海市复旦大学附属中学2019—2020学年高三上学期期中考试化学试题
【全国百强校】上海市复旦大学附属中学2019—2020学年高三上学期期中考试化学试题上海市奉贤区2015届高三上学期期末考试(一模)化学试题上海市宝山区行知中学2022-2023学年高三上学期期中测试化学试题(已下线)河北省石家庄市2023届高中毕业年级教学质量检测(一模)变式题(选择题11-14)
名校
8 . 体积相同的甲、乙两个容器中,分别充有等物质的量的N2和H2,在相同温度下发生合成氨反应,并达到平衡。在这过程中,甲容器为恒容容器,乙容器为恒压容器,若甲容器中H2的转化率为a%,则乙容器中H2的转化率为:
| A.等于a% | B.大于a% | C.小于a% | D.无法判断 |
您最近一年使用:0次
2019-11-17更新
|
108次组卷
|
2卷引用:上海市复兴高级中学2022-2023学年高二上学期期中考试化学(等级考)试题
名校
解题方法
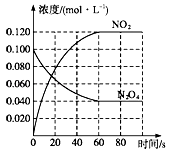
9 . 在容积为1.00L的容器中,通入一定量的 ,发生反应
,发生反应 。100℃时,体系中各物质浓度随时间变化如图所示。80s时,改变反应温度为T,
。100℃时,体系中各物质浓度随时间变化如图所示。80s时,改变反应温度为T, 的浓度以
的浓度以 的平均反应速率降低,经10s又达到平衡。
的平均反应速率降低,经10s又达到平衡。
完成下列填空:
(1)比较N、O的原子半径: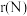
________  (选填“
(选填“ ”或“
”或“ ”)。
”)。
(2)在0-60s时段,反应速率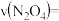
________  。
。
(3)若在相同情况下最初向该容器充入的是 气体,要达到上述同样的状态,
气体,要达到上述同样的状态, 的起始浓度是
的起始浓度是________ mol/L。
(4)T_____ 100℃(选填“ ”或“
”或“ ”),判断理由是
”),判断理由是________________ 。
(5)画出容器在80-90s时段内 和
和 的浓度变化
的浓度变化________ 。
 ,发生反应
,发生反应 。100℃时,体系中各物质浓度随时间变化如图所示。80s时,改变反应温度为T,
。100℃时,体系中各物质浓度随时间变化如图所示。80s时,改变反应温度为T, 的浓度以
的浓度以 的平均反应速率降低,经10s又达到平衡。
的平均反应速率降低,经10s又达到平衡。
完成下列填空:
(1)比较N、O的原子半径:
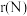
 (选填“
(选填“ ”或“
”或“ ”)。
”)。(2)在0-60s时段,反应速率
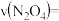
 。
。(3)若在相同情况下最初向该容器充入的是
 气体,要达到上述同样的状态,
气体,要达到上述同样的状态, 的起始浓度是
的起始浓度是(4)T
 ”或“
”或“ ”),判断理由是
”),判断理由是(5)画出容器在80-90s时段内
 和
和 的浓度变化
的浓度变化
您最近一年使用:0次
10 . 800℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应
CO(g)+H2O(g)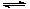 CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
下列说法正确的是
CO(g)+H2O(g)
 CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):| 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A.反应在t1min内的平均速率为v(H2)=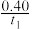 mol/(L·min) mol/(L·min) |
| B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol |
| C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 |
| D.温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应 |
您最近一年使用:0次



