名校
解题方法
1 . 以Cu/ZnO/Al2O3为催化剂,乙醇直接合成乙酸乙酯过程中发生的可逆反应如下:
C2H5OH(g)=CH3CHO(g)+H2(g);ΔH=59kJ·mol-1
2CH3CHO(g)+H2O(g)=C2H5OH(g)+CH3COOH(g);ΔH=-86kJ·mol-1
CH3COOH(g)+C2H5OH(g)=CH3COOC2H5(g)+H2O(g);ΔH=-25kJ·mol-1
2C2H5OH(g)=C2H5OC2H5(g)+H2O(g);ΔH=-44kJ·mol-1
其他条件相同,将无水乙醇经预热气化后以一定流速通过装有催化剂的反应管,将出口处收集到的乙酸乙酯、乙醛、乙醚、乙酸、乙醇冷凝,测得部分有机物占全部有机物的质量分数与反应温度的关系如图所示。下列说法正确的是

C2H5OH(g)=CH3CHO(g)+H2(g);ΔH=59kJ·mol-1
2CH3CHO(g)+H2O(g)=C2H5OH(g)+CH3COOH(g);ΔH=-86kJ·mol-1
CH3COOH(g)+C2H5OH(g)=CH3COOC2H5(g)+H2O(g);ΔH=-25kJ·mol-1
2C2H5OH(g)=C2H5OC2H5(g)+H2O(g);ΔH=-44kJ·mol-1
其他条件相同,将无水乙醇经预热气化后以一定流速通过装有催化剂的反应管,将出口处收集到的乙酸乙酯、乙醛、乙醚、乙酸、乙醇冷凝,测得部分有机物占全部有机物的质量分数与反应温度的关系如图所示。下列说法正确的是

| A.在250~300℃范围,乙醇的转化率随温度的升高而减小 |
| B.在200~325℃范围,乙醇生成乙醚的反应均已到达平衡 |
| C.在300~325℃范围,出口处氢气的量随温度的升高而减小 |
| D.研发使用催化活性高的催化剂有利于提高乙酸乙酯的平衡产率 |
您最近一年使用:0次
2022-03-29更新
|
579次组卷
|
4卷引用:江苏省2022届高三下学期3月第一次调研测试化学试题
江苏省2022届高三下学期3月第一次调研测试化学试题(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)江苏省响水中学2021-2022学年高二下学期第二次学情分析考试化学试题(已下线)第七章 化学反应速率和化学平衡(测)-2023年高考化学一轮复习讲练测(全国通用)
名校
2 . 碳热还原氧化锌反应可用于循环制氢。碳热还原氧化锌的主要反应如下:
反应I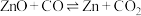 ;
;
反应Ⅱ
在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中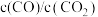 随温度变化的关系如图所示。下列说法正确的是
随温度变化的关系如图所示。下列说法正确的是
反应I
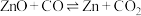 ;
;反应Ⅱ

在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中
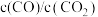 随温度变化的关系如图所示。下列说法正确的是
随温度变化的关系如图所示。下列说法正确的是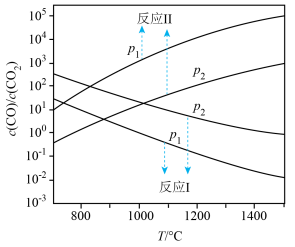
A.压强大小: |
B.在如图所示条件下,反应I可表示为  |
C.选择反应Ⅱ的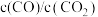 小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行 小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行 |
D.一定条件下将C与ZnO置于同一密闭容器中反应,当 时,增大 时,增大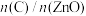 的值,可减少平衡时气体中 的值,可减少平衡时气体中 的含量 的含量 |
您最近一年使用:0次
2023-06-02更新
|
662次组卷
|
3卷引用:江苏省扬州市2023届高三下学期三模化学试题
解题方法
3 . 优化焦炭水蒸气重整工艺可制得CO含量较低的氢燃料。0.1 MPa下,按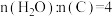 向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:
向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:
反应I: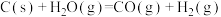
 kJ⋅mol
kJ⋅mol
反应II:
 kJ⋅mol
kJ⋅mol
反应III:
 kJ⋅mol
kJ⋅mol
达到平衡时, 的产率和CO、
的产率和CO、 、
、 干态体积分数(
干态体积分数( )随温度变化如图所示。下列说法
)随温度变化如图所示。下列说法不正确 的是

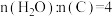 向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:
向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:反应I:
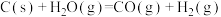
 kJ⋅mol
kJ⋅mol
反应II:

 kJ⋅mol
kJ⋅mol
反应III:

 kJ⋅mol
kJ⋅mol
达到平衡时,
 的产率和CO、
的产率和CO、 、
、 干态体积分数(
干态体积分数( )随温度变化如图所示。下列说法
)随温度变化如图所示。下列说法
| A.曲线B表示CO干态体积分数随温度的变化 |
| B.制备CO含量低的氢燃料应选择800℃左右的温度 |
C.800~1400℃,随温度升高 的产率降低,是因为温度升高对反应II的平衡转化率的影响大于对反应I平衡转化率的影响 的产率降低,是因为温度升高对反应II的平衡转化率的影响大于对反应I平衡转化率的影响 |
D.1200℃时,向平衡体系中通入水蒸气,再次达到平衡时 的值比原平衡的小 的值比原平衡的小 |
您最近一年使用:0次
4 . 铬是电镀、制革和颜料等工业废水中的主要重金属污染物。在水溶液中,Cr(III)以Cr3+形态存在;Cr(VI)主要以 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
(1)“NaBH4”可用于直接还原去除废水中的 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。

①废水初始pH=2.5时, 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式___________ 。
②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是___________ 。
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是______ 。
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的 。
。
①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是___________ 。
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是___________ 。
 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。(1)“NaBH4”可用于直接还原去除废水中的
 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
①废水初始pH=2.5时,
 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的
 。
。①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是
您最近一年使用:0次
名校
解题方法
5 . 经一定时间后,可逆反应aA+bB cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )
cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )
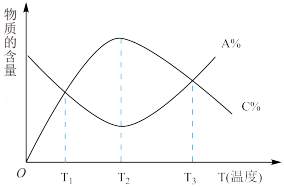
 cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )
cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )
| A.该反应在T1、T3温度时达到化学平衡 |
| B.该反应在T2温度时达到化学平衡 |
| C.该反应的逆反应是放热反应 |
| D.升高温度,平衡会向正反应方向移动 |
您最近一年使用:0次
2020-08-19更新
|
393次组卷
|
42卷引用:2018版化学(苏教版)高考总复习专题七题型冲关--巧解平衡及速率图像题
2018版化学(苏教版)高考总复习专题七题型冲关--巧解平衡及速率图像题(已下线)2010年云南省昆明一中高三上学期第一次月考化学试题(已下线)2011届内蒙古包头一中高三第一次模拟考试(理综)化学部分2015届山东省日照市高三12月校际联合检测化学试卷2017届山西省康杰中学高三上学期10月月考化学试卷2016-2017学年天津市武清区等五区县高三上学期期中考试化学试卷江西省临川第二中学2018届高三上学期第四次月考(期中)化学试题(已下线)专题7.3 化学平衡常数 化学反应进行的方向(练)-《2020年高考一轮复习讲练测》(已下线)2011-2012学年辽南协作体高二上学期期中考试化学试卷(已下线)2012-2013学年吉林省实验中学高二上学期期末考试化学试卷(已下线)2012-2013福建省上杭一中高二上学期期中考试化学理试卷(已下线)2014-2015学年福建三明市一中高二上第一次月考化学试卷2015-2016学年湖北省荆州中学高二上第一次月考化学试卷2015-2016学年江西省临川一中高二上第一次月考化学试卷2015-2016学年山东省平度市高二上学期直升班抽考化学试卷2015-2016学年山东省青岛市平度市高二上学期教学质检化学试卷2015-2016学年江西省上高二中高二下4月月考化学试卷2015-2016学年江西省吉安市一中高二下学期期中化学试卷2015-2016学年安徽省合肥中科大附中高二下期中理科化学试卷2015-2016学年湖南东部六校高一下期中化学试卷2015-2016学年浙江省杭州二中高二下期中化学试卷2015-2016学年云南临沧一中高二下学期期末考试化学卷2016-2017学年湖北省武钢三中高二上月考一化学卷2016-2017学年江西省宜春市奉新一中高二上月考一化学试卷安徽省淮北市第一中学2016-2017学年高一下学期期中考试化学试题1安徽省阜阳市临泉县第一中学2016-2017学年高二下学期学科竞赛化学试题四川省成都石室中学2017-2018学年高二10月月考化学试题山东省枣庄市第三中学2017-2018学年高二第六学段学情调查(1月)化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2018-2019学年高二上学期第一次阶段性测试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期10月月考化学试题河北省安平中学2019-2020学年高二上学期第一次月考化学试题重庆市云阳县2019-2020学年高二上学期期中考试化学试题湖南省长沙市第一中学2019-2020学年高二上学期第一次月考化学试题黑龙江省哈尔滨师范大学附属中学2019-2020学年高二10月月考化学试题江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题山东省济宁市微山一中2020-2021学年高二上学期第一次月考化学试题安徽省定远县育才学校2020-2021学年高二上学期第二次月考化学试题天津市部分区2020-2021学年高二上学期期中考试化学试题河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题广东省揭阳市揭西县河婆中学2020-2021学年高二上学期第二次月考化学试题湖南省祁东县育贤中学2022-2023学年高二上学期第一次月考化学试题安徽省太和县第八中学2021-2022学年高二上学期第一次月考化学试题
2010·江苏扬州·模拟预测
解题方法
6 . T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是( )
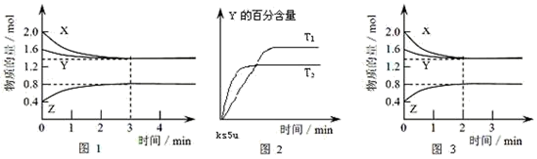

A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.反应进行的前3 min内,用X表示的反应速率 υ(X)=0.3mol/(L·min) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K增大 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |
您最近一年使用:0次



