优化焦炭水蒸气重整工艺可制得CO含量较低的氢燃料。0.1 MPa下,按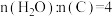 向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:
向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:
反应I: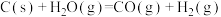
 kJ⋅mol
kJ⋅mol
反应II:
 kJ⋅mol
kJ⋅mol
反应III:
 kJ⋅mol
kJ⋅mol
达到平衡时, 的产率和CO、
的产率和CO、 、
、 干态体积分数(
干态体积分数( )随温度变化如图所示。下列说法
)随温度变化如图所示。下列说法不正确 的是

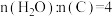 向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:
向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:反应I:
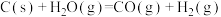
 kJ⋅mol
kJ⋅mol
反应II:

 kJ⋅mol
kJ⋅mol
反应III:

 kJ⋅mol
kJ⋅mol
达到平衡时,
 的产率和CO、
的产率和CO、 、
、 干态体积分数(
干态体积分数( )随温度变化如图所示。下列说法
)随温度变化如图所示。下列说法
| A.曲线B表示CO干态体积分数随温度的变化 |
| B.制备CO含量低的氢燃料应选择800℃左右的温度 |
C.800~1400℃,随温度升高 的产率降低,是因为温度升高对反应II的平衡转化率的影响大于对反应I平衡转化率的影响 的产率降低,是因为温度升高对反应II的平衡转化率的影响大于对反应I平衡转化率的影响 |
D.1200℃时,向平衡体系中通入水蒸气,再次达到平衡时 的值比原平衡的小 的值比原平衡的小 |
更新时间:2023-04-14 23:44:42
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】N2(g)+3H2(g) 2NH3(g) △H<0,向容器中通入1 molN2和3 molH2,当反应达到平衡时,下列措施能提高N2转化率的是
2NH3(g) △H<0,向容器中通入1 molN2和3 molH2,当反应达到平衡时,下列措施能提高N2转化率的是
①降低温度
②维持 温度、容积不变,按照物质的量之比为1:3再通入一定量的N2和H2
③增加N2的物质的量
④维持恒压条件,通入一定量惰性气体
 2NH3(g) △H<0,向容器中通入1 molN2和3 molH2,当反应达到平衡时,下列措施能提高N2转化率的是
2NH3(g) △H<0,向容器中通入1 molN2和3 molH2,当反应达到平衡时,下列措施能提高N2转化率的是①降低温度
②维持 温度、容积不变,按照物质的量之比为1:3再通入一定量的N2和H2
③增加N2的物质的量
④维持恒压条件,通入一定量惰性气体
| A.①④ | B.①② | C.②③ | D.③④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】恒容容器甲、乙与恒压容器丙开始时的体积相同,容器甲和容器丙均充入2molSO2和1molO2气体,容器乙中充入4mol SO3,经过一段时间,在相同温度下达到平衡。有关平衡时的叙述正确的是
| A.甲中SO2的转化率和乙中SO3的转化率之和为1 |
| B.达平衡时,甲用时间比丙长 |
| C.丙中SO3的体积分数比甲中小 |
| D.若乙、丙中皆再加入同量的氮气,平衡不移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】煤化工生产中常研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
则下列说法错误的是( )
已知:CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
| A.在830℃,等物质的量的CO和H2O反应达到平衡时,CO的转化率为50% |
| B.上述正向反应是放热反应 |
| C.某温度下上述反应平衡时,恒容、升高温度,原化学平衡向逆反应方向移动 |
| D.在500℃时,反应达到平衡后,增大压强,化学平衡常数K减小 |
您最近一年使用:0次
【推荐1】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-196kJ·mol-1,一段时间后达到平衡,反应过程中测定的部分数据见下表:
2SO3(g) △H=-196kJ·mol-1,一段时间后达到平衡,反应过程中测定的部分数据见下表:
下列说法不正确的是
 2SO3(g) △H=-196kJ·mol-1,一段时间后达到平衡,反应过程中测定的部分数据见下表:
2SO3(g) △H=-196kJ·mol-1,一段时间后达到平衡,反应过程中测定的部分数据见下表:反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 |
|
10 |
| 0.4 |
15 | 0.8 |
|
| A.△H的大小与平衡移动与否无关 |
| B.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% |
| C.保持温度不变,向平衡后的容器中再充入0.2mol SO2和0.2mol SO3时,v(正)>v(逆) |
| D.其他条件不变,若起始时向容器中充入2mol SO3,达平衡时吸收78.4kJ的热量 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】某温度下,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。
CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。
下列判断不正确的是( )
 CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。
CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。甲 | 乙 | |||
| 起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
| c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
| c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是( )
| A.x=y=0.16 |
| B.反应开始时,乙中反应速率快 |
| C.甲中0~5min平均反应速率υ(CO)=0.004mol•L-1•min-1 |
| D.平衡时,乙中的转化率是50%,c(CO)是甲中的2倍 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】向恒温恒容密闭容器中充入气体A,发生反应:xA(g) yB(g)+zC(g),各物质的浓度随时间的变化如表所示。重庆一中化学组刘卫兵老师看了看你的草稿,推了下你的胳膊,暗示了你一下,那么“这道题正确的是......”( )
yB(g)+zC(g),各物质的浓度随时间的变化如表所示。重庆一中化学组刘卫兵老师看了看你的草稿,推了下你的胳膊,暗示了你一下,那么“这道题正确的是......”( )
 yB(g)+zC(g),各物质的浓度随时间的变化如表所示。重庆一中化学组刘卫兵老师看了看你的草稿,推了下你的胳膊,暗示了你一下,那么“这道题正确的是......”( )
yB(g)+zC(g),各物质的浓度随时间的变化如表所示。重庆一中化学组刘卫兵老师看了看你的草稿,推了下你的胳膊,暗示了你一下,那么“这道题正确的是......”( )| 时间/s | c(A)/(mol•L-1) | c(B)/(mol•L-1) | c(C)/(mol•L-1) |
| 0 | 0.540 | 0 | 0 |
| 5 | 0.530 | 0.015 | 0.020 |
| 15 | 0.514 | 0.039 | 0.052 |
| 30 | 0.496 | 0.066 | 0.088 |
| A.0~30s内B的平均生成速率为2.2×10-3mol·L-1·s-1 |
| B.x+y=3 |
| C.若起始时在容器中通入氦气,使容器压强增大,各物质反应速率均加快 |
| D.随着反应的进行,A的反应速率不断减慢,是因为该反应是吸热反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】已知:CO(g) + H2O(g)  H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
 H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A.该反应的正反应是吸热反应 |
| B.恒温时减小容器体积增大压强,正反应速率增大 |
| C.830 ℃时,反应达到平衡,一定是c(CO) = c(CO2) |
| D.400 ℃时,生成CO2物质的量越多,平衡常数K越大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
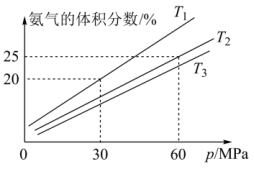
【推荐1】为了探究外界条件对工业合成氨反应的影响  , 现往密闭容器中充入
, 现往密闭容器中充入 和
和 模拟合成氨反应。在不同温度下, 平衡体系中氨气的体积分数与总压强(
模拟合成氨反应。在不同温度下, 平衡体系中氨气的体积分数与总压强( )的关系如图所 示 (分压
)的关系如图所 示 (分压 总压
总压 物质的量分数)。下列说法中正确的是
物质的量分数)。下列说法中正确的是
 , 现往密闭容器中充入
, 现往密闭容器中充入 和
和 模拟合成氨反应。在不同温度下, 平衡体系中氨气的体积分数与总压强(
模拟合成氨反应。在不同温度下, 平衡体系中氨气的体积分数与总压强( )的关系如图所 示 (分压
)的关系如图所 示 (分压 总压
总压 物质的量分数)。下列说法中正确的是
物质的量分数)。下列说法中正确的是
A.若断裂  键、同时断裂 键、同时断裂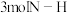 键, 则说明该反应达到平衡状态 键, 则说明该反应达到平衡状态 |
B.在 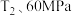 时, 时,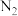 的平衡分压为 的平衡分压为 |
C.若 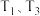 温度下的平衡常数分别为 温度下的平衡常数分别为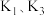 , 则 , 则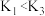 |
D.在 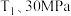 时, 若经过 2 小时达到平衡, 则: 时, 若经过 2 小时达到平衡, 则: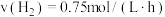 |
您最近一年使用:0次
【推荐2】一定量的CO2与足量的C在恒压密闭容器中发生反应:C(s)+CO2(g) 2CO(g) ΔH,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,下列说法正确的是
2CO(g) ΔH,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,下列说法正确的是
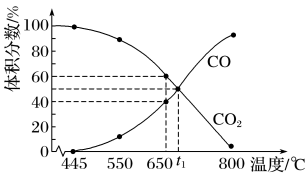
 2CO(g) ΔH,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,下列说法正确的是
2CO(g) ΔH,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,下列说法正确的是
| A.该反应ΔH<0 |
| B.650℃时CO2的平衡转化率为30% |
| C.t1℃时达平衡后若再充入等物质的量的CO和CO2气体,则平衡向逆向移动 |
| D.若密闭容器中混合气体密度不再变化时,该反应处于平衡状态 |
您最近一年使用:0次

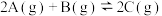 ,往密闭容器中以
,往密闭容器中以 的比例通入两种反应物,其中15 min后A在四温度下的转化率如下表所示,且
的比例通入两种反应物,其中15 min后A在四温度下的转化率如下表所示,且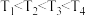 ,则下列说法正确的是
,则下列说法正确的是
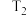
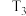
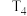
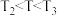 ),A的转化率是70%
),A的转化率是70%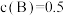 mol·L
mol·L


 在容积相同的恒容密闭容器中,不同温度下分别发生反应:
在容积相同的恒容密闭容器中,不同温度下分别发生反应: ,相同时间后测得
,相同时间后测得


