名校
解题方法
1 . 下列图像能正确地表达可逆反应3A(g)+B(g)⇌2C(g)(ΔH<0)的是
A.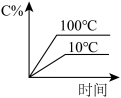 | B. |
C. | D. |
您最近一年使用:0次
2019-12-16更新
|
503次组卷
|
21卷引用:福建省长泰县第一中学2020届高三上学期期中考试化学试题
福建省长泰县第一中学2020届高三上学期期中考试化学试题福建省永安市第九中学2022-2023学年高二上学期期中考试化学(选考)试题(已下线)2010年河南省郑州外国语学校全真模拟(二)(理科综合)化学部分(已下线)2010-2011学年广东省白云中学高二下学期期中考试化学试卷(已下线)2011-2012学年辽宁省沈阳同泽女中高二上学期期中考试化学试卷(已下线)2011-2012学年山东省济宁市重点中学高二上学期期中考试化学试卷(已下线)2013-2014学年河北省遵化市高二上学期期中质量检测化学试卷2014-2015浙江省严州中学高二下学期4月阶段性测试化学试卷2015-2016学年河北邯郸魏县一中、曲周县一中高二上期中化学试卷湖南省湘潭、岳阳两校2015-2016学年高二上第三次联考化学卷2017届山东省枣庄三中高三上学期9月质检化学试卷2016-2017学年江西省南昌市第二中学高二上学期期末考试化学试卷2018届高三一轮复习化学:微考点55-平衡移动与结果判断(已下线)2018年9月18日 《每日一题》人教选修4-化学平衡移动的分析山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题陕西省蓝田县焦岱中学2018-2019学年高二上学期第一次月考化学试题湖南省岳阳市岳阳县一中、汨罗市一中2019-2020学年高二10月联考化学试题陕西省咸阳市西藏民族大学附属中学2019-2020学年高二上学期期中考试化学试题山西省怀仁市重点中学2019-2020学年高二上学期期末考试化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题湖北省黄冈市麻城市实验高中2020-2021学年高二上学期10月月考化学试题
解题方法
2 . CO还原脱硝技术可有效降低烟气中的NOx的排放量。
(1)汽车在行驶过程中会产生有害气体CO、NO,在催化剂作用下发生如下脱硝反应: ,该反应平衡常数的表达式K=
,该反应平衡常数的表达式K=______________ ,在570 K时,K值极大,为1×1059,但汽车上仍需装备尾气处理装置,其可能原因是________________ 。
(2)以Mn3O4为脱硝反应的催化剂,研究者提出如下反应历程,将历程补充完整。
第一步:___________________________________ ;
第二步:
(3)T℃、2L密闭容器中,充入各1mol的CO和NO混合气体,加入Mn3O4发生脱硝反应,t0 时达到平衡,测得反应过程中CO2的体积分数与时间的关系如下图所示:

①比较大小:a处v正______ b处v逆(填“>”、“<”或“=”)
②若t0 =10min,反应从开始到达平衡CO气体的平均反应速率v( CO) =_____ 。
③NO的平衡转化率为______ ,T℃时反应的化学平衡常数K=_________ 。
④T℃时,某时刻测得体系中各物质的量如下:n(CO)=0.2mol,n(NO)=0.2mol,n(N2)=0.1mol,n(CO2)=0.2mol,则此时该反应_______ 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(1)汽车在行驶过程中会产生有害气体CO、NO,在催化剂作用下发生如下脱硝反应:
 ,该反应平衡常数的表达式K=
,该反应平衡常数的表达式K=(2)以Mn3O4为脱硝反应的催化剂,研究者提出如下反应历程,将历程补充完整。
第一步:
第二步:

(3)T℃、2L密闭容器中,充入各1mol的CO和NO混合气体,加入Mn3O4发生脱硝反应,t0 时达到平衡,测得反应过程中CO2的体积分数与时间的关系如下图所示:

①比较大小:a处v正
②若t0 =10min,反应从开始到达平衡CO气体的平均反应速率v( CO) =
③NO的平衡转化率为
④T℃时,某时刻测得体系中各物质的量如下:n(CO)=0.2mol,n(NO)=0.2mol,n(N2)=0.1mol,n(CO2)=0.2mol,则此时该反应
您最近一年使用:0次
名校
解题方法
3 . 氨的合成对国家工业发展有着举足轻重的作用,N2(g)+3H2(g)  2NH3(g) △H<0(图中 T表示温度, n表示物质的量) ,下列说法不正确的是
2NH3(g) △H<0(图中 T表示温度, n表示物质的量) ,下列说法不正确的是
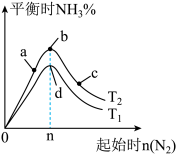
 2NH3(g) △H<0(图中 T表示温度, n表示物质的量) ,下列说法不正确的是
2NH3(g) △H<0(图中 T表示温度, n表示物质的量) ,下列说法不正确的是
| A.图中 T2和 T1的关系是: T2<T1 |
| B.在a、b、c三点所处的平衡状态中,反应物H2的转化率最高的是b |
| C.在起始体系中n(N2):n(H2)=1:3时,反应后氨的百分含量最大 |
| D.反应体系中活化分子的百分含量d>b |
您最近一年使用:0次
2019-11-26更新
|
121次组卷
|
2卷引用:福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题
4 . T℃时,在1L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是( )


A.容器中发生的反应可表示为:X(g)+Y(g)  Z(g) Z(g) |
| B.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| C.反应进行的前3 min内,用X表示的反应速率 v(Z)=0.4mol/(L·min) |
| D.反应达到平衡后,增大压强,Z的体积分数增大 |
您最近一年使用:0次
10-11高二上·福建·期中
名校
5 . 对于可逆反应2AB3(g) A2(g)+3B2(g)△H>0下列图像不正确的是()
A2(g)+3B2(g)△H>0下列图像不正确的是()
 A2(g)+3B2(g)△H>0下列图像不正确的是()
A2(g)+3B2(g)△H>0下列图像不正确的是()A. | B.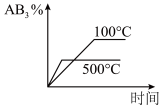 |
C. | D. |
您最近一年使用:0次
2019-10-13更新
|
218次组卷
|
17卷引用:2010年福建省师大附中高二上学期期中考试化学卷
(已下线)2010年福建省师大附中高二上学期期中考试化学卷(已下线)2011-2012学年福建省福州文博中学高二下学期期中考试化学试卷(已下线)2011-2012学年江西省南昌三中高二上学期期中考试化学试卷(已下线)2012-2013年江苏南京学大教育专修学校高二3月月考化学试卷(已下线)2013-2014学年湖北省武汉市部分学校高二上学期期末考试化学试卷(已下线)2014-2015学年湖北鄂州市泽林镇泽林中学高二上第一次月考化学试卷2015-2016学年四川省宜宾市第三中学高二上学期期中测试化学试卷2015-2016学年安徽省铜陵一中高二上期中测试化学试卷2015-2016学年贵州遵义航天中学高二上第三次月考化学卷2016届内蒙古鄂尔多斯市第三中学高三上学期第四次考试化学试卷2016-2017学年河北冀州市中学高二上开学调研化学卷2016-2017学年西藏拉萨中学高二上第一次月考化学试卷2016-2017学年辽宁省盘锦高中高二上期中化学卷【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期期中考试化学试题新疆巴州焉耆县第三中学2018-2019学年高二上学期期末考试化学试题河南省洛阳市2018-2019学年高二第一学期期中考试化学试题湖北省荆门市龙泉中学、巴东一中2019-2020学年高二10月联考化学试题
名校
6 . 可逆反应mA(固)+nB(气)⇌pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
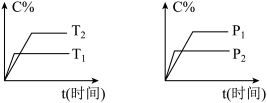

| A.达到平衡后,使用催化剂,C%将增大 |
| B.达到平衡后,若升高温度、化学平衡向逆反应方向移动 |
| C.方程式中n>p+q |
| D.达到平衡后,增加A的量有利于化学平衡向正反应方向移动 |
您最近一年使用:0次
2019-10-05更新
|
1836次组卷
|
39卷引用:2014-2015学年福建省晋江市季延中学高二下学期期中考试化学试卷
2014-2015学年福建省晋江市季延中学高二下学期期中考试化学试卷福建省莆田四中2019-2020学年高二上学期期中考试化学试题(已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2011-2012学年内蒙古包头三十三中高二上学期期末考试化学试卷(已下线)2012-2013学年黑龙江省集贤县第一中学高二上学期期末考试化学试卷(已下线)2014-2015学年吉林延边二中高二9月阶段考试化学试卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷2014-2015学年内蒙古巴彦淖尔市一中高二上学期期中化学试卷2015-2016学年浙江台州中学高二上第三次统练化学试卷2016-2017学年河北省定州二中高二上学期第一次月考化学试卷2016-2017学年甘肃省嘉峪关市酒钢三中高二上学期期末考试化学试卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷四川省泸州泸县第五中学2018届高三上学期期末考试理综化学试题吉林省吉林地区普通高中友好学校联合体2017-2018学年高二上学期期末考试化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二上学期10月月考化学试题【校级联考】广东省汕头市达濠华侨中学、东厦中学2018-2019学年高二(理)上学期阶段测试(二)化学试题安徽省六安市二中2018-2019学年高二第一学期10月月考化学试题甘肃省白银市会宁县第一中学2019-2020学年高二上学期期中考试化学(理)试题广东省广州市第八十九中学2019-2020学年高二上学期期中考试化学试题湖南省永州市宁远县第一中学2019-2020学年高二上学期期中考试化学试题山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题云南省曲靖市陆良县第十中学2019-2020学年高二上学期期末考试化学试题甘肃省兰州大学附属中学(33中)2019-2020学年高二上学期期中考试化学试题广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题湖北省恩施州巴东县第二高级中学2019-2020学年高一下学期网课质量检测化学试题江西省上饶市横峰中学2020-2021学年高二上学期第一次月考化学(统招班)试题甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 吉林省吉化第一高级中学校2020-2021学年高二上学期期末考试化学试题宁夏固原市隆德县2020-2021学年高二上学期期末考试化学试题湖南省湘潭电机子弟中学2019-2020学年高二下学期期中考试化学(理)试题河南省登封市第一高级中学2019-2020学年高二上学期期中考试化学试题广东省汕尾市2021-2022学年高一年级下学期期末考试化学试题安徽省怀宁县第二中学2021-2022学年高二上学期期中考试化学试题云南省文山州广南县第二中学校2021-2022学年高二上学期12月考试化学试题广东省江门广雅中学2022-2023学年高二上学期期中考试化学试题浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题辽宁省名校联盟2023-2024学年高二上学期期初考试化学试题辽宁省锦州市黑山县名校联盟试2023-2024学年高二上学期开学考试化学试题黑龙江省虎林市高级中学2023-2024学年高二上学期第一次月考化学试题
11-12高二上·吉林长春·阶段练习
名校
7 . 密闭容器中有如下反应:L(s)+aG(g)  bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )

 bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
| A.正反应为放热反应 |
| B.G的转化率随温度升高而减小 |
| C.化学方程式中的计量数a>b |
| D.增大压强,容器内气体质量不变 |
您最近一年使用:0次
2019-09-02更新
|
727次组卷
|
11卷引用:2012届福建省厦门外国语学校高三上学期10月份月考化学试卷
(已下线)2012届福建省厦门外国语学校高三上学期10月份月考化学试卷(已下线)2011-2012学年福建省福州文博中学高二下学期期中考试化学试卷(已下线)2011-2012年吉林省长春外国语学校高二上学期第一次月考化学试卷(已下线)2011-2012学年江西省白鹭洲中学高二上学期期中考试化学(理)试卷(已下线)2012-2013学年安徽省舒城晓天中学高二上学期第一次月考化学试卷2016届湖北省襄阳市保康县第一中学高三上学期期中测试化学试卷黑龙江省大庆铁人中学2019-2020学年高二上学期入学考试化学试题天津市静海区大邱庄中学等四校2019-2020学年高二10联考化学试题河南省三门峡市第一高级中学2020-2021学年高二上学期9月月考化学试题河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题广东省广州市第十七中学2022-2023学年高二上学期期中考试化学试题
名校
8 . 在一定条件下,密闭容器中进行反应CH4(g) + H2O(g)  CO(g) + 3H2(g) ,测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g) ,测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是

 CO(g) + 3H2(g) ,测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g) ,测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
| A.p1>p2 |
| B.ΔH<0 |
| C.加入催化剂可以提高甲烷的转化率 |
| D.恒温下,缩小容器体积,平衡后CH4浓度减小 |
您最近一年使用:0次
2019-02-02更新
|
276次组卷
|
3卷引用:【市级联考】福建省泉州市2018-2019学年高二上学期期末教学质量跟踪监测化学试题
名校
9 . 对于可逆反应mA(g)+nB(g) pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
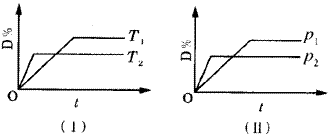
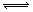 pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
| A.降温,化学平衡向正反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中气体的化学计量数m+n>q |
| D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
您最近一年使用:0次
2019-01-30更新
|
131次组卷
|
4卷引用:2015-2016学年福建省福安市高级中学高二上学期第一次月考化学试卷
10-11高三上·福建泉州·期末
名校
10 . 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系,当在某一温度时,A、B、C物质的量与时间的关系如图1,C的百分含量与温度的关系如图2。
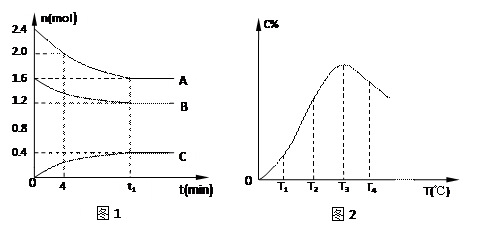
下列分析不正确的是

下列分析不正确的是
| A.0~4分钟时,A的平均反应速率为0.02mol/(L·min) |
B.该反应的平衡常数表达式 |
| C.由T1向T2变化时,V正 > V逆 |
| D.此反应的正反应为放热反应 |
您最近一年使用:0次
2019-01-30更新
|
759次组卷
|
6卷引用:福建省泉州市四校2010届高三上学期期末联考(化学)
(已下线)福建省泉州市四校2010届高三上学期期末联考(化学)(已下线)2015届山西大学附中高三上学期期中化学试卷2017届四川省广元市苍溪县高三零诊理综化学试卷(已下线)山东省济南市2019-2020年高三10月月考化学试题湖南师范大学附属中学2021届高三上学期第二次月考化学试题河北省保定市曲阳县第一高级中学2020-2021学年高二上学期第二次月考化学试题



