名校
1 .  和
和 是两种重要的温室气体,通过
是两种重要的温室气体,通过 和
和 反应制造更高价值化学品是目前的研究目标。请回答下列问题:
反应制造更高价值化学品是目前的研究目标。请回答下列问题:
Ⅰ.工业上可以利用 和
和 合成
合成 :
:
 。该反应在起始温度和体积均相同(T℃、IL)的两个密闭容器中分别进行,反应物起始物质的量如表。
。该反应在起始温度和体积均相同(T℃、IL)的两个密闭容器中分别进行,反应物起始物质的量如表。
(1)下列能说明反应a达到平衡状态的是_______。(填字母)
(2)达到平衡时,反应a,b对比: 的体积分数
的体积分数
_______  。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)
Ⅱ.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:

反应2:

在密闭容器中通入3mol的 和1mol的
和1mol的 ,分别在0.1MPa和1MPa下进行反应。实验中对平衡体系进行分析,其中温度对CO和的影响如图1所示
,分别在0.1MPa和1MPa下进行反应。实验中对平衡体系进行分析,其中温度对CO和的影响如图1所示
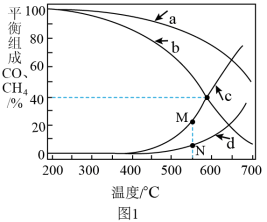
(3)1MPa时,表示 和CO平衡组成随温度变化关系的曲线分别是
和CO平衡组成随温度变化关系的曲线分别是_______ 和_______ 。M点平衡组成含量高于N点的原因是_______ 。
Ⅲ.在 时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和
时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和 ,发生反应:
,发生反应: ,反应达到平衡时
,反应达到平衡时 的体积分数(
的体积分数(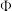 )与
)与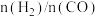 的关系如图2所示。
的关系如图2所示。

(4)当 时,达到平衡后,
时,达到平衡后, 的体积分数可能是图象中的
的体积分数可能是图象中的_______ (填“D”、“E”或“F”)点。
(5)
_______ 时, 的体积分数最大。
的体积分数最大。
 和
和 是两种重要的温室气体,通过
是两种重要的温室气体,通过 和
和 反应制造更高价值化学品是目前的研究目标。请回答下列问题:
反应制造更高价值化学品是目前的研究目标。请回答下列问题:Ⅰ.工业上可以利用
 和
和 合成
合成 :
:
 。该反应在起始温度和体积均相同(T℃、IL)的两个密闭容器中分别进行,反应物起始物质的量如表。
。该反应在起始温度和体积均相同(T℃、IL)的两个密闭容器中分别进行,反应物起始物质的量如表。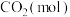 |  | 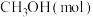 |  | |
| 反应a(恒温恒容) | 1 | 3 | 0 | 0 |
| 反应b(绝热恒容) | 0 | 0 | 1 | 1 |
A. | B.混合气体的平均摩尔质量不再改变 |
C.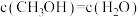 | D.容器内压强不再改变 |
 的体积分数
的体积分数
 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”) Ⅱ.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:


反应2:


在密闭容器中通入3mol的
 和1mol的
和1mol的 ,分别在0.1MPa和1MPa下进行反应。实验中对平衡体系进行分析,其中温度对CO和的影响如图1所示
,分别在0.1MPa和1MPa下进行反应。实验中对平衡体系进行分析,其中温度对CO和的影响如图1所示
(3)1MPa时,表示
 和CO平衡组成随温度变化关系的曲线分别是
和CO平衡组成随温度变化关系的曲线分别是Ⅲ.在
 时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和
时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和 ,发生反应:
,发生反应: ,反应达到平衡时
,反应达到平衡时 的体积分数(
的体积分数(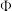 )与
)与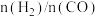 的关系如图2所示。
的关系如图2所示。
(4)当
 时,达到平衡后,
时,达到平衡后, 的体积分数可能是图象中的
的体积分数可能是图象中的(5)
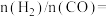
 的体积分数最大。
的体积分数最大。
您最近一年使用:0次
名校
2 .  与
与 是大气主要污染物,需要经过净化处理后才能排放。
是大气主要污染物,需要经过净化处理后才能排放。
(1)汽车发动机工作时会引发 和
和 反应生成NO,其反应过程中的能量变化如表:
反应生成NO,其反应过程中的能量变化如表:
则
_______ (填“>”或“<”)。
(2) 催化还原氨氧化物是目前应用广泛的烟气氨氧化物脱除技术,如用
催化还原氨氧化物是目前应用广泛的烟气氨氧化物脱除技术,如用 还原NO的反应为:
还原NO的反应为:
 。
。
①实验分别测得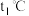 、
、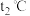 时NO的百分含量随时间变化关系如图所示,分析图象可得出该反应的
时NO的百分含量随时间变化关系如图所示,分析图象可得出该反应的
_______ 0(填“>”或“<”)。
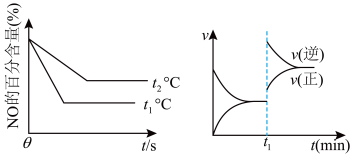
②一定条件下该可逆反应达到平衡后, 时刻改变某个外界条件,正反应的速率
时刻改变某个外界条件,正反应的速率 、逆反应的速率
、逆反应的速率 变化情况如图所示,则
变化情况如图所示,则 时刻改变的外界条件可能是
时刻改变的外界条件可能是_______ 。
(3)利用电化学联合处理法可实现 和NO同时除去,工作原理如图所示:
和NO同时除去,工作原理如图所示:

①阳极的电极反应式为_______ 。
②若工作前后阴极室成分不变,被处理的 和NO在相同条件下体积比
和NO在相同条件下体积比
_______ 。
 与
与 是大气主要污染物,需要经过净化处理后才能排放。
是大气主要污染物,需要经过净化处理后才能排放。(1)汽车发动机工作时会引发
 和
和 反应生成NO,其反应过程中的能量变化如表:
反应生成NO,其反应过程中的能量变化如表:| 反应 |  |  |  |
| 反应热 |  |  |  |

(2)
 催化还原氨氧化物是目前应用广泛的烟气氨氧化物脱除技术,如用
催化还原氨氧化物是目前应用广泛的烟气氨氧化物脱除技术,如用 还原NO的反应为:
还原NO的反应为:
 。
。①实验分别测得
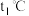 、
、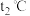 时NO的百分含量随时间变化关系如图所示,分析图象可得出该反应的
时NO的百分含量随时间变化关系如图所示,分析图象可得出该反应的

②一定条件下该可逆反应达到平衡后,
 时刻改变某个外界条件,正反应的速率
时刻改变某个外界条件,正反应的速率 、逆反应的速率
、逆反应的速率 变化情况如图所示,则
变化情况如图所示,则 时刻改变的外界条件可能是
时刻改变的外界条件可能是(3)利用电化学联合处理法可实现
 和NO同时除去,工作原理如图所示:
和NO同时除去,工作原理如图所示:
①阳极的电极反应式为
②若工作前后阴极室成分不变,被处理的
 和NO在相同条件下体积比
和NO在相同条件下体积比
您最近一年使用:0次
名校
3 . 密闭容器中进行的可逆反应aA(g)+bB(g)⇌cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是( )
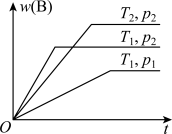

| A.T1<T2,p1<p2,a+b>c,正反应为吸热反应 |
| B.T1>T2,p1<p2,a+b<c,正反应为吸热反应 |
| C.T1<T2,p1>p2,a+b<c,正反应为吸热反应 |
| D.T1>T2,p1>p2,a+b>c,正反应为放热反应 |
您最近一年使用:0次
2020-05-08更新
|
392次组卷
|
25卷引用:江苏省南京市雨花台中学2020-2021学年高二年级上学期期末调研测试化学试题
江苏省南京市雨花台中学2020-2021学年高二年级上学期期末调研测试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期末考试化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期末考试化学试题广东省大埔县虎山中学2022-2023学年高三上学期1月期末考试化学试题河北省承德县第一中学2022-2023学年高一下学期期末考试化学试题2016-2017学年新疆生产建设兵团二中高二上期中化学卷新疆呼图壁县第一中学2017-2018学年高二上学期期中考试化学试题新疆维吾尔自治区昌吉市第四中学2018-2019学年第一学期高二第一次月考化学试题内蒙古自治区翁牛特旗乌丹第一中学2018-2019学年高二上学期期中考试化学试题新疆自治区昌吉市第九中学2018-2019学年高二上学期第二次月考化学试题四川省宁南中学2018-2019学年高二下学期第一次月考化学试题山东省实验中学2020届高三第一次诊断性考试化学试题云南省玉溪市玉溪一中2019-2020学年高二上学期第一次月考化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(讲)-《2020年高考一轮复习讲练测》步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题湖北省新高考联考协作体2020-2021学年高二上学期期中考试化学试题贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题重庆市朝阳中学高2020-2021学年高二上学期期中考试化学试题北京市东直门中学2022-2023学年高二上学期期中考试化学试题北京工业大学附属中学2023-2024学年高二上学期期中考试化学试题四川省达州市宣汉县第二中学2023-2024学年高二上学期中期考试化学试题四川省内江市2025届第三中学高二上学期化学试卷四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题
解题方法
4 . CO2、CO、H2催化合成醇可减排温室气体并合成可再生燃料,是新能源领域的研究前沿。已知CO2与H2混合后一定条件下可发生下列两个可逆反应:
I、CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol−1
II、CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2= 41.1 kJ·mol−1
(1)H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) = CH3OH(g) ΔH,则ΔH=_______ kJ·mol−1。
(2)1 mol CO2和3 mol H2混和气体在一定条件下反应,测得CO2平衡转化率、平衡时含碳产物中CH3OH和CO的物质的量分数随温度变化如图-1所示
①图中平衡时产物中CO的百分含量对应的曲线是_______ (填“b”或“c”),理由为_______ 。
②图中X点时,CO2的平衡转化率为25%,则此时混合体系中n(CH3OH)∶n(CO)∶n(CO2)=_______ ;H2的转化率为_______ %(保留三位有效数字)。
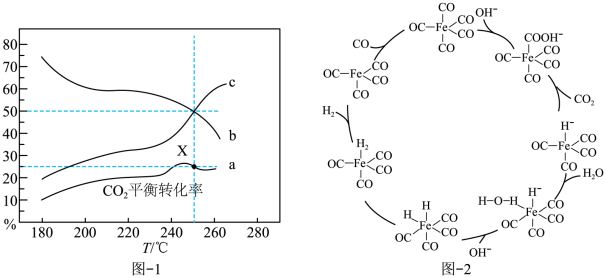
(3)CO和H2O可以在Fe(CO)5催化作用下发生反应II,其反应机理如图-2所示。OH-在此反应中的作用是_______ ;若参与反应的为C18O,则生成的二氧化碳成分为_______ (填“只有CO18O”或“只有CO2” 或“CO18O和CO2”)
I、CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol−1
II、CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2= 41.1 kJ·mol−1
(1)H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) = CH3OH(g) ΔH,则ΔH=
(2)1 mol CO2和3 mol H2混和气体在一定条件下反应,测得CO2平衡转化率、平衡时含碳产物中CH3OH和CO的物质的量分数随温度变化如图-1所示
①图中平衡时产物中CO的百分含量对应的曲线是
②图中X点时,CO2的平衡转化率为25%,则此时混合体系中n(CH3OH)∶n(CO)∶n(CO2)=

(3)CO和H2O可以在Fe(CO)5催化作用下发生反应II,其反应机理如图-2所示。OH-在此反应中的作用是
您最近一年使用:0次
名校
5 . 反应mA(固)+nB(气)⇌eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是
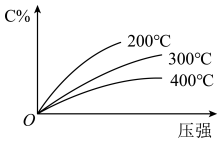

| A.化学方程式中n>e+f |
| B.达到平衡后,若升温,平衡右移 |
| C.到平衡后,加入催化剂,则C%增大 |
| D.达到平衡后,增加A的量有利于平衡向右移动 |
您最近一年使用:0次
2020-06-10更新
|
168次组卷
|
12卷引用:2015-2016学年江苏省盐城市阜宁中学高二上学期期末选修化学试卷
2015-2016学年江苏省盐城市阜宁中学高二上学期期末选修化学试卷2016-2017学年天津市部分区高二上学期期末化学试卷天津市静海区第一中学2019-2020学年高二上学期期末学生学业能力调研化学试题(已下线)2012-2013学年陕西省长安一中高二下学期期中考试化学试卷(已下线)2013-2014学年海南省三亚市一中高二上学期期中考试理科化学试卷(已下线)2013-2014学年海南三亚一中高二上学期期中考试理科化学试卷(B)2015-2016学年河南省洛阳市伊川实验高中高二上第二次月考化学试卷吉林松原乾安七中2019-2020学年高二上学期9月月考化学试题吉林省松原市乾安县七中2019-2020学年高二上学期第一次月考化学试题四川省攀枝花市第十五中学2019-2020学年高二上学期期中考试化学试题新疆昌吉州教育共同体2020-2021学年高二上学期期中考试化学试题云南省水富县云天化中学2020-2021学年高二下学期期中考试化学试题
10-11高二下·浙江嘉兴·期中
名校
6 . 在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)⇌xC(g),符合如图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
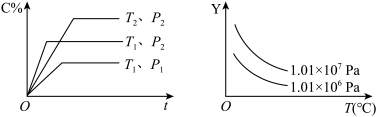

| A.反应物A的百分含量 | B.平衡混合气体中物质B的百分含量 |
| C.平衡混合气体的密度 | D.平衡混合气体的平均摩尔质量 |
您最近一年使用:0次
2019-12-05更新
|
268次组卷
|
16卷引用:2010-2011学年江苏省五校联考高二下学期期末考试化学试题
(已下线)2010-2011学年江苏省五校联考高二下学期期末考试化学试题(已下线)2011-2012年江苏宿迁泗洪县洪翔中学高二下学期期中考试化学试卷2015-2016学年甘肃省甘谷一中高二上期末化学试卷云南省普洱市澜沧县第一中学2018-2019学年高二下学期期末考试化学试题(已下线)2010—2011学年浙江省嘉兴一中高二下学期期中考试化学试卷2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷2015-2016学年黑龙江齐齐哈尔实验中学高二上期中化学卷浙江省温州市求知中学2018-2019学年高二上学期期中考试(选考)化学试题内蒙古自治区固阳县一中2018-2019学年高二上学期期中考试理科综合化学试题安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题甘肃省定西市岷县第一中学2019-2020学年高二下学期开学测试化学试题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(精练)-2021年高考化学一轮复习讲练测安徽省六安市城南中学2020-2021学年高二上学期期中考试化学试题吉林省抚松县第六中学2020-2021学年高二下学期摸底考试化学试题内蒙古赤峰市第四中学分校2021-2022学年高二上学期期中考试化学试题重庆市黔江中学校2022-2023学年高二上学期10月考试化学试卷
10-11高二上·四川成都·期中
名校
解题方法
7 . 反应A(g) + 3B(g)  2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
 2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的A. | B.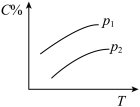 |
C.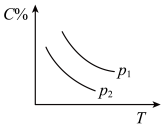 | D.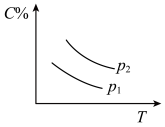 |
您最近一年使用:0次
2020-04-14更新
|
164次组卷
|
21卷引用:2013-2014学年江苏省南师附中江宁分校高二上学期选修期末化学试卷
(已下线)2013-2014学年江苏省南师附中江宁分校高二上学期选修期末化学试卷江苏省仪征中学2016-2017学年高二4月月考化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题(已下线)2010年四川省成都市实验中学高二上学期期中考试化学试卷(已下线)2010年黑龙江大庆实验中学高二上学期期中考试化学试卷(已下线)2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷(已下线)2014-2015学年辽宁大连市第二十高级中学高二上期中考试化学试题(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(A)卷2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷甘肃省天水市第一中学2017-2018学年高二上学期第一阶段考试(理)化学试题湖南省邵东县第十中学2018-2019学年高二上学期期中考试理科班化学试题山东省泰安第四中学2018-2019学年高二上学期12月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二上学期第二次月考化学试题甘肃省天水市天水一中2019-2020学年高二(普通班)上学期第一次月考化学(理)试题广东省惠来县葵潭中学2019-2020学年高二上学期第二次月考化学试题湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题(已下线)上海市松江一中2013届高三上学期期中考试化学试题安徽省黄山市屯溪第一中学2019-2020学年高二下学期入学考试化学试题甘肃省武威第八中学2020-2021学年高二上学期月考化学试题甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 海南省海口市灵山中学2019—2020学年高二上学期期中测试化学试题



