名校
解题方法
1 . 以Cu/ZnO/Al2O3为催化剂,乙醇直接合成乙酸乙酯过程中发生的可逆反应如下:
C2H5OH(g)=CH3CHO(g)+H2(g);ΔH=59kJ·mol-1
2CH3CHO(g)+H2O(g)=C2H5OH(g)+CH3COOH(g);ΔH=-86kJ·mol-1
CH3COOH(g)+C2H5OH(g)=CH3COOC2H5(g)+H2O(g);ΔH=-25kJ·mol-1
2C2H5OH(g)=C2H5OC2H5(g)+H2O(g);ΔH=-44kJ·mol-1
其他条件相同,将无水乙醇经预热气化后以一定流速通过装有催化剂的反应管,将出口处收集到的乙酸乙酯、乙醛、乙醚、乙酸、乙醇冷凝,测得部分有机物占全部有机物的质量分数与反应温度的关系如图所示。下列说法正确的是

C2H5OH(g)=CH3CHO(g)+H2(g);ΔH=59kJ·mol-1
2CH3CHO(g)+H2O(g)=C2H5OH(g)+CH3COOH(g);ΔH=-86kJ·mol-1
CH3COOH(g)+C2H5OH(g)=CH3COOC2H5(g)+H2O(g);ΔH=-25kJ·mol-1
2C2H5OH(g)=C2H5OC2H5(g)+H2O(g);ΔH=-44kJ·mol-1
其他条件相同,将无水乙醇经预热气化后以一定流速通过装有催化剂的反应管,将出口处收集到的乙酸乙酯、乙醛、乙醚、乙酸、乙醇冷凝,测得部分有机物占全部有机物的质量分数与反应温度的关系如图所示。下列说法正确的是

| A.在250~300℃范围,乙醇的转化率随温度的升高而减小 |
| B.在200~325℃范围,乙醇生成乙醚的反应均已到达平衡 |
| C.在300~325℃范围,出口处氢气的量随温度的升高而减小 |
| D.研发使用催化活性高的催化剂有利于提高乙酸乙酯的平衡产率 |
您最近一年使用:0次
2022-03-29更新
|
579次组卷
|
4卷引用:江苏省响水中学2021-2022学年高二下学期第二次学情分析考试化学试题
江苏省响水中学2021-2022学年高二下学期第二次学情分析考试化学试题江苏省2022届高三下学期3月第一次调研测试化学试题(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)(已下线)第七章 化学反应速率和化学平衡(测)-2023年高考化学一轮复习讲练测(全国通用)
名校
解题方法
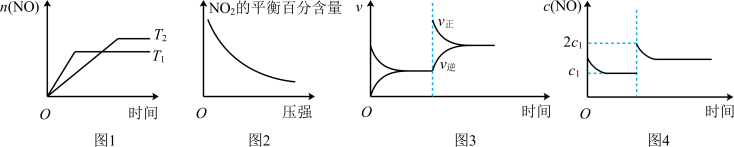
2 . 1000K时,在密闭容器内发生反应:2NO2(g) 2NO(g)+O2(g) ΔH>0,下列图像与该反应体系相符的是
2NO(g)+O2(g) ΔH>0,下列图像与该反应体系相符的是
 2NO(g)+O2(g) ΔH>0,下列图像与该反应体系相符的是
2NO(g)+O2(g) ΔH>0,下列图像与该反应体系相符的是
| A.图1表示温度对反应的影响 | B.图2表示压强对物质平衡百分含量的影响 |
| C.图3表示恒容再充入NO2 | D.图4表示体积增大至原来的2倍 |
您最近一年使用:0次
2023-09-13更新
|
361次组卷
|
2卷引用:江苏省连云港市东海县石榴高级中学2022-2023学年高二上学期第一次学情测试化学试题
名校
3 . 碳热还原氧化锌反应可用于循环制氢。碳热还原氧化锌的主要反应如下:
反应I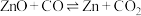 ;
;
反应Ⅱ
在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中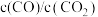 随温度变化的关系如图所示。下列说法正确的是
随温度变化的关系如图所示。下列说法正确的是
反应I
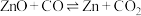 ;
;反应Ⅱ

在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中
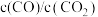 随温度变化的关系如图所示。下列说法正确的是
随温度变化的关系如图所示。下列说法正确的是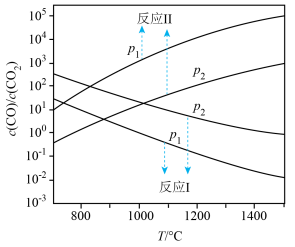
A.压强大小: |
B.在如图所示条件下,反应I可表示为  |
C.选择反应Ⅱ的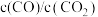 小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行 小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行 |
D.一定条件下将C与ZnO置于同一密闭容器中反应,当 时,增大 时,增大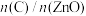 的值,可减少平衡时气体中 的值,可减少平衡时气体中 的含量 的含量 |
您最近一年使用:0次
2023-06-02更新
|
663次组卷
|
3卷引用:江苏省清江中学、南通部分学校2023-2024学年高二下学期第一次调研(3月)化学试卷
名校
解题方法
4 . 二甲醚催化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g) CH3COOCH3(g)△H1<0
CH3COOCH3(g)△H1<0
反应Ⅱ:CH3COOCH3(g)+2H2(g) CH3CH2OH(g)+CH3OH(g)△H2<0
CH3CH2OH(g)+CH3OH(g)△H2<0
在固定 CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ, 平衡时各物质的物质的量分数随温度的变化如图所示。下列说法正确的是
反应Ⅰ:CO(g)+CH3OCH3(g)
 CH3COOCH3(g)△H1<0
CH3COOCH3(g)△H1<0反应Ⅱ:CH3COOCH3(g)+2H2(g)
 CH3CH2OH(g)+CH3OH(g)△H2<0
CH3CH2OH(g)+CH3OH(g)△H2<0在固定 CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ, 平衡时各物质的物质的量分数随温度的变化如图所示。下列说法正确的是

| A.曲线 B 表示 H2的物质的量分数随温度的变化 |
| B.600 K 后升高温度,CH3COOCH3的物质的量分数降低原因是反应Ⅱ平衡右移 |
| C.测得 X 点 CH3CH2OH 的物质的量分数是 10%,则 X 点反应Ⅱ有:v 正>v 逆 |
| D.其他条件不变,延长反应时间能提高平衡混合物中乙醇含量 |
您最近一年使用:0次
2023-04-15更新
|
312次组卷
|
5卷引用:江苏省江阴市华士高级中学2023-2024学年高二上学期12月学情调研化学(选修)试卷
解题方法
5 . 优化焦炭水蒸气重整工艺可制得CO含量较低的氢燃料。0.1 MPa下,按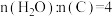 向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:
向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:
反应I: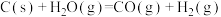
 kJ⋅mol
kJ⋅mol
反应II:
 kJ⋅mol
kJ⋅mol
反应III:
 kJ⋅mol
kJ⋅mol
达到平衡时, 的产率和CO、
的产率和CO、 、
、 干态体积分数(
干态体积分数( )随温度变化如图所示。下列说法
)随温度变化如图所示。下列说法不正确 的是

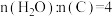 向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:
向容器中加入一定量的焦炭和水蒸气。体系中发生如下反应:反应I:
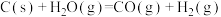
 kJ⋅mol
kJ⋅mol
反应II:

 kJ⋅mol
kJ⋅mol
反应III:

 kJ⋅mol
kJ⋅mol
达到平衡时,
 的产率和CO、
的产率和CO、 、
、 干态体积分数(
干态体积分数( )随温度变化如图所示。下列说法
)随温度变化如图所示。下列说法
| A.曲线B表示CO干态体积分数随温度的变化 |
| B.制备CO含量低的氢燃料应选择800℃左右的温度 |
C.800~1400℃,随温度升高 的产率降低,是因为温度升高对反应II的平衡转化率的影响大于对反应I平衡转化率的影响 的产率降低,是因为温度升高对反应II的平衡转化率的影响大于对反应I平衡转化率的影响 |
D.1200℃时,向平衡体系中通入水蒸气,再次达到平衡时 的值比原平衡的小 的值比原平衡的小 |
您最近一年使用:0次
名校
6 . 在恒容密闭容器中充入一定量的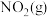 和
和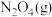 ,发生反应N2O4(g)⇌2NO2(g)
,发生反应N2O4(g)⇌2NO2(g)  ,体系中各物质的百分含量与温度的变化关系如图所示,
,体系中各物质的百分含量与温度的变化关系如图所示,

下列说法错误的是
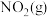 和
和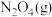 ,发生反应N2O4(g)⇌2NO2(g)
,发生反应N2O4(g)⇌2NO2(g)  ,体系中各物质的百分含量与温度的变化关系如图所示,
,体系中各物质的百分含量与温度的变化关系如图所示,
下列说法错误的是
A.曲线①表示 的百分含量 的百分含量 |
B. 的键能总和大于 的键能总和大于 的键能总和 的键能总和 |
C.若 点为反应平衡点,此时平衡常数 点为反应平衡点,此时平衡常数 |
| D.反应达到平衡后,往该容器中充入少量N2O4,N2O4转化率减小 |
您最近一年使用:0次
2021-11-03更新
|
130次组卷
|
2卷引用:江苏省江阴市华士高级中学2023-2024学年高二上学期12月学情调研化学(选修)试卷
名校
7 . T℃时,在体积为2L的恒容密闭容器中A气体与B气体反应生成C气体,反应过程中A、B、C物质的量的变化如下图a所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如下图b所示。

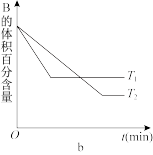
(1)从反应开始到平衡,A的平均反应速率v(A)=_____ mol/(L∙min);
(2)该反应的平衡常数表达式为___ ;为使该反应的平衡常数变大,可以采取的措施是___ 。
(3)上述反应的正反应____ (填“放热”或“吸热”);
(4)在此容器中,判断该反应达到平衡状态的标志是___ 。(填字母)
a.A和B的浓度相等 b.C的百分含量保持不变 c.容器中气体的压强不变 d.C的生成速率与C的消耗速率相等 e.容器中混合气体的密度保持不变
(5)T℃时,若在同一容器中加入2molC,达平衡后体系中各物质的百分含量与图a中的平衡状态相同,则需再加入A、B的物质的量分别为____ 、____ 。


(1)从反应开始到平衡,A的平均反应速率v(A)=
(2)该反应的平衡常数表达式为
(3)上述反应的正反应
(4)在此容器中,判断该反应达到平衡状态的标志是
a.A和B的浓度相等 b.C的百分含量保持不变 c.容器中气体的压强不变 d.C的生成速率与C的消耗速率相等 e.容器中混合气体的密度保持不变
(5)T℃时,若在同一容器中加入2molC,达平衡后体系中各物质的百分含量与图a中的平衡状态相同,则需再加入A、B的物质的量分别为
您最近一年使用:0次
8 . 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。下列分析不正确的是
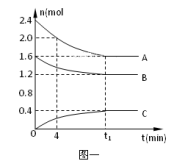
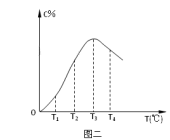


A.0~4 时,A的平均反应速率为0.01mol/(L·min) 时,A的平均反应速率为0.01mol/(L·min) |
B.该反应的平衡常数表达式为: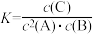 |
| C.由T1向T2变化时,v正>v逆 |
| D.此反应的正反应为吸热反应 |
您最近一年使用:0次
名校
解题方法
9 . 反应A(g) + 3B(g)  2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
 2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的A. | B.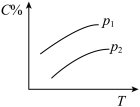 |
C.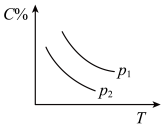 | D.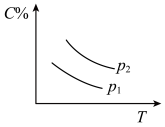 |
您最近一年使用:0次
2020-04-14更新
|
164次组卷
|
21卷引用:江苏省仪征中学2016-2017学年高二4月月考化学试题
江苏省仪征中学2016-2017学年高二4月月考化学试题(已下线)2013-2014学年江苏省南师附中江宁分校高二上学期选修期末化学试卷甘肃省天水市第一中学2017-2018学年高二上学期第一阶段考试(理)化学试题山东省泰安第四中学2018-2019学年高二上学期12月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二上学期第二次月考化学试题甘肃省天水市天水一中2019-2020学年高二(普通班)上学期第一次月考化学(理)试题广东省惠来县葵潭中学2019-2020学年高二上学期第二次月考化学试题安徽省黄山市屯溪第一中学2019-2020学年高二下学期入学考试化学试题甘肃省武威第八中学2020-2021学年高二上学期月考化学试题(已下线)2010年四川省成都市实验中学高二上学期期中考试化学试卷(已下线)2010年黑龙江大庆实验中学高二上学期期中考试化学试卷(已下线)2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷(已下线)2014-2015学年辽宁大连市第二十高级中学高二上期中考试化学试题(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(A)卷2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷湖南省邵东县第十中学2018-2019学年高二上学期期中考试理科班化学试题湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题(已下线)上海市松江一中2013届高三上学期期中考试化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 海南省海口市灵山中学2019—2020学年高二上学期期中测试化学试题



