11-12高三·陕西西安·阶段练习
名校
1 . aA(g)+bB(g) cC(g)+dD(g) ΔH=Q,同时符合下列两图中各曲线的规律是
cC(g)+dD(g) ΔH=Q,同时符合下列两图中各曲线的规律是

 cC(g)+dD(g) ΔH=Q,同时符合下列两图中各曲线的规律是
cC(g)+dD(g) ΔH=Q,同时符合下列两图中各曲线的规律是
| A.a+b>c+d T1>T2 Q>0 | B.a+b>c+d T1<T2 Q<0 |
| C.a+b<c+d T1<T2 Q>0 | D.a+b>c+d T1>T2 Q<0 |
您最近一年使用:0次
2016-12-09更新
|
496次组卷
|
10卷引用:广东省揭西县河婆中学2018-2019学年高二上学期期中考试化学试题
广东省揭西县河婆中学2018-2019学年高二上学期期中考试化学试题(已下线)2012届陕西省西安中学高三第三次月考化学试卷(已下线)2014—2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷2016-2017学年河北冀州中学高二上第一次月考化学试卷河北省唐山一中2017-2018学年高二上学期期中考试化学试题安徽省铜陵市第一中学2019-2020学年高二上学期期中考试化学试题江西省上饶市“山江湖”协作体2019-2020学年高二上学期期中化学(统招班)试题湖北省荆门市2019-2020学年高二上学期期末学业水平选择性考试阶段性检测化学试题福建省三明第一中学2019-2020学年高二下学期期中考试化学试题(已下线)2.3.2影响化学平衡状态的因素(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)
名校
解题方法
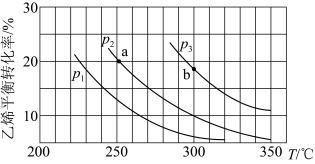
2 . 乙烯气相直接水合反应制备乙醇: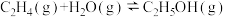 。乙烯的平衡转化率随温度、压强的变化关系如图(起始时,n(H2O)=n(C2H4)=1mol,容器体积为1L)。下列分析正确的是
。乙烯的平衡转化率随温度、压强的变化关系如图(起始时,n(H2O)=n(C2H4)=1mol,容器体积为1L)。下列分析正确的是
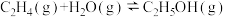 。乙烯的平衡转化率随温度、压强的变化关系如图(起始时,n(H2O)=n(C2H4)=1mol,容器体积为1L)。下列分析正确的是
。乙烯的平衡转化率随温度、压强的变化关系如图(起始时,n(H2O)=n(C2H4)=1mol,容器体积为1L)。下列分析正确的是
| A.乙烯气相直接水合反应的△H<0 |
| B.图中压强的大小关系为:p1>p2>p3 |
| C.达到平衡状态a、b所需要的时间:a<b |
| D.图中a点对应的平衡常数K=5 |
您最近一年使用:0次
2020-12-15更新
|
114次组卷
|
2卷引用:广东省深圳市盐田区深圳外国语学校2020-2021学年高二上学期期中考试化学试题
解题方法
3 . 低碳环保,减轻大气污染,必须从源头上对尾气进行净化处理。回答下列问题
(1)汽车尾气催化转换器中的反应为2NO(g)+2CO(g) 2CO2(g)+N2(g)。若在密闭容器中发生该反应时,c(N2)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。若在密闭容器中发生该反应时,c(N2)随温度(T)和时间(t)的变化曲线如图所示。
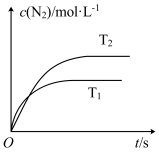
①由图甲可知,温度T1_____ T2(填“>”或“<”,下同);该反应的△H_____ 0。
②能提高尾气转化率的措施有_____ (填字母)。
a.升高温度 b.降低温度 c.增大压强 d.增大催化剂的比表面积
(2)煤燃烧产生的烟气中含有氮氧化物,可用CH4催化还原NOx,消除氮氧化物的污染。已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ•mol﹣1,②N2O4(g)⇌2NO2(g)△H=+56.9k•mol﹣1,③CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣810.1kJ•mol﹣1,从原电池的工作原理分析,可设计为原电池的反应为_____ (填序号)。
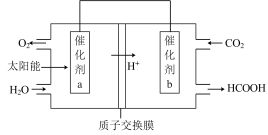
(3)下图是通过光电转化原理,以燃煤产生的二氧化碳为原料,制备新产品的示意图。试写出光电转化过程中总反应的化学方程式:_____ ;催化剂a、b之间连接导线上的电流方向是_____ 。
(1)汽车尾气催化转换器中的反应为2NO(g)+2CO(g)
 2CO2(g)+N2(g)。若在密闭容器中发生该反应时,c(N2)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。若在密闭容器中发生该反应时,c(N2)随温度(T)和时间(t)的变化曲线如图所示。
①由图甲可知,温度T1
②能提高尾气转化率的措施有
a.升高温度 b.降低温度 c.增大压强 d.增大催化剂的比表面积
(2)煤燃烧产生的烟气中含有氮氧化物,可用CH4催化还原NOx,消除氮氧化物的污染。已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ•mol﹣1,②N2O4(g)⇌2NO2(g)△H=+56.9k•mol﹣1,③CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣810.1kJ•mol﹣1,从原电池的工作原理分析,可设计为原电池的反应为
(3)下图是通过光电转化原理,以燃煤产生的二氧化碳为原料,制备新产品的示意图。试写出光电转化过程中总反应的化学方程式:

您最近一年使用:0次
名校
4 . 某化学科研小组研究在其他条件不变时,改变某一条件对3A2(g)+B2(g)⇌2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的


| A.a、b、c三点平衡常数的大小关系为:Kb>Kc >Ka |
| B.达到平衡时B2的转化率大小为:b>a>c |
| C.增大压强有利于AB3的生成,因此在实际生产中压强越大越好 |
D.若起始量为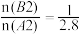 ,则在T2温度下,平衡时AB3的体积分数接近b点 ,则在T2温度下,平衡时AB3的体积分数接近b点 |
您最近一年使用:0次
名校
5 . 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g)。
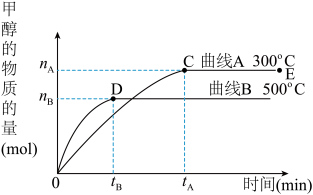
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=__________ ,升高温度,K值__________ (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______________ 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是__________ (填字母序号)。
a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大

根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
您最近一年使用:0次
2020-04-10更新
|
110次组卷
|
2卷引用:广东省揭阳市第三中学2019-2020学年高二上学期第二次月考化学试题
名校
6 . 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g) CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。
CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。

下列说法中,正确的是( )
 CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。
CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。
下列说法中,正确的是( )
| A.X代表压强 | B.L1<L2 |
| C.平衡常数:K(A)=K(B) | D.在C点时,CO转化率为75% |
您最近一年使用:0次
2016-12-09更新
|
430次组卷
|
7卷引用:广东省广州市第六中学2021-2022学年高二下学期期中测试化学试题
名校
7 . T ℃时,将5mol A和7mol B气体通入体积为10L的密闭容器中(容积不变),反应过程中A、B、C的浓度变化如图Ⅰ所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间关系如图Ⅱ所示:
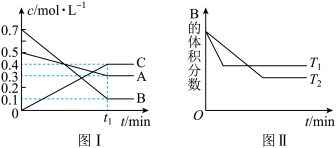
则下列结论正确的是( )

则下列结论正确的是( )
| A.T ℃时,将4mol A、4mol B和2mol C气体通入体积为10L的密闭容器中(容积不变),达到平衡时,C的浓度为0.4 mol·L-1 |
| B.保持其他条件不变,在(t1+10)min 时,加入催化剂,平衡向正反应方向移动 |
| C.保持其他条件不变,在(t1+10)min 时,通入稀有气体,平衡向逆反应方向移动 |
| D.保持其他条件不变,升高温度,正、逆反应速率均增大,A的转化率也增大 |
您最近一年使用:0次
2019-12-23更新
|
132次组卷
|
4卷引用:广东省第二师范学院番禺附属中学2019-2020学年高二下学期期中段考化学试题
名校
8 . 在一定条件下CO(g)和H2(g)发生反应:CO(g) +2H2(g) ⇌CH3OH(g)。在容积固定且均为1 L的a、b、c三个密闭容器中分别充入1 mol CO (g)和2 mol H2 (g),三个容器的反应温度分别为T1、T2、T3(依次升高)且恒定不变,测得反应均进行到5 min时CH3OH (g)的浓度如下图所示。下列说法正确的
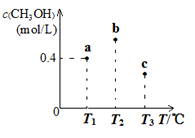

| A.该反应的正反应△H >0 |
| B.当三个容器内的反应都达到化学平衡时,CO转化率最大的是α(a) |
| C.三个容器中平衡常数最大的是c容器中的平衡常数 |
| D.反应均进行到5min时,b点一定达到平衡状态 |
您最近一年使用:0次
名校
解题方法
9 . 向恒容、绝热的容器中加入0.15 A、0.05
A、0.05 C和一定量B三种气体,一定条件下发生反应,各物质浓度随时间的变化如图所示。已知在反应过程中混合气体的平均摩尔质量没有变化,下列说法错误的是:
C和一定量B三种气体,一定条件下发生反应,各物质浓度随时间的变化如图所示。已知在反应过程中混合气体的平均摩尔质量没有变化,下列说法错误的是:
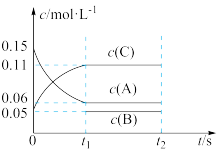
 A、0.05
A、0.05 C和一定量B三种气体,一定条件下发生反应,各物质浓度随时间的变化如图所示。已知在反应过程中混合气体的平均摩尔质量没有变化,下列说法错误的是:
C和一定量B三种气体,一定条件下发生反应,各物质浓度随时间的变化如图所示。已知在反应过程中混合气体的平均摩尔质量没有变化,下列说法错误的是:
A.反应的化学方程式为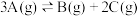 |
| B.t2时再加入少量A,平衡不移动 |
| C.容器内的压强不变说明该反应已达平衡状态 |
D.起始时B的浓度为0.02 |
您最近一年使用:0次
名校
10 . 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应N2(g)+3H2(g) 2NH3(g),673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
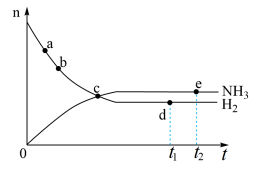
 2NH3(g),673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
| A.点c处反应达到平衡 |
| B.点a的正反应速率比点b的大 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.点d(t1时刻)和点e(t2时刻)处正逆速率不相等。 |
您最近一年使用:0次
2019-11-02更新
|
123次组卷
|
3卷引用:广东省广州市第一一三中学22020-2021学年高二上学期第一阶段考试化学(选考)试题



