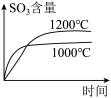
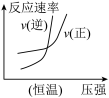
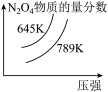
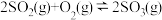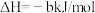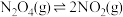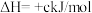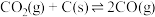真题
解题方法
1 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1
b)CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
c)CH4(g) C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3
d)2CO(g) CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4
e)CO(g)+H2(g) H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=_______ (写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______ 。
A. 增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B. 移去部分C(s),反应c、d、e的平衡均向右移动
C. 加入反应a的催化剂,可提高CH4的平衡转化率
D. 降低反应温度,反应a~e的正、逆反应速率都减小
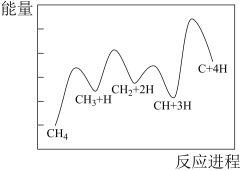
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分_______ 步进行,其中,第_______ 步的正反应活化能最大。
(4)设K 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
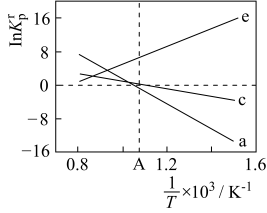
①反应a、c、e中,属于吸热反应的有_______ (填字母)。
②反应c的相对压力平衡常数表达式为K =
=_______ 。
③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程_______ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:_______ 。
a)CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1b)CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2c)CH4(g)
 C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3d)2CO(g)
 CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4e)CO(g)+H2(g)
 H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5(1)根据盖斯定律,反应a的∆H1=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有
A. 增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B. 移去部分C(s),反应c、d、e的平衡均向右移动
C. 加入反应a的催化剂,可提高CH4的平衡转化率
D. 降低反应温度,反应a~e的正、逆反应速率都减小
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分

(4)设K
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为K
 =
=③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程
(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
2021-06-11更新
|
13338次组卷
|
11卷引用:2021年新高考广东化学高考真题
2021年新高考广东化学高考真题2021年广东省高考化学试卷变式题11-21(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向18 化学反应与能量变化-备战2022年高考化学一轮复习考点微专题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编(已下线)考点23 化学平衡常数-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题17 原理综合题(已下线)专题17 原理综合题
解题方法
2 . 一定温度下,在 的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的曲线如图所示。下列描述正确的是
的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的曲线如图所示。下列描述正确的是
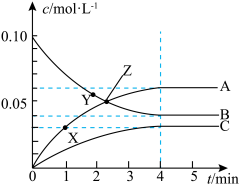
 的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的曲线如图所示。下列描述正确的是
的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的曲线如图所示。下列描述正确的是
A.X点的 Y点的 Y点的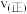 | B.Z点时反应达到平衡状态 |
| C.B的平衡转化率为30% | D.保持温度、体积不变, 时充入 时充入 ,正逆反应速率均增大 ,正逆反应速率均增大 |
您最近一年使用:0次
名校
解题方法
3 . 下列四图中,曲线变化情况与所给反应 、
、 、
、 、
、 均大于
均大于 相对应的是
相对应的是
A | B | C | D |
|
|
|
|
|
|
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-02更新
|
655次组卷
|
13卷引用:广东省广州市第八十九中学2020-2021学年高二上学期期中考试化学试题
广东省广州市第八十九中学2020-2021学年高二上学期期中考试化学试题广东省佛山市第一中学2021-2022学年高二上学期第一次段考化学试题 广东省佛山市第一中学2022-2023学年高二上学期10月月考化学试题广东省惠州市实验中学2022-2023学年高二上学期期中考试化学试题广东省湛江市第二十一中学2022-2023学年高二上学期期中考试化学试题广东省松湖莞中、深大附中两校2023-2024学年高二上学期10月联考化学试题【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期期中考试化学试题1江西省靖安中学2019-2020学年高二上学期第一次月考化学试题浙江省精诚联盟2022-2023学年高二上学期10月联考化学试题湖南省长郡中学2022-2023学年高二上学期第一次月考化学试题湖北省襄阳东风中学2021-2022学年高二上学期10月月考化学试题辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题福建省龙岩市永定区城关中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . NO和O2混合后可发生反应:①2NO(g)+O2(g)=2NO2(g),②2NO2(g)⇌N2O4(g)反应体系中含氮物质的物质的量浓度 随着时间
随着时间 的变化曲线如图。下列说法正确的是
的变化曲线如图。下列说法正确的是
 随着时间
随着时间 的变化曲线如图。下列说法正确的是
的变化曲线如图。下列说法正确的是
A.c为c(NO2)随 的变化曲线 的变化曲线 |
B. 时,反应①达到化学平衡状态 时,反应①达到化学平衡状态 |
C. 时,c(NO)+c(NO2)+c(N2O4)=c0 时,c(NO)+c(NO2)+c(N2O4)=c0 |
D. 后,NO2的消耗速率等于生成速率 后,NO2的消耗速率等于生成速率 |
您最近一年使用:0次
2022-03-07更新
|
1305次组卷
|
8卷引用:广东省广州市执信中学2022届高三下学期联考化学试题
广东省广州市执信中学2022届高三下学期联考化学试题(已下线)2022年广东卷高考真题变式题(11-16)(已下线)第21练 新高考模式综合练(广东卷)-2022年【暑假分层作业】高二化学(2023届一轮复习通用)广东省广州市第一中学2022-2023学年高二上学期期中考试化学试题广东省佛山市顺德区罗定邦中学2023-2024学年高二上学期期中考试化学试题广东省茂名市高州中学2023-2024学年高二上学期期中考试化学试题(1-3班)湖南省长郡中学2021-2022学年高一下学期选考科目调研考试化学试题山东名校考试联盟2023-2024学年高一下学期5月期中检测化学试题
5 . 在1L恒容密闭容器中充入体积比为3:1的H2和CO2,二者在催化剂、加热条件下反应可以合成乙烯:6H2+2CO2 CH2=CH2+4H2O(g)△H<0,不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是
CH2=CH2+4H2O(g)△H<0,不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是
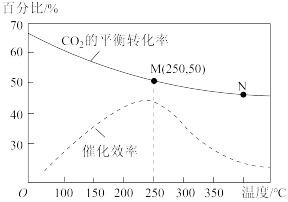
 CH2=CH2+4H2O(g)△H<0,不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是
CH2=CH2+4H2O(g)△H<0,不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是
| A.N点的反应速率一定比M点大 |
| B.M点时,产物乙烯的体积分数约为7.7% |
| C.其他条件相同时,N点的平衡常数比M点的大 |
| D.N点对应温度下的催化剂的催化效率比M点对应温度下的高 |
您最近一年使用:0次
2021-01-19更新
|
1226次组卷
|
6卷引用:广东省茂名市“五校联盟” 2021-2022学年高二上学期期末联考(创新班)化学试题
广东省茂名市“五校联盟” 2021-2022学年高二上学期期末联考(创新班)化学试题河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研二化学试题(已下线)第2章 化学反应速率与化学平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)黑龙江省七台河市勃利县高级中学2022-2023学年高二上学期期中考试化学试题河南省鹤壁市高中2022-2023学年高二上学期10月居家测试化学试题重庆市松树桥中学校2023-2024学年高二上学期半期考试(期中)化学试题
解题方法
6 . 以 为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇: 。
。
已知:
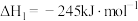
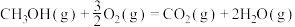
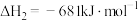
回答下列问题:
(1)计算上述合成甲醇反应的焓变
______  。
。
(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果.在3 MPa, 时,不同Ni、Ga配比的Ni-Ga/
时,不同Ni、Ga配比的Ni-Ga/ 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是______ 。催化剂的最佳配比和反应温度是______ 。 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数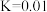 ,下列事实说明该反应已达平衡的是______。
,下列事实说明该反应已达平衡的是______。
(4)① 合成
合成 存在以下副反应:
存在以下副反应: 。5MPa,200℃时在1 L容器中投入1 mol
。5MPa,200℃时在1 L容器中投入1 mol  和3 mol
和3 mol  ,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=
,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=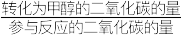 )。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)
)。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)________________________ 。
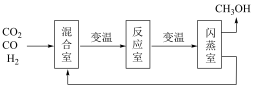
②已知200℃时有60%以上的原料未转化,为了提高转化率,设计如图流程分离甲醇和水,循环利用原料气。已知甲醇的沸点是64.7℃,根据信息判断反应室的温度______ 闪蒸室的温度(选填“<”、“=”或“>”).在原料气中通入CO的目的是________________________ 。
 为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇: 。
。已知:

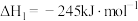
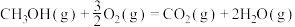
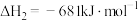
回答下列问题:
(1)计算上述合成甲醇反应的焓变

 。
。(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果.在3 MPa,
 时,不同Ni、Ga配比的Ni-Ga/
时,不同Ni、Ga配比的Ni-Ga/ 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是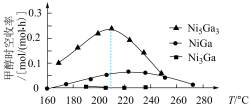
 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数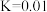 ,下列事实说明该反应已达平衡的是______。
,下列事实说明该反应已达平衡的是______。| A.气体密度保持不变 |
B. 与 与 的生成速率相等 的生成速率相等 |
C.某时刻容器中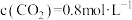 , ,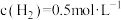 , , |
| D.混合气体的平均相对分子质量不变 |
 合成
合成 存在以下副反应:
存在以下副反应: 。5MPa,200℃时在1 L容器中投入1 mol
。5MPa,200℃时在1 L容器中投入1 mol  和3 mol
和3 mol  ,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=
,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率= )。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)
)。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)②已知200℃时有60%以上的原料未转化,为了提高转化率,设计如图流程分离甲醇和水,循环利用原料气。已知甲醇的沸点是64.7℃,根据信息判断反应室的温度
您最近一年使用:0次
名校
解题方法
7 . 下列图示与对应叙述不相符 的是
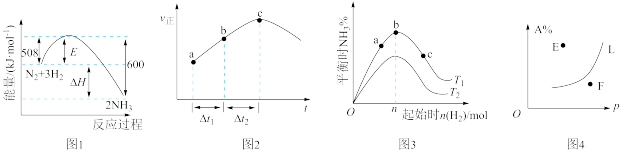
A.图1各物质均为气体,升高温度时,反应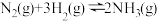 的平衡常数会减小 的平衡常数会减小 |
B.图2为在绝热恒容密闭容器中,反应 的正反应速率随时间变化的示意图,由图可知该反应为放热反应 的正反应速率随时间变化的示意图,由图可知该反应为放热反应 |
| C.图3为合成氨反应中,其它条件不变时,起始时H2用量对反应的影响图,则图中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
D.图4中,反应 ,L线上所有的点都是平衡点,则E点v正>v逆 ,L线上所有的点都是平衡点,则E点v正>v逆 |
您最近一年使用:0次
2022-11-05更新
|
659次组卷
|
7卷引用:广东省三校联考2022-2023学年高二上学期期中考试化学试题
解题方法
8 . 二氧化碳催化加氢制甲醇有利于减少温室气体排放。涉及的主要反应如下:
Ⅰ.

Ⅱ.
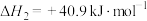
Ⅲ.
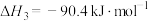
(1)
___________  ,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________ (填标号),判断的理由是___________ 。
A. B.
B.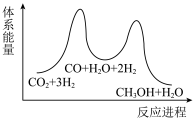
C.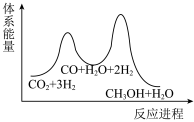 D.
D.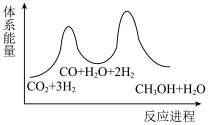
(2)一定条件下,恒容密闭容器中 和
和 发生上述反应。下列说法正确的是___________
发生上述反应。下列说法正确的是___________
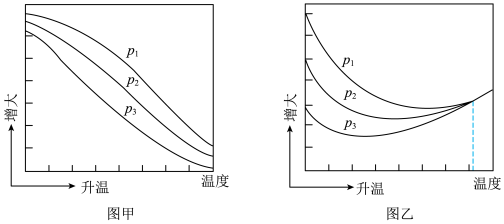
(3)不同压强下,按照 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
已知:
 的平衡转化率
的平衡转化率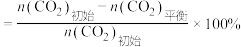
 的平衡产率
的平衡产率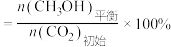
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图___________ (填“甲”或“乙”),压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是___________ 。
(4)一定条件下,向体积为1L的恒容密闭容器中通入1mol 和3mol
和3mol  发生上述反应,经10分钟达到平衡,此时
发生上述反应,经10分钟达到平衡,此时 的转化率为80%,且体系中
的转化率为80%,且体系中 。
。 的平均反应速率
的平均反应速率
___________  ,反应Ⅱ的平衡常数K=
,反应Ⅱ的平衡常数K=___________ 。
Ⅰ.


Ⅱ.

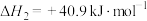
Ⅲ.

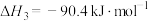
(1)

 ,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是A.
 B.
B.
C.
 D.
D.
(2)一定条件下,恒容密闭容器中
 和
和 发生上述反应。下列说法正确的是___________
发生上述反应。下列说法正确的是___________| A.当混合气体密度不变时说明体系达到平衡状态 |
| B.反应达到平衡状态后通入氦气,体系压强增大,反应速率不变,平衡不移动 |
| C.使用高效催化剂,可提高甲醇的生产效率,但不能改变甲醇的平衡产率 |
| D.实际生产中温度越低越有利于甲醇的合成 |
 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
已知:
 的平衡转化率
的平衡转化率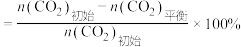
 的平衡产率
的平衡产率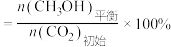
其中纵坐标表示
 平衡转化率的是图
平衡转化率的是图 、
、 、
、 由大到小的顺序为
由大到小的顺序为 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是(4)一定条件下,向体积为1L的恒容密闭容器中通入1mol
 和3mol
和3mol  发生上述反应,经10分钟达到平衡,此时
发生上述反应,经10分钟达到平衡,此时 的转化率为80%,且体系中
的转化率为80%,且体系中 。
。 的平均反应速率
的平均反应速率
 ,反应Ⅱ的平衡常数K=
,反应Ⅱ的平衡常数K=
您最近一年使用:0次
9 . 能量、速率和限度是认识和研究化学反应的重要视角。利用所学知识,回答下列问题:
(1)键能是表征化学键强度的物理量,可以用键断裂时所需能量的大小来衡量。从断键和成键的角度分析反应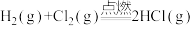 中能量的变化,化学键的键能如表所示:
中能量的变化,化学键的键能如表所示:
则生成1 mol 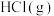 可以放出
可以放出_______ kJ热量。
(2)某温度时,在0.5 L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:
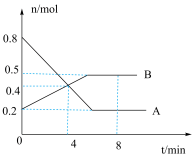
①该反应的化学方程式为_______ 。
②若降低温度,则该反应的正反应速率_______ (填“加快”“减慢”或“不变”,下同),逆反应速率_______ 。
③能判断该反应在一定温度下达到化学平衡状态的依据是_______ 。
a.容器中压强不变 b.混合气体中A的浓度不再改变
c.容器中气体密度不变 d.
④反应从开始至4 min时,用B的浓度变化来表示的反应速率为_______ 。
⑤平衡时A的转化率为_______ 。
(3)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。
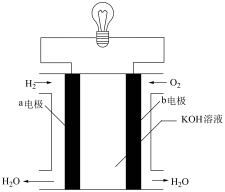
电池工作时,溶液中的 会向
会向_______ 区移动(填“正极”或“负极”),当外电路中转移1 mol电子时,消耗的 在标准状况下体积为
在标准状况下体积为_______ 。
(1)键能是表征化学键强度的物理量,可以用键断裂时所需能量的大小来衡量。从断键和成键的角度分析反应
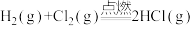 中能量的变化,化学键的键能如表所示:
中能量的变化,化学键的键能如表所示:| 化学键 |  |  |  |
键能(kJ•mol ) ) | 436 | 243 | 431 |
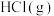 可以放出
可以放出(2)某温度时,在0.5 L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:

①该反应的化学方程式为
②若降低温度,则该反应的正反应速率
③能判断该反应在一定温度下达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中A的浓度不再改变
c.容器中气体密度不变 d.

④反应从开始至4 min时,用B的浓度变化来表示的反应速率为
⑤平衡时A的转化率为
(3)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

电池工作时,溶液中的
 会向
会向 在标准状况下体积为
在标准状况下体积为
您最近一年使用:0次
名校
解题方法
10 . 可逆反应aA(g)+bB(g)⇌ cC(g)+dD(g)△H同时符合下列两图中各曲线的是


| A.a+b>c+d T1>T2 △H>0 | B.a+b>c+d T1<T2 △H<0 |
| C.a+b<c+d T1>T2 △H>0 | D.a+b<c+d T1<T2 △H<0 |
您最近一年使用:0次
2019-12-19更新
|
1812次组卷
|
51卷引用:广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)
广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)广东省惠州市博罗县2022-2023学年高二上学期期中考试化学试题广东省深圳市光明区高级中学2023-2024学年高二上学期10月月考化学试题广东省普宁二中实验学校2023-2024学年高二上学期第三次月考化学试题(已下线)2011届湖南省十二校联考高三上学期第一次考试化学试卷(已下线)2012-2013学年山东济宁鱼台一中高二上学期期中考试化学试卷(已下线)2013-2014学年安徽师大附中高二下学期期中考查化学试卷(已下线)2013-2014学年福建省长乐第一中学高二上学期第二次月考化学试卷2015-2016学年湖北省襄州区一中高二上学期10月月考化学试卷2016届黑龙江省哈尔滨三十二中高三上学期期末考试化学试卷2016-2017学年湖南省衡阳一中高二上10月月考化学卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷河北省正定中学2016-2017学年高一下学期期末考试化学试题【区级联考】天津市武清区2018-2019学年高二上学期期中质量调查化学试题浙江省宁波市余姚中学2018-2019学年高二上学期期中考试化学试题陕西省渭南市渭南中学2018-2019学年高二上学期第三次月考化学试题山东省沂水外国语2018-2019学年高二上学期第三次月考化学试卷青海省海东市第二中学2018-2019学年高一下学期期中考试化学试题辽宁省大连海湾高级中学2019-2020学年高二上学期第一次质量检测化学试题福建省莆田四中2019-2020学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析海南省海南枫叶国际学校2019-2020学年高二上学期期中考试化学试题江苏省盐城市大丰区新丰中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市会泽县第一中学2019-2020高二上学期开学考试化学试题河北省衡水市第十四中学2019-2020学年高二上学期第三次调研考试化学试题河北省新乐市第一中学2019-2020学年高二上学期第二次月考化学试题山东省枣庄市滕州市第一中学2019-2020高二上学期期末考试化学试题辽宁省大连市瓦房店市实验高级中学2020-2021学年高二上学期10月月考化学试题吉林省吉林市第二中学2021届高三上学期9月份考试化学试题山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题天津市宝坻九中2020-2021学年高二上学期第一次月考化学试题天津市静海瀛海学校2020-2021学年高二上学期11月联考化学试题四川省成都市实验外国语学校(西区)2020-2021学年高二上学期12月月考化学测试卷福建省泉州市2020-2021学年高二上学期期末教学质量跟踪监测化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高二上学期期中考试化学(理)试题安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题陕西省咸阳市泾干中学2021-2022学年高二上学期第二次月考化学试题山西省运城市芮城中学2021-2022学年高二上学期阶段性月考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题河南省新蔡县第一高级中学2021-2022学年高二上学期9月月考化学试题湖南省临澧县第一中学2021-2022学年高二上学期期中段考化学试题(已下线)2.3.3 化学平衡中的图像问题(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)湖南省常德市临澧县第一中学2021-2022学年高二上学期期中考试化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题湖南省宁远县第一中学2022-2023学年高二上学期第一次适应性考试化学试题北京市陈经纶中学2022-2023学年高二10月月考化学试题陕西省渭南市尚德中学2022-2023学年高二上学期第一次质量检测化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题湖南省株洲市第一中学2022-2023学年高二上学期期末考试化学试题黑龙江省哈尔滨市兆麟中学2023-2024学年高二上学期第一次月考化学试题青海省西宁市海湖中学2023-2024学年高二下学期开学考试化学试卷