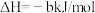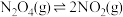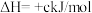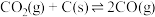真题
解题方法
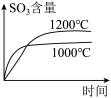
1 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1
b)CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
c)CH4(g) C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3
d)2CO(g) CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4
e)CO(g)+H2(g) H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=_______ (写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______ 。
A. 增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B. 移去部分C(s),反应c、d、e的平衡均向右移动
C. 加入反应a的催化剂,可提高CH4的平衡转化率
D. 降低反应温度,反应a~e的正、逆反应速率都减小
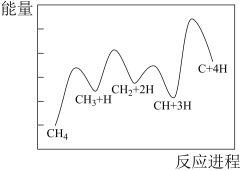
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分_______ 步进行,其中,第_______ 步的正反应活化能最大。
(4)设K 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
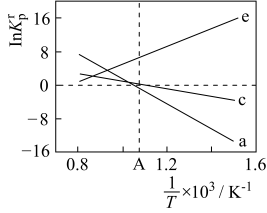
①反应a、c、e中,属于吸热反应的有_______ (填字母)。
②反应c的相对压力平衡常数表达式为K =
=_______ 。
③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程_______ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:_______ 。
a)CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1b)CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2c)CH4(g)
 C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3d)2CO(g)
 CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4e)CO(g)+H2(g)
 H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5(1)根据盖斯定律,反应a的∆H1=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有
A. 增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B. 移去部分C(s),反应c、d、e的平衡均向右移动
C. 加入反应a的催化剂,可提高CH4的平衡转化率
D. 降低反应温度,反应a~e的正、逆反应速率都减小
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分

(4)设K
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为K
 =
=③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程
(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近半年使用:0次
2021-06-11更新
|
13153次组卷
|
11卷引用:2021年新高考广东化学高考真题
2021年新高考广东化学高考真题(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向18 化学反应与能量变化-备战2022年高考化学一轮复习考点微专题2021年广东省高考化学试卷变式题11-21(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编(已下线)考点23 化学平衡常数-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题17 原理综合题(已下线)专题17 原理综合题
名校
2 . 工业上可用“氨催化氧化法”生产NO,以氨气、氧气为原料,在Pt-Rh合金催化剂存在下生成NO和副产物N2,两个竞争反应化学方程式如下:
Ⅰ.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
Ⅱ.4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
现将1molNH3、1.45molO2充入1L恒容密闭容器中,在上述催化剂作用下反应,相同时间内有关生成物物质的量随温度变化曲线如图所示: ×100%
×100%
下列说法不正确的是
Ⅰ.4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)Ⅱ.4NH3(g)+3O2(g)
 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)现将1molNH3、1.45molO2充入1L恒容密闭容器中,在上述催化剂作用下反应,相同时间内有关生成物物质的量随温度变化曲线如图所示:

 ×100%
×100%下列说法不正确的是
| A.400℃时,主要发生反应Ⅱ |
| B.由图分析工业上用氨催化氧化制备HNO3,最佳温度约为840℃ |
| C.520℃时,NH3的有效转化率约为66.7% |
| D.840℃后,NO的物质的量下降,可能是反应I平衡逆向移动所致 |
您最近半年使用:0次
2023-04-12更新
|
929次组卷
|
7卷引用:北京市顺义区2023届高三下学期第二次化学统练题
北京市顺义区2023届高三下学期第二次化学统练题北京市第八中学2023-2024学年高三上学期期中练习化学试题(已下线)20231218+12月月考1737051759696343040北京市第十四中学2023-2024学年高三上学期12月月考化学试题(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)北京师范大学实验中学2023-2024学年高三上学期12月月考化学试卷(已下线)FHgkyldyjhx07
解题方法
3 . 一定温度下,在 的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的曲线如图所示。下列描述正确的是
的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的曲线如图所示。下列描述正确的是
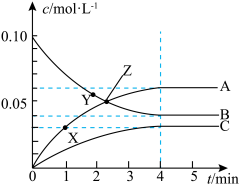
 的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的曲线如图所示。下列描述正确的是
的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的曲线如图所示。下列描述正确的是
A.X点的 Y点的 Y点的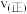 | B.Z点时反应达到平衡状态 |
| C.B的平衡转化率为30% | D.保持温度、体积不变, 时充入 时充入 ,正逆反应速率均增大 ,正逆反应速率均增大 |
您最近半年使用:0次
4 . 工业上可通过甲醇羰基化法制取甲酸甲酯(HCOOCH3):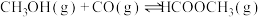 ,在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化)。下列说法不合理的是
,在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化)。下列说法不合理的是
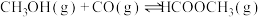 ,在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化)。下列说法不合理的是
,在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化)。下列说法不合理的是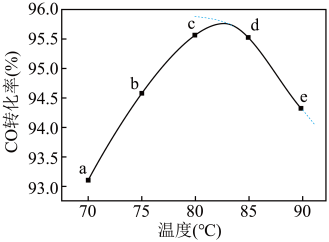
| A.适当增大压强可增大甲醇的平衡转化率 |
B.c点反应速率 |
C.反应速率 ,平衡常数 ,平衡常数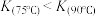 |
| D.生产时反应温度控制在80~85℃为宜 |
您最近半年使用:0次
2023-02-11更新
|
665次组卷
|
7卷引用:山西省临汾市2022-2023学年高二下学期开学考试化学试题
5 . 在体积均为1.0L的恒容密闭容器甲、乙中,起始投料量如表,在不同温度下发生反应:CO2(g)+C(s) 2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是
2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是

 2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是
2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是| 容器 | n(CO2)/mol | n(C)/mol | n(CO)/mol |
| 甲 | 0.1 | 0.3 | 0 |
| 乙 | 0 | 0 | 0.4 |

| A.曲线Ⅰ对应的是甲容器 |
| B.a、b两点所处状态的压强大小关系:9pa>14pb |
C.c点:CO的体积分数>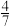 |
| D.900K时,若起始向容器乙中加入CO、CO2、C各1mol,则v(正)>v(逆) |
您最近半年使用:0次
2021-12-27更新
|
2448次组卷
|
15卷引用:上海市金山区2022届高三一模化学试题
上海市金山区2022届高三一模化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)江西省宜春市奉新县第一中学2021-2022学年高二下学期第一次月考化学试题上海市育才中学2022-2023学年高三上学期10月月考化学试题山东省青岛第二中学2022-2023学年高二上学期期中考试化学试题辽宁省大连市滨城高中联盟2022-2023学年高二上学期期中考试化学试题湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题湖南省攸县第二中学2022-2023学年高三第六次月考化学试题湖南省攸县第三中学2022-2023学年高三第六次月考化学试题湖南省常德市第一中学2023届高三第五次月考化学试题山东省滕州市第一中学2023-2024学年高二上学期10月月考化学试题河南省周口恒大中学2023-2024学年高二上学期9月月考化学试题安徽省安庆市第二中学2023-2024学年高二上学期期中考试化学试卷(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
解题方法
6 . 下列四图中,曲线变化情况与所给反应 、
、 、
、 、
、 均大于
均大于 相对应的是
相对应的是
A | B | C | D |
|
|
|
|
|
|
|
|
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-02-02更新
|
654次组卷
|
13卷引用:【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期期中考试化学试题1
【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期期中考试化学试题1广东省广州市第八十九中学2020-2021学年高二上学期期中考试化学试题江西省靖安中学2019-2020学年高二上学期第一次月考化学试题广东省佛山市第一中学2021-2022学年高二上学期第一次段考化学试题 浙江省精诚联盟2022-2023学年高二上学期10月联考化学试题湖南省长郡中学2022-2023学年高二上学期第一次月考化学试题广东省佛山市第一中学2022-2023学年高二上学期10月月考化学试题广东省惠州市实验中学2022-2023学年高二上学期期中考试化学试题湖北省襄阳东风中学2021-2022学年高二上学期10月月考化学试题广东省湛江市第二十一中学2022-2023学年高二上学期期中考试化学试题广东省松湖莞中、深大附中两校2023-2024学年高二上学期10月联考化学试题辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题福建省龙岩市永定区城关中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
7 . NO和O2混合后可发生反应:①2NO(g)+O2(g)=2NO2(g),②2NO2(g)⇌N2O4(g)反应体系中含氮物质的物质的量浓度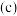 随着时间
随着时间 的变化曲线如图。下列说法正确的是
的变化曲线如图。下列说法正确的是
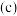 随着时间
随着时间 的变化曲线如图。下列说法正确的是
的变化曲线如图。下列说法正确的是
A.c为c(NO2)随 的变化曲线 的变化曲线 |
B. 时,反应①达到化学平衡状态 时,反应①达到化学平衡状态 |
C. 时,c(NO)+c(NO2)+c(N2O4)=c0 时,c(NO)+c(NO2)+c(N2O4)=c0 |
D. 后,NO2的消耗速率等于生成速率 后,NO2的消耗速率等于生成速率 |
您最近半年使用:0次
2022-03-07更新
|
1283次组卷
|
7卷引用:广东省广州市执信中学2022届高三下学期联考化学试题
广东省广州市执信中学2022届高三下学期联考化学试题湖南省长郡中学2021-2022学年高一下学期选考科目调研考试化学试题(已下线)2022年广东卷高考真题变式题(11-16)(已下线)第21练 新高考模式综合练(广东卷)-2022年【暑假分层作业】高二化学(2023届一轮复习通用)广东省广州市第一中学2022-2023学年高二上学期期中考试化学试题广东省佛山市顺德区罗定邦中学2023-2024学年高二上学期期中考试化学试题广东省茂名市高州中学2023-2024学年高二上学期期中考试化学试题(1-3班)
8 . 工业合成氨反应具有非常重要的意义。
(1)已知: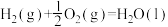


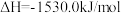
则合成氨反应的热化学方程式为___________ 。
(2)在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:
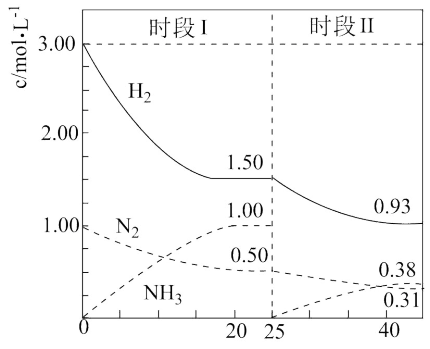
前20min内
___________  ,放出的热量为
,放出的热量为___________ ,25min时采取的措施是___________ 。
(3)对可逆反应 ,若起始投料
,若起始投料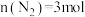 、
、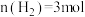 ,达到平衡后,增大压强,
,达到平衡后,增大压强, 的体积分数
的体积分数___________ (填“增大”“减小”或“不变”)
(4)T℃,以 和
和 为原料可合成化肥尿素:
为原料可合成化肥尿素: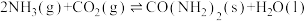 ;在2L的密闭容器中,通入1.2mol
;在2L的密闭容器中,通入1.2mol 和0.6mol
和0.6mol ,2min时反应刚好达到平衡。此时,
,2min时反应刚好达到平衡。此时, ,
, 。
。
①该反应的平衡常数是___________ 。
②若2min时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6mol ,则此时平衡
,则此时平衡___________ (填“正向移动”“逆向移动”或“不移动”)
(1)已知:
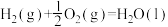


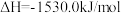
则合成氨反应的热化学方程式为
(2)在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:

前20min内

 ,放出的热量为
,放出的热量为(3)对可逆反应
 ,若起始投料
,若起始投料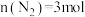 、
、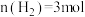 ,达到平衡后,增大压强,
,达到平衡后,增大压强, 的体积分数
的体积分数(4)T℃,以
 和
和 为原料可合成化肥尿素:
为原料可合成化肥尿素: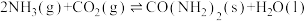 ;在2L的密闭容器中,通入1.2mol
;在2L的密闭容器中,通入1.2mol 和0.6mol
和0.6mol ,2min时反应刚好达到平衡。此时,
,2min时反应刚好达到平衡。此时, ,
, 。
。①该反应的平衡常数是
②若2min时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6mol
 ,则此时平衡
,则此时平衡
您最近半年使用:0次
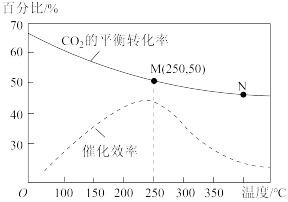
9 . 在1L恒容密闭容器中充入体积比为3:1的H2和CO2,二者在催化剂、加热条件下反应可以合成乙烯:6H2+2CO2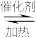 CH2=CH2+4H2O(g)△H<0,不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是
CH2=CH2+4H2O(g)△H<0,不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是
 CH2=CH2+4H2O(g)△H<0,不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是
CH2=CH2+4H2O(g)△H<0,不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是
| A.N点的反应速率一定比M点大 |
| B.M点时,产物乙烯的体积分数约为7.7% |
| C.其他条件相同时,N点的平衡常数比M点的大 |
| D.N点对应温度下的催化剂的催化效率比M点对应温度下的高 |
您最近半年使用:0次
2021-01-19更新
|
1226次组卷
|
6卷引用:河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研二化学试题
河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研二化学试题(已下线)第2章 化学反应速率与化学平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)广东省茂名市“五校联盟” 2021-2022学年高二上学期期末联考(创新班)化学试题黑龙江省七台河市勃利县高级中学2022-2023学年高二上学期期中考试化学试题河南省鹤壁市高中2022-2023学年高二上学期10月居家测试化学试题重庆市松树桥中学校2023-2024学年高二上学期半期考试(期中)化学试题
10 . 体积均为1.0L的甲、乙两个恒容密闭容器,向甲中加入0.1molCO2和0.3mol碳粉,向乙中加入0.4molCO,在不同温度下发生反应:CO2(g)+C(s) 2CO(g)。达到平衡时CO的物质的量浓度随温度的变化如图所示。下列说法正确的是
2CO(g)。达到平衡时CO的物质的量浓度随温度的变化如图所示。下列说法正确的是
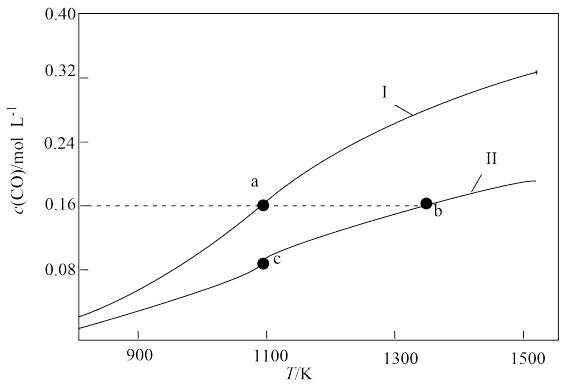
 2CO(g)。达到平衡时CO的物质的量浓度随温度的变化如图所示。下列说法正确的是
2CO(g)。达到平衡时CO的物质的量浓度随温度的变化如图所示。下列说法正确的是
| A.曲线II对应的是乙容器 |
| B.a、b两点对应平衡体系中的压强之比:pa:pb<14:9 |
C.b点对应的平衡体系中,CO的体积分数小于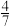 |
| D.900K时,起始时向容器乙中加入CO、CO2、碳粉各1mol,此时v正﹥v逆 |
您最近半年使用:0次
2020-12-23更新
|
1853次组卷
|
3卷引用:安徽省舒城中学2020-2021学年高二上学期第三次月考化学试题