1 . 第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2(g)+O2(g) 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1
反应H2(g)+Se(s) H2Se(g)的反应热△H=
H2Se(g)的反应热△H=___________ kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s) H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是___________ (填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
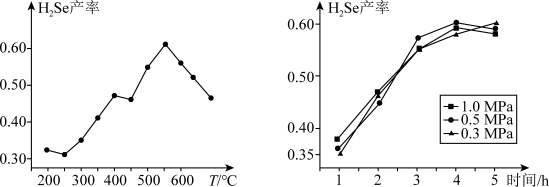
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:___________ 。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈___________ (填“酸性”或“碱性”),该溶液中的物料守恒关系式为___________ 。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________ ,最后通入SO2析出硒单质。
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=___________ (保留2位有效数字)。
(1)已知:①2H2Se(g)+O2(g)
 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1②2H2(g)+O2(g)
 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1反应H2(g)+Se(s)
 H2Se(g)的反应热△H=
H2Se(g)的反应热△H=(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s)
 H2Se(g),
H2Se(g),①下列情况可判断反应达到平衡状态的是
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq)
 CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=
您最近半年使用:0次
解题方法
2 . 油气开采、煤化工等行业的硫化氢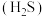 废气转化为
废气转化为 (熔点
(熔点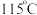 )是资源利用和环境保护的重要研究课题。
)是资源利用和环境保护的重要研究课题。

Ⅰ.高温热分解法: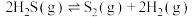
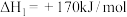
(1) 分解所得
分解所得 ,在低温高压时和氢气反应得到一种新型超导材料(晶胞如图-1所示)。该物质化学式为
,在低温高压时和氢气反应得到一种新型超导材料(晶胞如图-1所示)。该物质化学式为_______ 。
Ⅱ.克劳斯法: 时,
时,
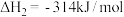
(2)其他条件不变时,相同时间内 的产率随
的产率随 值的变化如图-2所示。当
值的变化如图-2所示。当 时,
时, 产率随
产率随 值增大而减小的可能原因是
值增大而减小的可能原因是_______ 。
Ⅲ.用 脱除法。
脱除法。
(3)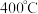 时,将
时,将 和
和 混合气体以一定流速通过装有
混合气体以一定流速通过装有 脱硫剂的反应器,得到
脱硫剂的反应器,得到 和
和 。
。
①该反应的化学方程式为_______ 。
②取反应后的固体,在 的混合气体中加热再生,
的混合气体中加热再生, 随温度变化的曲线如图-3所示。在
随温度变化的曲线如图-3所示。在 范围内,固体质量减小的主要原因:(ⅰ)
范围内,固体质量减小的主要原因:(ⅰ) 和
和 被氧化成
被氧化成 ;(ⅱ)
;(ⅱ)_______ 。

Ⅳ.电化学脱除法
(4)我国科学家设计了 协同转化装置(右侧电解质溶液中含有
协同转化装置(右侧电解质溶液中含有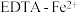 ),实现对天然气中
),实现对天然气中 和
和 的高效去除,工作原理如图-4所示。
的高效去除,工作原理如图-4所示。

①电极 上发生的电极式为
上发生的电极式为_______ 。
②在图-4中,图右侧的反应可描述为_______ 。
 废气转化为
废气转化为 (熔点
(熔点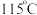 )是资源利用和环境保护的重要研究课题。
)是资源利用和环境保护的重要研究课题。
Ⅰ.高温热分解法:
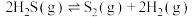
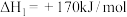
(1)
 分解所得
分解所得 ,在低温高压时和氢气反应得到一种新型超导材料(晶胞如图-1所示)。该物质化学式为
,在低温高压时和氢气反应得到一种新型超导材料(晶胞如图-1所示)。该物质化学式为Ⅱ.克劳斯法:
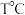 时,
时,
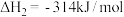
(2)其他条件不变时,相同时间内
 的产率随
的产率随 值的变化如图-2所示。当
值的变化如图-2所示。当 时,
时, 产率随
产率随 值增大而减小的可能原因是
值增大而减小的可能原因是
Ⅲ.用
 脱除法。
脱除法。(3)
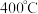 时,将
时,将 和
和 混合气体以一定流速通过装有
混合气体以一定流速通过装有 脱硫剂的反应器,得到
脱硫剂的反应器,得到 和
和 。
。①该反应的化学方程式为
②取反应后的固体,在
 的混合气体中加热再生,
的混合气体中加热再生, 随温度变化的曲线如图-3所示。在
随温度变化的曲线如图-3所示。在 范围内,固体质量减小的主要原因:(ⅰ)
范围内,固体质量减小的主要原因:(ⅰ) 和
和 被氧化成
被氧化成 ;(ⅱ)
;(ⅱ)
Ⅳ.电化学脱除法
(4)我国科学家设计了
 协同转化装置(右侧电解质溶液中含有
协同转化装置(右侧电解质溶液中含有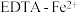 ),实现对天然气中
),实现对天然气中 和
和 的高效去除,工作原理如图-4所示。
的高效去除,工作原理如图-4所示。
①电极
 上发生的电极式为
上发生的电极式为②在图-4中,图右侧的反应可描述为
您最近半年使用:0次
名校
解题方法
3 . 丙烯(C3H6)是重要的有机化工原料。丙烷直接脱氢制丙烯发生的主要反应及能量变化如图:
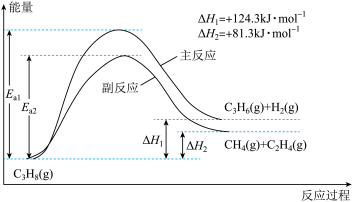
回答下列问题:
(1)丙烷直接脱氢制丙烯为强吸热过程,该反应必须在高温下进行,但温度越高副反应进行程度越大,同时还会降低催化剂的活性和选择性。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)___ (填“增大”、“减小”或“不变”)。
②温度升高,副反应更容易发生的主要原因是_______ 。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强p1、p2分别为1×104 Pa和1×105 Pa)。
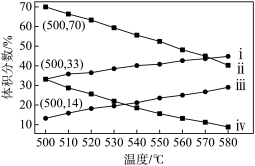
①1×104 Pa时,如图中表示丙烯的曲线是____ (填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②1×105Pa、500℃时,若只发生上述主反应和副反应,则达平衡时,丙烷转化为丙烯的转化率为____ 。
(3)为克服丙烷直接脱氢法的缺点,科学家探索出在无机膜反应器中进行丙烷脱氢制丙烯的技术。在膜反应器中,利用特定功能膜将生成的氢气从反应区一侧有选择性地及时移走。与丙烷直接脱氢法相比,该方法的优点是__________ 。
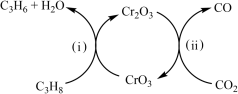
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
已知:CO和H2的燃烧热分别为△H =-283.0kJ/mol、△H =-285.8kJ/mol。
①反应(ⅰ)的化学方程式为_____ 。
②25℃时,该工艺总反应的热化学方程式为________ 。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是_______ 。

回答下列问题:
(1)丙烷直接脱氢制丙烯为强吸热过程,该反应必须在高温下进行,但温度越高副反应进行程度越大,同时还会降低催化剂的活性和选择性。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)
②温度升高,副反应更容易发生的主要原因是
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强p1、p2分别为1×104 Pa和1×105 Pa)。

①1×104 Pa时,如图中表示丙烯的曲线是
②1×105Pa、500℃时,若只发生上述主反应和副反应,则达平衡时,丙烷转化为丙烯的转化率为
(3)为克服丙烷直接脱氢法的缺点,科学家探索出在无机膜反应器中进行丙烷脱氢制丙烯的技术。在膜反应器中,利用特定功能膜将生成的氢气从反应区一侧有选择性地及时移走。与丙烷直接脱氢法相比,该方法的优点是
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0kJ/mol、△H =-285.8kJ/mol。
①反应(ⅰ)的化学方程式为
②25℃时,该工艺总反应的热化学方程式为
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
您最近半年使用:0次
2019-04-24更新
|
495次组卷
|
2卷引用:【市级联考】四川省攀枝花市2019届高三下学期第三次统考理科综合化学试题
4 . 工业废水中常含有一定量的Cr2O ,易被人体吸收累积而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
,易被人体吸收累积而导致肝癌。处理工业含铬废水的方法通常是将Cr2O 转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。已知元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)
转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。已知元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH) (绿色)、Cr2O
(绿色)、Cr2O (橙红色)、CrO
(橙红色)、CrO (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体。
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体。
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是____
(2)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理:_______________
(3)Cr3+在强碱中可被双氧水氧化为CrO ,发生反应的离子方程式为
,发生反应的离子方程式为___________
(4)CrO 和Cr2O
和Cr2O 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1 的Na2CrO4溶液中c(Cr2O
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1 的Na2CrO4溶液中c(Cr2O )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
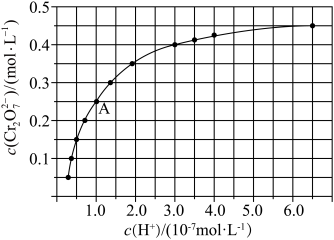
①由图可知,溶液酸性增大,CrO 的平衡转化率
的平衡转化率_________ (填“增大“减小”或“不变”),
② 据A点数据,计算出该转化反应的平衡常数__________ 。
 ,易被人体吸收累积而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
,易被人体吸收累积而导致肝癌。处理工业含铬废水的方法通常是将Cr2O 转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。已知元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)
转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。已知元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH) (绿色)、Cr2O
(绿色)、Cr2O (橙红色)、CrO
(橙红色)、CrO (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体。
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体。(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
(2)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理:
(3)Cr3+在强碱中可被双氧水氧化为CrO
 ,发生反应的离子方程式为
,发生反应的离子方程式为(4)CrO
 和Cr2O
和Cr2O 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1 的Na2CrO4溶液中c(Cr2O
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1 的Na2CrO4溶液中c(Cr2O )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
①由图可知,溶液酸性增大,CrO
 的平衡转化率
的平衡转化率② 据A点数据,计算出该转化反应的平衡常数
您最近半年使用:0次



