1 . 要除去CuCl2溶液中的Fe3+ ,甲同学不知道调整溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,通过调节溶液pH除去Fe3+而不损失Cu2+,调节pH的取值范围
| A.3≤pH<4 | B.3≤pH≤4 |
| C.2<pH≤3 | D.2≤pH<3 |
您最近一年使用:0次
名校
解题方法
2 . 向0.1 mol/LCH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起
| A.溶液的pH增大 | B.CH3COOH的电离程度增大 |
| C.溶液的导电能力减小 | D.溶液的c(OH-)减小 |
您最近一年使用:0次
2022-12-18更新
|
176次组卷
|
7卷引用:吉林省德惠市实验中学2022-2023学年高二上学期第三次月考化学试题
解题方法
3 . 室温时,pH=6的盐酸和pH=8的Na2CO3溶液中,水电离出的c(OH-)分别为xmol•L-1和ymol•L-1,两者的关系正确的是
| A.x=10‑2y | B.x=102y | C.x=y | D.x>y |
您最近一年使用:0次
2022-10-26更新
|
106次组卷
|
2卷引用:吉林省洮南市第一中学2022-2023学年高二上学期第一次(10月)月考化学试题
名校
解题方法
4 . 已知 时水的离子积常数
时水的离子积常数 ,对于该温度下
,对于该温度下 的硫酸,下列叙述正确的是
的硫酸,下列叙述正确的是
 时水的离子积常数
时水的离子积常数 ,对于该温度下
,对于该温度下 的硫酸,下列叙述正确的是
的硫酸,下列叙述正确的是A.向该溶液中加入同温同体积 的 的 溶液,反应后溶液呈中性 溶液,反应后溶液呈中性 |
B.该溶液中硫酸电离出的 与水电离出的 与水电离出的 之比为 之比为 |
C.等体积的该硫酸与室温下 为1的硫酸中和碱的能力相同 为1的硫酸中和碱的能力相同 |
D.该溶液中水电离出的 是同温下 是同温下 为3的硫酸中水电离出的 为3的硫酸中水电离出的 的100倍 的100倍 |
您最近一年使用:0次
2022-03-22更新
|
159次组卷
|
2卷引用:吉林省通化市辉南县第六中学2022-2023学年高二上学期第一次月考化学试题
名校
5 . 按要求填空。
(1)Fe(OH)3的Ksp的表达式:___________ ;
(2)H2CO3的电离方程式(第一步):___________ ;
(3)1molN2(g)与适量H2(g)完全反应生成NH3(g)放热92kJ,热化学方程式:___________ ;
(4)100℃时,KW=1×10-12的纯水中,c(H+)=___________ ;
(5)明矾可以净水,用离子方程式表示明矾净水的原理:___________ 。
(1)Fe(OH)3的Ksp的表达式:
(2)H2CO3的电离方程式(第一步):
(3)1molN2(g)与适量H2(g)完全反应生成NH3(g)放热92kJ,热化学方程式:
(4)100℃时,KW=1×10-12的纯水中,c(H+)=
(5)明矾可以净水,用离子方程式表示明矾净水的原理:
您最近一年使用:0次
名校
解题方法
6 . 常温下,将 溶液滴加到某二元弱酸(
溶液滴加到某二元弱酸( )中,混合溶
)中,混合溶 与
与 或
或 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是

 溶液滴加到某二元弱酸(
溶液滴加到某二元弱酸( )中,混合溶
)中,混合溶 与
与 或
或 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是
A. ( ( )的数量级为 )的数量级为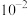 |
B.曲线M表示 与 与 的变化关系 的变化关系 |
C.常温时, 溶液显酸性 溶液显酸性 |
D.当混合溶液呈中性时, |
您最近一年使用:0次
2021-11-20更新
|
905次组卷
|
5卷引用:吉林省长春市十一高中2022-2023学年高二上学期第一学程考试化学试题
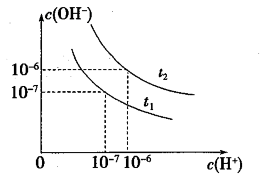
7 . 已知在 、
、 温度下水的电离平衡曲线如图所示,则下列说法中不正确的是
温度下水的电离平衡曲线如图所示,则下列说法中不正确的是
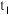 、
、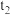 温度下水的电离平衡曲线如图所示,则下列说法中不正确的是
温度下水的电离平衡曲线如图所示,则下列说法中不正确的是

A.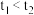 |
B.一定温度下,改变水溶液中 或 或  不会发生变化 不会发生变化 |
C.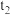 温度pH为2的HCl溶液中,水电离出的 温度pH为2的HCl溶液中,水电离出的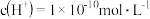 |
D.将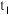 温度下 温度下 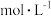 的盐酸稀释,溶液中所有离子的浓度均减小 的盐酸稀释,溶液中所有离子的浓度均减小 |
您最近一年使用:0次
2021-03-04更新
|
185次组卷
|
2卷引用:吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题
8 . 一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示,下列说法正确的是
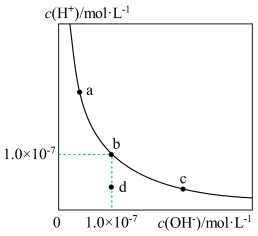

| A.升高温度,可能引起由c向b的变化 |
| B.该温度下,水的离子积常数为1.0×10-13 |
| C.该温度下,加入FeCl3可能引起由b向a的变化 |
| D.该温度下,稀释溶液可能引起由c向d的变化 |
您最近一年使用:0次
2021-02-27更新
|
2895次组卷
|
77卷引用:吉林省梅河口市朝鲜族中学2020-2021学年高二下学期第一次月考化学试题
吉林省梅河口市朝鲜族中学2020-2021学年高二下学期第一次月考化学试题2016届黑龙江省哈尔滨师大附属中学高三上12月月考化学试卷2015-2016学年浙江省东阳中学高二上学期12月阶段测化学试卷2016-2017学年河北省沧州一中高二上10月检测化学卷安徽省铜陵市第一中学2017-2018学年高二12月月考化学试题吉林省扶余市第一中学2017-2018学年高二上学期期末考试化学试题吉林省东北师范大学附属中学2017-2018学年高二上学期期末考试化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第二次月考化学试题安徽省天长市天长二中2018-2019学年高二第一学期12月月考化学试题山西省太原市太原师范学院附属中学2019-2020学年高二上学期12月月考理科化学试题宁夏回族自治区中卫市中宁县中宁中学2019-2020学年高二下学期阶段测试化学试题黑龙江省牡丹江市东宁市第一中学2020-2021学年高二上学期第一次月考化学试题江苏省南京市中华中学2020-2021学年高二上学期9月测试化学试题广西贵港市覃塘区覃塘高级中学2020-2021学年高二下学期3月月考化学试题辽宁省沈阳市郊联体2021-2022学年高二上学期10月月考化学试题安徽省亳州市涡阳县育萃高级中学2021-2022学年高二上学期第一次月考化学试题安徽省青阳县第一中学2021-2022学年高二下学期5月月考化学试题四川省成都外国语学校2022-2023学年高二上学期12月月考化学试题河南省信阳市第二高级中学2023-2024学年高二上学期10月阶段测试化学试题2015年全国普通高等学校招生统一考试化学(广东卷)2015-2016学年广东广州执信中学高二上期中理化学试卷2016届宁夏石嘴山三中高三上学期期末理综化学试卷2016届天津市河北区高三一模化学试卷2016-2017学年河北省冀州中学高二上期中化学卷2016-2017学年江西省师大附中高二上学期期中化学试卷2016-2017学年江西省景德镇市第一中学高二(素质班)上学期期末考试化学试卷2016-2017学年福建省漳州市第一中学高二上学期期末考试化学试卷2016-2017学年安徽省马鞍山二中高二下学期期中(理科)考试化学试卷山东省曲阜师范大学附属中学2017-2018学年高二上学期期中考试化学试题福建省福州市2016-2017学年高二上学期期中考试化学试题福建省宁德市2017-2018学年高二上学期期末模拟质量检测化学试题(已下线)二轮复习 专题11 水溶液中的离子平衡 押题专练(已下线)解密11 弱电解质的电离和溶液的酸碱性——备战2018年高考化学之高频考点解密(已下线)2018年12月31日 《每日一题》人教选修4-水的电离北京市海淀区101中学2018-2019学年下学期高二期中考试化学试题(已下线)第19天 水电离平衡的影响因素——《2019年暑假作业总动员》高二化学湖北省沙市中学2019-2020学年高二上学期期中考试化学(选考)试题江西省南昌市新建县第一中学2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——水的离子积常数的应用(强化练习)上海市宝山区2016届高三上学期期末教学质量检测化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训福建省福清市龙西中学2018-2019学年高二下学期期中考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 章末综合检测卷(已下线)3.2.1+水的电离和溶液的酸碱性-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 高考帮黑龙江省哈尔滨市呼兰区第一中学校等三校2020-2021学年高二上学期期末联考化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)青海省湟川中学2019-2020学年高二上学期期中考试化学试题河南省汤阴县五一中学2019-2020学年高二上学期期中考试化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时40 水的电离与溶液的酸碱性-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题25 水的电离和溶液的酸碱性(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第08练 水的电离和溶液的pH-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)江苏省徐州市第七中学2021-2022学年高二下学期期中考试化学试题广东省潮州市2022届高三下学期第二次模拟考试化学试题(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题11 水溶液中的离子反应与平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第22讲 水的电离与溶液的pH(练)-2023年高考化学一轮复习讲练测(新教材新高考)北京师范大学附属中学2020-2021学年高二上学期期中考试化学试题天津市天津中学2022-2023学年高二上学期线上期末考试化学试题(已下线)第一部分 二轮专题突破 专题14 溶液中的三大平衡及应用(已下线)题型131 水的电离平衡曲线(已下线)化学-2023年高考押题预测卷01(广东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第30讲水的电离和溶液的酸碱性(已下线)第2讲 溶液的酸碱性和pH计算(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)湖南省岳阳市华容县2023-2024学年高二上学期期末考试化学试题浙江省宁波三锋教研联盟2023-2024学年高二上学期期中联考化学试题
解题方法
9 . 弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),请回答下面问题:
(1)CH3COONH4的水溶液呈___ (选填“酸性”、“中性”或“碱性”)。理由是___ 。溶液中各离子浓度大小关系是___ 。
温度t℃时,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,请回答下列问题:
(2)该温度下水的离子积常数Kw=___ 。
(3)该NaOH溶液中由水电离出的c(OH-)是___ mol/L。
(4)给该NaOH溶液加热(水不挥发),pH=____ 。(填变大、变小或不变)
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
(1)CH3COONH4的水溶液呈
温度t℃时,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,请回答下列问题:
(2)该温度下水的离子积常数Kw=
(3)该NaOH溶液中由水电离出的c(OH-)是
(4)给该NaOH溶液加热(水不挥发),pH=
您最近一年使用:0次
名校
10 . 升高温度,下列数据不一定增大的是
| A.化学平衡常数 K | B.水的离子积 Kw |
| C.化学反应速率 | D.醋酸的电离平衡常数 Ka |
您最近一年使用:0次
2020-11-04更新
|
290次组卷
|
6卷引用:吉林省抚松县第一中学2021-2022学年高二上学期第二次月考(平行班)化学试题
吉林省抚松县第一中学2021-2022学年高二上学期第二次月考(平行班)化学试题吉林省梅河口市朝鲜族中学2019-2020学年高二上学期期末考试化学试题重庆市合川实验中学2020-2021学年高二上学期期中考试化学试题河北省石家庄第四十一中学2020-2021学年高二上学期期中考试化学试题(已下线)专题3.2.1 水的电离和溶液的酸碱性(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)黑龙江省牡丹江市第三高级中学2023-2024学年高二上学期期中考试化学试题



