名校
1 . 下列图示与对应的叙述相符的是( )
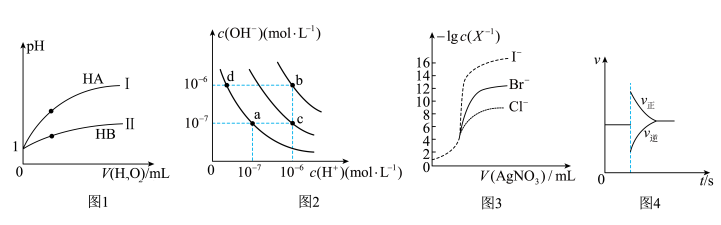

| A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+) |
| B.图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性 |
| C.用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
D.图4表示在N2(g)+3H2(g)  2NH3(g)达到平衡后,减小NH3浓度时速率的变化 2NH3(g)达到平衡后,减小NH3浓度时速率的变化 |
您最近一年使用:0次
2019-03-09更新
|
774次组卷
|
8卷引用:【校级联考】江西省上饶市重点中学2019届高三下学期第一次六校联考理科综合化学试题
【校级联考】江西省上饶市重点中学2019届高三下学期第一次六校联考理科综合化学试题【全国百强校】广西南宁市第三中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】福建省厦门市外国语学校2018-2019学年高二下学期期中考试化学试题江西省吉安市重点高中2018-2019学年高二下学期5月联考化学试题江西吉安市重点高中2019-2020学年高二上第一次联考化学试题西藏拉萨中学2019-2020学年高二上学期第三次月考理综化学试题(已下线)第三章 检测-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)河北省石家庄市第二十四中学2023-2024高二上学期期末考试化学试题
2 . 下列图示与对应的叙述正确的是( )
A. 若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右 若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右 |
B. 表示反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a 表示反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a |
C. 表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数 表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数 |
D. 表示25℃时,向0.1 mol•L﹣1的NH4Cl溶液中滴加0.1 mol•L﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系 表示25℃时,向0.1 mol•L﹣1的NH4Cl溶液中滴加0.1 mol•L﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系 |
您最近一年使用:0次
2019-03-04更新
|
589次组卷
|
2卷引用:【市级联考】江苏省扬州市2019届高三下学期一模考试化学试题
名校
3 . 根据下列图示所得出的结论正确的是( )
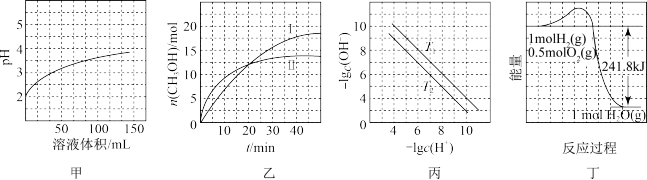

| A.图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸 |
B.图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ |
| C.图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2 |
| D.图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1 |
您最近一年使用:0次
2019-03-04更新
|
1120次组卷
|
6卷引用:【市级联考】江苏省南通市2019届高三上学期第一次模拟考试化学试题
名校
4 . 根据下列图示所得出的结论正确的是


A.图甲是在不同温度下三个恒容容器中反应2H2(g)+CO(g)  CH3OH(g) ΔH<0的平衡曲线,曲线X对应的温度相对较高 CH3OH(g) ΔH<0的平衡曲线,曲线X对应的温度相对较高 |
| B.图乙是一定温度下三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线,a点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-) |
| C.图丙为MOH和ROH两种一元碱水溶液在常温下分别加水稀释时pH的变化曲线,可知ROH是强碱 |
D.图丁为两个容器中在不同的压强下各投入1 mol CH4和1 molCO2所发生反应CH4(g)+CO2(g)  2CO(g)+2H2(g)的平衡曲线,N点化学平衡常数K=1 2CO(g)+2H2(g)的平衡曲线,N点化学平衡常数K=1 |
您最近一年使用:0次
2019-02-17更新
|
384次组卷
|
4卷引用:【校级联考】江苏省四校(姜堰中学、前中、淮阴中学、溧阳中学)2019届高三下学期第二学期联考化学试题
真题
名校
5 . 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。据图判断正确的是


| A.Ⅱ为盐酸稀释时pH值变化曲线 | B.b点溶液的导电性比c点溶液的导电性强 | C.a点Kw的数值比c点Kw的数值大 | D.b点酸的总浓度大于a点酸的总浓度 |
您最近一年使用:0次
2019-01-30更新
|
2990次组卷
|
80卷引用:2010年湖北省武汉市华中师大一附中高三五月适应性考试理综化学试题
(已下线)2010年湖北省武汉市华中师大一附中高三五月适应性考试理综化学试题2009年普通高等学校招生统一考试理综试题化学部分(山东卷)(已下线)2010年广西桂林十八中高二上学期期中考试化学卷(已下线)2010—2011学年辽宁省北镇高中高二上学期期末考试化学试卷(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年江西省安福中学高二上学期期中考试化学试卷(已下线)2011-2012学年辽宁省沈阳同泽女中高二上学期期中考试化学试卷(已下线)2011-2012学年山东省济宁市梁山二中高二上学期期中考试化学试卷(已下线)2011-2012学年河南省濮阳市高二上学期期末考试化学试卷(已下线)2011-2012学年山西省“晋商四校”高二下学期联考化学试卷(已下线)2011-2012学年江西省白鹭洲中学高二下学期第三次月考化学试卷(已下线)2013-2014学年广东省佛山市高二上学期普通高中质量检测化学试卷(已下线)2014届山东省济南一中高二上学期期末考试化学试卷 (已下线)2014-2015学年黑龙江大庆铁人中学高二上期中考试化学卷(已下线)2015届黑龙江省牡丹江第一高中高二上学期期中考试化学(理)试卷(已下线)2014-2015学年黑龙江省绥化市三校高二上学期期中化学试卷2016届安徽省安庆市第二中学高三上学期第一次质检化学试卷2015-2016学年山东寿光现代中学高二上12月月考化学卷2015-2016学年四川省成都市六校高二上学期期中联考化学试卷2015-2016学年江苏省射阳县第二中学高二上学期期末选修化学试卷2015-2016学年河北省唐山市高二上学期期末考试化学试卷2015-2016学年湖北省孝感市六校教学联盟高二上期末联考化学试卷2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷2016-2017学年山东省寿光现代中学高二12月月考化学卷2黑龙江省哈尔滨市第三中学2018届高三上学期(10月)第二次验收考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二12月月考化学试题(A卷)山东省寿光现代中学2017-2018学年高二12月月考化学试题甘肃省天水市第一中学2017-2018学年高二下学期入学考试化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】山西省忻州第一中学2018-2019学年高二上学期第一次月考化学试题河北省唐山市第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】河北省武邑中学2019届高三上学期期中考试化学试题吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题云南省大理市下关一中2018-2019学年高二上学期期中考试化学试题【全国百强校】山西省忻州市第一中学2018-2019学年高二上学期第一次月考化学试题【校级联考】吉林省辽源市田家炳高级中学(第六十六届友好学校)2018-2019学年高二上学期期末联考化学试题宁夏回族自治区长庆高级中学2018-2019学年高二上学期期末考试化学试题【全国百强校】内蒙古杭锦后旗奋斗中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题江苏省启东中学2019-2020学年高二上学期第一次质量检测化学试题辽宁省大连市旅顺口区2018-2019学年高二上学期期中考试化学试题安徽省阜阳市颍上二中2019-2020学年高二上学期第二次段考化学试题步步为赢高二化学寒假作业:作业八 溶液的酸黑龙江省哈尔滨工业大学附属中学2019-2020学年高二上学期期末考试化学试题山东省淄博市淄川区般阳中学2019-2020学年高二上学期期中考试化学试题(已下线)上海市闸北区2012届高三上学期期末化学试题江苏苏州市第四中学2019-2020学年高二下学期5月自学能力测试化学试题(已下线)【南昌新东方】江西省九江一中2014-2015学年高二上学期期中化学试卷人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 作业帮吉林省长春市第七中学2020-2021学年高二上学期第一次月考化学试题河南省洛阳市豫西名校2020-2021学年高二上学期第一次联考化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 易错疑难集训(一)新疆昌吉州教育共同体2020-2021学年高二上学期期中考试化学试题吉林省油田高级中学2020-2021学年高二上学期期初考试化学试题重庆市育才中学校2020-2021学年高二上学期10月月考化学试题江苏省南京市中华中学2020-2021学年高二上学期9月测试化学试题广东省广州市禺山高级中学2020-2021学年高二下学期第一阶段考试化学试题黑龙江省大庆中学2021-2022学年高二上学期第一次月考化学试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期期中考试化学试题吉林省长春市农安县2021-2022学年高二上学期期末考试化学试题(已下线)3.2.2 溶液pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)吉林省延边朝鲜族自治州汪清县汪清第四中学2021-2022学年高二上学期第二次阶段考试化学试题福建省莆田市莆田第十五中学2021-2022学年高二下学期第一次月考化学试题湖南省常德市石门县第一中学2021-2022学年高一下学期期中考试化学试题辽宁省阜新市第二高级中学2021-2022学年高二上学期期末考试化学试题湖南省邵东创新实验学校2021-2022学年高二上学期期中考试化学试题福建省莆田第七中学2021-2022学年高二下学期期中考试化学试题天津市西青区杨柳青第一中学2022-2023学年高二上学期第一次适应性测试化学试题浙江省北斗联盟2022-2023学年高二上学期期中联考化学试题湖北省武汉市东湖中学2022-2023学年高二上学期期中考试化学试题(已下线)3.2.2 pH计算和酸碱中和滴定-同步学习必备知识内蒙古自治区呼伦贝尔市鄂温克族自治旗第三中学2021-2022学年高二上学期第一次月考化学试题宁夏回族自治区银川市北方民族大学附属中学2020-2021学年高二下学期3月月考化学试题广东省广州市从化区从化中学2022-2023学年高二上学期期中考试化学试题广西河池市罗城仫佬族自治县高级中学等2校2022-2023学年高二上学期12月月考化学试题辽宁省沈阳市第二中学2023-2024学年高二上学期10月阶段考试化学试题天津市第五十四中学2023-2024学年高二上学期11月期中考试化学试题江苏省南菁高级中学2023-2024学年高二上学期10月考试化学试题陕西省延安市延川县中学2023-2024学年高二上学期第一次月考化学试题2023-2024学年高二上学期化学期中考试试卷
名校
6 . 室温下,下列有关两种溶液的说法不正确的是
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A.①②两溶液中c(OH-)相等 |
| B.①②两溶液中水的电离程度相同 |
| C.等体积的①②两溶液分别与0.01mol·L-1的盐酸完全中和,消耗盐酸的体积:①>② |
| D.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①<② |
您最近一年使用:0次
名校
7 . 下列说法不正确的是
| A.1L浓度为0.1mol/L的NH4Cl溶液阳离子数目多于氯离子数目 |
| B.比较浓度均为0.1mol·L-1的HI和醋酸溶液的导电能力可判断HI为强酸 |
| C.常温下,pH=3的醋酸溶液水加稀释1000倍后溶液的pH<6 |
| D.常温下,同体积的pH=9的NaClO溶液和pH=5的NH4Cl溶液水电离的OH-数相同 |
您最近一年使用:0次
2018-03-29更新
|
468次组卷
|
4卷引用:2018年3月浙江省暨阳联考化学试题
名校
解题方法
8 . 下图所示与对应叙述不相符的是


| A.图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) >Ksp(CuS) |
| B.图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸>乙酸 |
| C.图丙用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1 |
D.图丁表示反应N2(g)+3H2(g)  2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2) 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2) |
您最近一年使用:0次
2018-03-26更新
|
403次组卷
|
2卷引用:宁夏石嘴山市第三中学2018届高三下学期第一次模拟考试理科综合化学试题
名校
9 . T℃,分别向10ml浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH) 与溶液浓度的对数(lgc) 的关系如图所示。下列叙述正确的是
已知:(1)HA的电离平衡常数Ka=[c(H+)·c(A-)]/[c(HA)-c(A-)]≈c2(H+)/c(HA);(2) pKa=-lgKa

已知:(1)HA的电离平衡常数Ka=[c(H+)·c(A-)]/[c(HA)-c(A-)]≈c2(H+)/c(HA);(2) pKa=-lgKa

| A.弱酸的Ka随溶液浓度的降低而增大 |
| B.a 点对应的溶液中c(HA)=0.1mol/L,pH=4 |
| C.酸性:HA<HB |
| D.弱酸HB的 pKa=5 |
您最近一年使用:0次
2018-02-06更新
|
486次组卷
|
3卷引用:河北省衡水中学2018届高三上学期九模考试理科综合化学试题
10 . 图象常作为描述化学过程的一种方法,在化学中大量运用。下列有关图象的说法正确的是

| A.图Ⅰ表示V L 0.1mol/L的氨水中滴加某种浓度的盐酸时,溶液pH的变化情况 |
| B.图Ⅱ表示SO2与O2的可逆反应,t2时刻条件的改变可能是压强 |
| C.图Ⅲ表示一个气体总体积减小的可逆反应中,压强与反应速率的关系 |
| D.图Ⅳ表示某种放热反应,反应热为49.0kJ |
您最近一年使用:0次



