2021高三·全国·专题练习
解题方法
1 . 有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作是___________ (填“正确的”或“不正确的”),其理由是___________ 。
(2)如不正确,请分析是否一定有误差___________ 。
(3)若用此法分别测定[H+]相等的盐酸和醋酸溶液的pH,误差较大的是___________ ,原因是___________ 。
(1)该学生的操作是
(2)如不正确,请分析是否一定有误差
(3)若用此法分别测定[H+]相等的盐酸和醋酸溶液的pH,误差较大的是
您最近一年使用:0次
名校
2 . 氟和氯是两种典型的卤族元素。回答下列问题:
(1)氟与氯化学性质相似,写出NaF的电子式:___________ 。根据元素周期律知识,写出氢气和氟气反应的化学方程式(标出反应条件):___________ 。
(2)氧元素的非金属性___________ (填“强于”或“弱于”)氯元素,你的理由是___________ 。根据HF的___________ (选填编号)大于H2O,可推断氟元素的非金属性强于氧元素。
A.酸性 B.熔沸点 C.稳定性 D.键的极性
(3)不同卤素原子之间形成的化合物叫做卤素互化物,如ClF、ICl、BrF3等。ClF是___________ 化合物(填“离子”或“共价”),它遇水发生复分解反应,试写出该反应的化学方程式:___________ 。
(4)盐酸(氢氯酸)和氢氟酸都是一元酸。某温度下,相同pH的盐酸和氢氟酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如下图所示。据图判断:
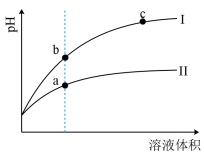
①盐酸稀释时的pH变化曲线为___________ (填“Ⅰ”或“Ⅱ”),溶液的导电性b___________ c(填“>”、“<”或“=”)。
②比较两种溶液中水电离的[H+]:a点___________ b点(填“>”、“<”或“=”)。从电离平衡移动原理解释原因:___________ 。
(1)氟与氯化学性质相似,写出NaF的电子式:
(2)氧元素的非金属性
A.酸性 B.熔沸点 C.稳定性 D.键的极性
(3)不同卤素原子之间形成的化合物叫做卤素互化物,如ClF、ICl、BrF3等。ClF是
(4)盐酸(氢氯酸)和氢氟酸都是一元酸。某温度下,相同pH的盐酸和氢氟酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如下图所示。据图判断:

①盐酸稀释时的pH变化曲线为
②比较两种溶液中水电离的[H+]:a点
您最近一年使用:0次
3 . 25℃时,三种酸的电离平衡常数如下表:
(1)CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO-+H+,下列方法中,可以使0.10mol•L−1CH3COOH溶液中CH3COOH电离程度增大的是_______ 。
a.加入少量稀盐酸 b.加入少量冰醋酸
c.加入少量醋酸钠固体 d.加入少量碳酸钠固体
(2)常温下0.1mol•L−1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___ 。
a.c(H+) b. c.c(H+)•c(OH-) d.
c.c(H+)•c(OH-) d.
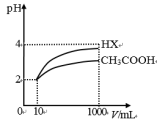
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示。则HX的电离平衡常数___ (填“大于”、“等于”或“小于”,下同)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)__ 醋酸溶液水电离出来的c(H+)。
(4)等物质的量浓度的下列溶液:①Na2CO3;②NaClO;③CH3COONa;④NaHCO3的pH由大到小的顺序是____ (填序号)。
(5)写出往NaClO溶液中通少量CO2的离子方程式:____ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
a.加入少量稀盐酸 b.加入少量冰醋酸
c.加入少量醋酸钠固体 d.加入少量碳酸钠固体
(2)常温下0.1mol•L−1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
a.c(H+) b.
 c.c(H+)•c(OH-) d.
c.c(H+)•c(OH-) d.
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示。则HX的电离平衡常数

(4)等物质的量浓度的下列溶液:①Na2CO3;②NaClO;③CH3COONa;④NaHCO3的pH由大到小的顺序是
(5)写出往NaClO溶液中通少量CO2的离子方程式:
您最近一年使用:0次
2020高三·全国·专题练习
4 . 下列有关说法正确的是___________ 。
①用润湿的试纸测溶液的pH,一定会使结果偏低
②一定温度下,pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
③25 ℃ 时,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍
④25 ℃ 时,某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13
⑤常温下,pH=3的盐酸和pH=12的NaOH溶液等体积混合所得溶液呈碱性
⑥25 ℃ 时,pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合所得溶液呈中性
⑦25 ℃ 时,pH=2的盐酸和pH=12的氨水等体积混合所得溶液呈酸性
⑧25℃时有甲、乙两杯醋酸稀溶液,甲的pH=2,乙的pH=3,中和等物质的量的NaOH,需甲、乙两杯酸的体积(V)之间的关系为10V(甲)>V(乙)
⑨MOH和ROH两种一元碱,其水溶液分别加水稀释时,pH变化如下图所示,在x点时,ROH完全电离

⑩在25℃时,向50.00 mL未知浓度的CH3COOH溶液中逐滴加入0.5 mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如右图所示,①点所示溶液的导电能力弱于②点

⑪室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,V(NaOH) =20ml时,c(Cl-)=c(CH3COO-)

⑫25 ℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值是可以等于4
①用润湿的试纸测溶液的pH,一定会使结果偏低
②一定温度下,pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
③25 ℃ 时,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍
④25 ℃ 时,某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13
⑤常温下,pH=3的盐酸和pH=12的NaOH溶液等体积混合所得溶液呈碱性
⑥25 ℃ 时,pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合所得溶液呈中性
⑦25 ℃ 时,pH=2的盐酸和pH=12的氨水等体积混合所得溶液呈酸性
⑧25℃时有甲、乙两杯醋酸稀溶液,甲的pH=2,乙的pH=3,中和等物质的量的NaOH,需甲、乙两杯酸的体积(V)之间的关系为10V(甲)>V(乙)
⑨MOH和ROH两种一元碱,其水溶液分别加水稀释时,pH变化如下图所示,在x点时,ROH完全电离

⑩在25℃时,向50.00 mL未知浓度的CH3COOH溶液中逐滴加入0.5 mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如右图所示,①点所示溶液的导电能力弱于②点

⑪室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,V(NaOH) =20ml时,c(Cl-)=c(CH3COO-)

⑫25 ℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值是可以等于4
您最近一年使用:0次
解题方法
5 . Ⅰ 常温下,将某一元酸
常温下,将某一元酸 甲、乙、丙、丁代表不同的一元酸
甲、乙、丙、丁代表不同的一元酸 和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
 从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?
从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?________________________________________________________________________ 。
 乙组混合溶液中
乙组混合溶液中 和
和 的大小关系是
的大小关系是________  填标号
填标号 。
。
A.前者大 后者大
后者大
C.二者相等 无法判断
无法判断
 从丙组实验结果分析,该混合溶液中
从丙组实验结果分析,该混合溶液中
__________  填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。
 分析丁组实验数据,写出该混合溶液中下列算式的精确结果
分析丁组实验数据,写出该混合溶液中下列算式的精确结果 列式
列式 :
:
___________  。
。
 某二元酸H
某二元酸H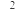 B在水中的电离方程式是H
B在水中的电离方程式是H 、HB
、HB H
H 。
。
 的NaHB溶液显酸性,原因是
的NaHB溶液显酸性,原因是________________________________ 。
 在
在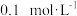 的Na
的Na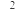 B溶液中,下列粒子浓度关系式正确的是
B溶液中,下列粒子浓度关系式正确的是________  填标号
填标号 。
。
A.
B.
C.
D.
 常温下,将某一元酸
常温下,将某一元酸 甲、乙、丙、丁代表不同的一元酸
甲、乙、丙、丁代表不同的一元酸 和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:| 实验 编号 | HA的物质的 量浓度  | NaOH的物质的 量浓度  | 混合后溶液的pH |
| 甲 | 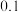 | 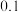 | pH a a |
| 乙 | 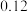 | 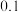 | pH 7 7 |
| 丙 |  | 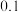 | 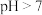 |
| 丁 | 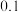 | 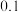 | pH 10 10 |
 从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?
从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸? 乙组混合溶液中
乙组混合溶液中 和
和 的大小关系是
的大小关系是 填标号
填标号 。
。A.前者大
 后者大
后者大C.二者相等
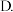 无法判断
无法判断 从丙组实验结果分析,该混合溶液中
从丙组实验结果分析,该混合溶液中
 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。 分析丁组实验数据,写出该混合溶液中下列算式的精确结果
分析丁组实验数据,写出该混合溶液中下列算式的精确结果 列式
列式 :
:
 。
。 某二元酸H
某二元酸H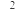 B在水中的电离方程式是H
B在水中的电离方程式是H 、HB
、HB H
H 。
。 的NaHB溶液显酸性,原因是
的NaHB溶液显酸性,原因是 在
在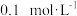 的Na
的Na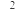 B溶液中,下列粒子浓度关系式正确的是
B溶液中,下列粒子浓度关系式正确的是 填标号
填标号 。
。A.

B.

C.

D.

您最近一年使用:0次
2019高二上·全国·专题练习
解题方法
6 . H2S水溶液中存在电离平衡H2S H++HS−和HS−
H++HS−和HS− H++S2−。若向H2S溶液中:
H++S2−。若向H2S溶液中:
(1)加水稀释后,H2S电离平衡向___________ 移动(填“左”或“右”),溶液中c(H+)___________ (填“增大”或“减小”)。
(2)滴加新制氯水,H2S电离平衡向___________ 方向移动(填“左”或“右”),溶液pH___________ (填“增大”或“减小”)。
(3)逐渐通入SO2气体,直到过量,H2S电离平衡向________ 移动(填“左”或“右”),下列表示溶液pH随SO2气体体积变化关系示意图正确的是________ (填字母)。[已知常温下,Ka1(H2SO3)>Ka1(H2S),Ka2(H2SO3)>Ka2(H2S)]

(4)加少量CuSO4固体(忽略体积变化),H2S电离平衡向_______ 移动(填“左”或“右”),c(S2−)_______ ,c(H+)________ (填“增大”或“减小”)。
(5)加入固体NaOH,H2S电离平衡向________ 移动(填“左”或“右”),c(H+)________ (填“增大”或“减小”),c(S2−)________ (填“增大”或“减小”)。
(6)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象_________ 。
 H++HS−和HS−
H++HS−和HS− H++S2−。若向H2S溶液中:
H++S2−。若向H2S溶液中:(1)加水稀释后,H2S电离平衡向
(2)滴加新制氯水,H2S电离平衡向
(3)逐渐通入SO2气体,直到过量,H2S电离平衡向

(4)加少量CuSO4固体(忽略体积变化),H2S电离平衡向
(5)加入固体NaOH,H2S电离平衡向
(6)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象
您最近一年使用:0次
7 . pH=a的氨水稀释10倍后,其pH=b,则a=b+1。______
您最近一年使用:0次



