解题方法
1 . 常温下,乳酸(用HL表示)的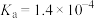 ,乳酸和氢氧化钠溶液反应生成乳酸钠(用NaL表示)。下列说法正确的是
,乳酸和氢氧化钠溶液反应生成乳酸钠(用NaL表示)。下列说法正确的是
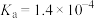 ,乳酸和氢氧化钠溶液反应生成乳酸钠(用NaL表示)。下列说法正确的是
,乳酸和氢氧化钠溶液反应生成乳酸钠(用NaL表示)。下列说法正确的是| A.NaL水溶液呈中性 |
B.0.01 HL溶液的pH=2 HL溶液的pH=2 |
C.0.01 HL溶液中, HL溶液中,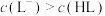 |
D.0.01 NaL溶液中, NaL溶液中, |
您最近半年使用:0次
解题方法
2 . 过氧化氢是淡蓝色的黏稠液体,可。与水以任意比例混溶,是一种强氧化剂。其一般以30%~60%的水溶液形式存放,水溶液俗称双氧水,适用于医用伤口消毒,环境消毒和食品消毒等。回答下列问题:
(1)实验室中利用反应2H2O2 2H2O+O2↑制取O2,可选用的发生装置是
2H2O+O2↑制取O2,可选用的发生装置是___________ (填字母,下同),收集O2可选用的装置是___________ (填字母)。___________ mL(保留三位有效数字)。
(3)过氧化氢是一种二元弱酸,写出H2O2的第一步电离方程式:___________
(4)某课外兴趣小组欲探究温度对H2O2电离平衡的影响,进行如下实验:
①实验任务:利用灵敏pH计测量溶液的pH,并探究电离过程是否吸热。
②查阅资料:20℃时,Ka1(H2O2)=2.4×10-12,lg6≈0.778。
③提出猜想:反应物浓度相同时;温度越高,酸性越强,pH越小。
④设计实验、验证猜想。取试样进行表正实验1~3,记录数据。
⑤数据分析、交流讨论。
实验结果:X2<X1<X3且X1=___________ ,测得pH数据中能证明上述猜想的是___________ (用X1、X2、X3的大小关系表示);pH出现X1<X3的原因是___________ 。
⑥优化实验。在20℃下进行下列实验:
若实验中测得△T1___________ △T2(填“>”或“<”),则说明H2O2电离过程吸热。
(1)实验室中利用反应2H2O2
 2H2O+O2↑制取O2,可选用的发生装置是
2H2O+O2↑制取O2,可选用的发生装置是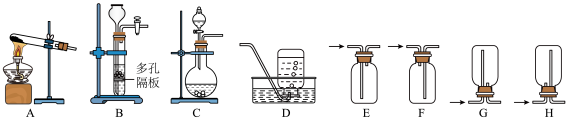
(3)过氧化氢是一种二元弱酸,写出H2O2的第一步电离方程式:
(4)某课外兴趣小组欲探究温度对H2O2电离平衡的影响,进行如下实验:
①实验任务:利用灵敏pH计测量溶液的pH,并探究电离过程是否吸热。
②查阅资料:20℃时,Ka1(H2O2)=2.4×10-12,lg6≈0.778。
③提出猜想:反应物浓度相同时;温度越高,酸性越强,pH越小。
④设计实验、验证猜想。取试样进行表正实验1~3,记录数据。
| 试祥 | 温度/℃ | pH | |
| 1 | 10mL1.5mol/L的双氧水 | 20 | X1 |
| 2 | 10mL1.5mol/L的双氧水 | 30 | X2 |
| 3 | 10mL1.5mol/L的双氧水 | 50 | X3 |
实验结果:X2<X1<X3且X1=
⑥优化实验。在20℃下进行下列实验:
| 试样 | 反应前后温度变化/℃ | |
| 4 | 10mL1.5mol/L的双氧水、10mL1.5mol/L的NaOH溶液 | △T1 |
| 5 | 10mL1.5mol/L的H2SO4溶液10mL1.5mol/L的NaOH溶液 | △T2 |
您最近半年使用:0次
名校
3 . 常温下,某 溶液的
溶液的 ,下列关于该溶液的说法中
,下列关于该溶液的说法中,不正确 的是
 溶液的
溶液的 ,下列关于该溶液的说法中
,下列关于该溶液的说法中| A.显酸性 | B.水电离出的 |
C. | D.加热, 变小 变小 |
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
4 . 2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
(1)一种脱除和利用水煤气中 方法的示意图如下:
方法的示意图如下: 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
___________ (该温度下 的
的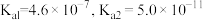 );
);
②再生塔中产生 的离子方程式为
的离子方程式为___________ ;
③利用电化学原理,将 电催化还原为
电催化还原为 ,阴极反应式为
,阴极反应式为___________ 。
(1)一种脱除和利用水煤气中
 方法的示意图如下:
方法的示意图如下: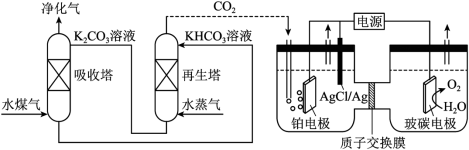
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
 的
的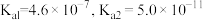 );
);②再生塔中产生
 的离子方程式为
的离子方程式为③利用电化学原理,将
 电催化还原为
电催化还原为 ,阴极反应式为
,阴极反应式为
您最近半年使用:0次
5 . 室温下,在实验室中用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的盐酸,滴定曲线如图所示,
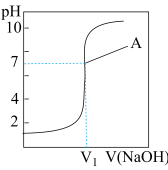
| A.V1=10mL | B.点A处溶质为NaCl |
| C.点A处曲线斜率最大 | D.滴定开始前盐酸pH为1 |
您最近半年使用:0次
6 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.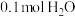 中含有的质子数为 中含有的质子数为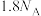 |
B. 的盐酸溶液中 的盐酸溶液中 的数目为 的数目为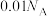 |
C.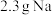 在空气中充分燃烧生成 在空气中充分燃烧生成 ,转移的电子数目为 ,转移的电子数目为 |
D.8 g甲烷和15 g乙烷的混合气体中含有 共价键的数目为 共价键的数目为 |
您最近半年使用:0次
2024-04-17更新
|
410次组卷
|
3卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
广西壮族自治区柳州市2024届高三第三次模拟考试化学试题广西柳州市2024届高三下学期第三次模拟考试(三模)化学试题(已下线)题型3 有关NA的综合考查(25题)-2024年高考化学常考点必杀300题(新高考通用)
名校
7 . 已知H3PO4的pKa1=2.1,pKa2=7.2,pKa3=12.7,则0.10mol·L-1Na2HPO4水溶液的pH值约为
| A.4.65 | B.9.95 | C.7.40 | D.7.33 |
您最近半年使用:0次
名校
解题方法
8 . 某化学兴趣小组用下图所示装置进行电化学原理的实验探究,试回答下列问题:

(1)通 的
的 电极为电池
电极为电池___________ 极(填电极名称):其电极方程式为___________ 。
(2)若B池为电镀池,目的是在铁上镀一层银,则X电极材料为___________ 。
(3)B池为精炼铜,且粗铜中含有 、
、 、
、 、
、 等杂质,则该电池阳极泥的主要成分是
等杂质,则该电池阳极泥的主要成分是___________ 。
(4)若B池的电解质溶液为500mL1.0mol/L的 溶液,X、Y皆为惰性电极,常温下,当电池工作一段时间,断开电源
溶液,X、Y皆为惰性电极,常温下,当电池工作一段时间,断开电源 ,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时
,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时 电池溶液的
电池溶液的 =
=___________ ;要使该溶液恢复到原来的状态,需加入(填物质并注明物质的量)___________ 。
(5)若X、Y均是铜,电解质溶液为 溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是
溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是 ,试写出该电极发生的电极反应式为
,试写出该电极发生的电极反应式为___________ 。

(1)通
 的
的 电极为电池
电极为电池(2)若B池为电镀池,目的是在铁上镀一层银,则X电极材料为
(3)B池为精炼铜,且粗铜中含有
 、
、 、
、 、
、 等杂质,则该电池阳极泥的主要成分是
等杂质,则该电池阳极泥的主要成分是(4)若B池的电解质溶液为500mL1.0mol/L的
 溶液,X、Y皆为惰性电极,常温下,当电池工作一段时间,断开电源
溶液,X、Y皆为惰性电极,常温下,当电池工作一段时间,断开电源 ,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时
,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时 电池溶液的
电池溶液的 =
=(5)若X、Y均是铜,电解质溶液为
 溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是
溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是 ,试写出该电极发生的电极反应式为
,试写出该电极发生的电极反应式为
您最近半年使用:0次
解题方法
9 . 下列有关说法中错误的是
A.某温度时的混合溶液中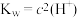 ,说明该溶液呈中性( ,说明该溶液呈中性(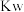 为该温度时水的离子积常数) 为该温度时水的离子积常数) |
B.常温下,由水电离出的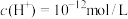 的溶液的 的溶液的 可能为2或12 可能为2或12 |
C.已知 , ,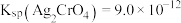 ,向含有Cl-、CrO ,向含有Cl-、CrO 且浓度均为 且浓度均为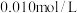 溶液中逐滴加入 溶液中逐滴加入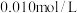 的 的 溶液时,CrO 溶液时,CrO 先产生沉淀 先产生沉淀 |
D.常温下,某 的 的 和 和 混合溶液中, 混合溶液中,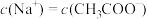 |
您最近半年使用:0次
10 . 要除去CuCl2溶液中的Fe3+ ,甲同学不知道调整溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,通过调节溶液pH除去Fe3+而不损失Cu2+,调节pH的取值范围
| A.3≤pH<4 | B.3≤pH≤4 |
| C.2<pH≤3 | D.2≤pH<3 |
您最近半年使用:0次



