解题方法
1 . 在常温下,向20mL0.10mol·L-1的Na2CO3溶液中滴加0.10mol·L-1的盐酸,溶液pH随滴定百分率%的变化如图所示。下列说法正确


A.在a点的溶液中,c(H2CO3)-c(CO )> c(OH-)-c(C1-) )> c(OH-)-c(C1-) |
B.在b点的溶液中,2n(H2CO3)+ n(HCO )<0.002 mol )<0.002 mol |
| C.煮沸目的是除去CO2,使突跃变大,冷却后继续滴定到终点 |
| D.若将0.10mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时: c(Na+)=c(CH3COO-) |
您最近一年使用:0次
2022-04-11更新
|
1307次组卷
|
4卷引用:湖南省攸县第三中学2022-2023学年高三第六次月考化学试题
湖南省攸县第三中学2022-2023学年高三第六次月考化学试题浙江省绍兴市2022届高三选考科目适应性考试(二模)化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)三轮冲刺卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
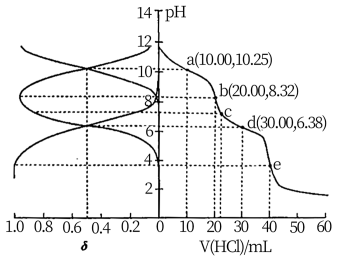
2 . 用 盐酸滴定
盐酸滴定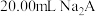 溶液,溶液中
溶液,溶液中 、
、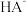 、
、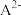 的分布分数
的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是【如
随pH变化曲线及滴定曲线如图。下列说法正确的是【如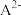 分布分数:
分布分数: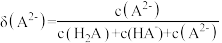 】
】
 盐酸滴定
盐酸滴定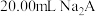 溶液,溶液中
溶液,溶液中 、
、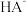 、
、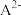 的分布分数
的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是【如
随pH变化曲线及滴定曲线如图。下列说法正确的是【如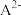 分布分数:
分布分数: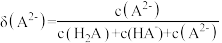 】
】
A. 的 的 为 为 | B.c点: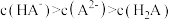 |
| C.第一次突变,可选酚酞作指示剂 | D.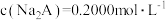 |
您最近一年使用:0次
2021-09-13更新
|
12211次组卷
|
29卷引用:湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题湖南省长沙市周南中学2023-2024学年高二下学期第一次月考化学试题2021年新高考辽宁化学高考真题辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题辽宁省实验中学2021-2022学年高二上学期期中考试化学试题2021年辽宁高考化学试题变式题11-192020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)辽宁省朝阳市建平县实验中学2021-2022学年高二上学期第三次月考化学试题四川省绵阳南山中学2021-2022学年高二下学期3月月考理综化学试题内蒙古海拉尔第二中学2021-2022学年高三上学期第三次阶段考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题10 水溶液中的离子平衡-三年(2020-2022)高考真题分项汇编(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题(已下线)易错点24 水的电离平衡-备战2023年高考化学考试易错题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡微专题(12) 电解质溶液中的两类特殊图像(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)四川省仁寿第一中学校南校区2023-2024学年高三上学期11月期中考试理综化学试题黑龙江省大庆市肇州县第二中学2023-2024学年高二上学期12月月考化学试题辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题
解题方法
3 . 常温时,采用甲基橙和酚酞双指示剂,用盐酸滴定 溶液﹐溶液中
溶液﹐溶液中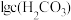 、
、 、
、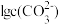 、
、 、
、 随溶液pH的变化及滴定曲线如图所示:
随溶液pH的变化及滴定曲线如图所示:

下列说法不正确的是
 溶液﹐溶液中
溶液﹐溶液中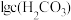 、
、 、
、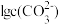 、
、 、
、 随溶液pH的变化及滴定曲线如图所示:
随溶液pH的变化及滴定曲线如图所示:
下列说法不正确的是
| A.整个滴定过程中可先用酚酞再用甲基橙作指示剂 |
| B.n点的pH为m点和q点pH的平均值 |
C.r点溶液中: |
| D.r点到k点对应的变化过程中,溶液中水的电离程度先减小后增大 |
您最近一年使用:0次
2021-05-20更新
|
565次组卷
|
2卷引用:湖南省永州市省重点中学2021届高三5月联考化学试题
名校
4 . 常温下,将0.1000 mol·L-1的KOH溶液分别滴加到20.00 mL浓度均为0.1000 mol·L-1的一元酸HX和HY溶液中,溶液的pH与所加 KOH 溶液体积的关系如图所示,下列叙述错误的是


| A.M点溶液中c(K+)>c(X-)>c(OH-)>c(H+) |
| B.常温下用0.1000 mol·L-1的氨水(Kb=1.8x10-5)滴定0.1000 mol·L-1HX溶液可用酚酞做指示剂 |
| C.N点溶液中,c(Y-)+2c(OH-)=2c(H+)+c(HY) |
| D.常温下,将0.1000 mol·L-1HX溶液和0.2000mol·L-1KY溶液等体积混合,混合液呈酸性 |
您最近一年使用:0次
2021-04-04更新
|
718次组卷
|
5卷引用:湖南省大联考雅礼十六校2021-2022学年高三第二次联考化学试题
湖南省大联考雅礼十六校2021-2022学年高三第二次联考化学试题湖南省长沙市麓山国际实验学校2022-2023学年高三下学期3月月考化学试题安徽省池州市2021届高三下学期4月普通高中教学质量统一监测(二模)理综化学试题(已下线)难点7 溶液稀释与酸碱中和滴定曲线分析-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)化学-2022年高考考前押题密卷(广东卷)
名校
解题方法
5 . 常温下,磷酸钠溶液中含磷微粒的分布随pH的变化如图所示,M、N、P三点对应的pH分别为a、b、c,其中δ表示含磷微粒的物质的量分数。下列说法错误的是
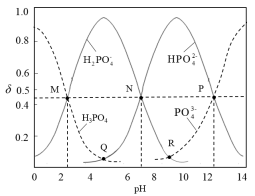

A.常温下, 的一级电离平衡常数Ka1=10-a 的一级电离平衡常数Ka1=10-a |
B.常温下,溶液中水电离出的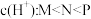 |
C.Q点与R点对应溶液的pH差: |
D.用磷酸标准溶液滴定NaOH溶液,选择酚酞作指示剂,终点时溶质主要为 |
您最近一年使用:0次
2021-02-03更新
|
1092次组卷
|
7卷引用:湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题
湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题河南省新乡市2020-2021学年高二上学期期末考试化学试题湖北省仙桃中学、天门中学(B班)2021-2022学年高二上学期期中考试化学试题(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江西省宜春市铜鼓中学2021-2022学年高二下学期第一次月考(实验班)化学试卷(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(练)
解题方法
6 . 298K时,向20 mL 0.1000 mol·L-1 CH3COOH溶液中滴入0.1000 mol·L-1NaOH溶液,滴定曲线如图所示(忽略温度变化)。下列说法正确的是


| A.该滴定过程应该选择石蕊溶液做指示剂 |
| B.由c点数值可求醋酸的电离平衡常数为1.66×10-5 mol·L-1 |
| C.b点溶液中各微粒浓度关系为2c(H+)+c(CH3COOH) =c(CH3COO-)+2c(OH-) |
| D.中和同体积同pH的醋酸和盐酸所用氢氧化钠的物质的量,后者多 |
您最近一年使用:0次
2020-05-09更新
|
408次组卷
|
2卷引用:湖南省邵阳市新邵县2019-2020学年高二下学期期末考试化学试题
2019高二上·全国·专题练习
名校
解题方法
7 . 常温下,用0.100 0 mol·L−1的 NaOH溶液滴定20.00 mL 0.1000 mol·L−1的某酸HA溶液所得滴定曲线如图所示。
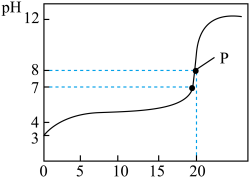
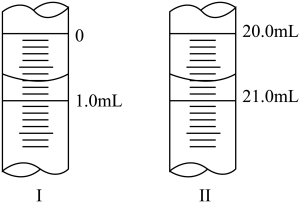
回答下列问题:
(1)该酸为_______ 酸(填“强”或者“弱”),你的判断理由是_________________ 。
(2)点P时溶液中的 c(HA)=________ mol·L−1。
(3)①该中和滴定应选择________ 做指示剂,滴定终点时的现象是________________________ 。
②滴定起始和终点的液面位置如图2所示,则消耗NaOH溶液的体积为_____ mL。
③下列操作使滴定结果偏高的是________ 。
a.滴定前,碱式滴定管未用NaOH溶液润洗
b.锥形瓶的待测液中加少量水稀释
c.碱式滴定管滴定前有气泡,滴定后无气泡
d.读数时,滴定前仰视,滴定后俯视


回答下列问题:
(1)该酸为
(2)点P时溶液中的 c(HA)=
(3)①该中和滴定应选择
| 指示剂变色范围(pH) | 甲基橙(3.1~4.4) | 石蕊(5~8) | 酚酞(8.2~10.0) | ||||||
| 颜色 | <3.1 | 3.1~4.4 | >4.4 | <5 | 5~8 | >8 | <8.2 | 8.2~10.0 | >10.0 |
| 红 | 橙 | 黄 | 红 | 紫 | 蓝 | 无色 | 粉红 | 红 | |
③下列操作使滴定结果偏高的是
a.滴定前,碱式滴定管未用NaOH溶液润洗
b.锥形瓶的待测液中加少量水稀释
c.碱式滴定管滴定前有气泡,滴定后无气泡
d.读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次



