名校
1 . (1)某学生用0.1500mol/LNaOH溶液测定某未知浓度的盐酸溶液,完成以下填空:
(1)滴定时边滴边摇动锥形瓶,眼睛应注意观察___ 。
(2)盛装氢氧化钠溶液应该选择图中滴定管___ (填标号)。


(3)滴定结果如表所示:
计算该盐酸的物质的量浓度为___ (精确至0.0001)。
(4)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去24mLl.0×l0-4mol/L的KMnO4溶液。
Ⅰ.判断滴定终点的方法是___ 。
Ⅱ.写出用KMnO4滴定H2C2O4的离子方程式___ 。
Ⅲ.计算:血液中含钙离子的浓度为___ mol/L。
(1)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(2)盛装氢氧化钠溶液应该选择图中滴定管


(3)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
(4)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去24mLl.0×l0-4mol/L的KMnO4溶液。
Ⅰ.判断滴定终点的方法是
Ⅱ.写出用KMnO4滴定H2C2O4的离子方程式
Ⅲ.计算:血液中含钙离子的浓度为
您最近一年使用:0次
解题方法
2 . 氧化钒( VO2)是一种新型热敏材料。+4价的钒化合物弱酸性性条件下易被氧化。实验室以V2O3为原料合成用于制备VO2的氧钒( IV)碱式碳酸铵晶体,过程如图:
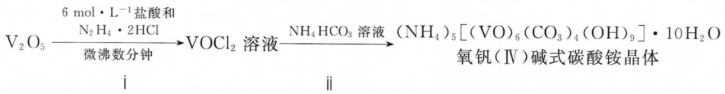
回答下列问题:
(1)VOCl2和VO 中V的化合价分别为
中V的化合价分别为___________ 、___________ 。
(2)步骤i中生成VOCl2的同时生成一种无色无污染的气体:该化学方程式为___________ 。若只用浓盐酸与V2O5来制备VOCl2溶液,该法的缺点是___________ 。
(3)步骤ii可在如图装置中进行。

①反应前应通入CO2数分钟的目的是___________ ,
②装置B中的试剂是___________ 。
(4)测定氧钒( IV )碱式碳酸铵晶体粗产品中钒的含量。
称量w g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,滴加0.02mol·L-1 KMnO4溶液至稍过量,充分反应后继续滴加1% NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用x mol·L-1( NH4)2Fe( SO4)2标准溶液滴定至终点,消耗体积为0.01mL。滴定反应为: VO +Fe2++2H+=VO2++Fe3++H2O。
+Fe2++2H+=VO2++Fe3++H2O。
①KMnO4溶液的作用是___________ 。若不加NaNO2溶液和尿素会导致测定结果___________ (填“偏高"“偏低”或“无影响" )
②粗产品中钒的质量分数表达式为___________ 。

回答下列问题:
(1)VOCl2和VO
 中V的化合价分别为
中V的化合价分别为(2)步骤i中生成VOCl2的同时生成一种无色无污染的气体:该化学方程式为
(3)步骤ii可在如图装置中进行。

①反应前应通入CO2数分钟的目的是
②装置B中的试剂是
(4)测定氧钒( IV )碱式碳酸铵晶体粗产品中钒的含量。
称量w g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,滴加0.02mol·L-1 KMnO4溶液至稍过量,充分反应后继续滴加1% NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用x mol·L-1( NH4)2Fe( SO4)2标准溶液滴定至终点,消耗体积为0.01mL。滴定反应为: VO
 +Fe2++2H+=VO2++Fe3++H2O。
+Fe2++2H+=VO2++Fe3++H2O。①KMnO4溶液的作用是
②粗产品中钒的质量分数表达式为
您最近一年使用:0次
名校
解题方法
3 . 某学生用0.1000mol/L的NaOH标准溶液滴定未知浓度的盐酸,用酚酞作指示剂。
(1)滴定前,下列操作的正确顺序是__ (填字母序号):
A.用0.1000mol/LNaOH溶液润洗
B.盛装0.1000mol/LNaOH溶液
C.查漏、清洗
D.读数、记录
E.排尽滴定管尖嘴的气泡并调整液面
(2)滴定时,左手挤压玻璃球,右手不断摇动锥形瓶,眼睛___ ;
(3)判断到达滴定终点的实验现象是___ 。
(4)下列说法正确的是___ (填字母序号)。
a.滴定管用蒸馏水洗涤后,装入NaOH溶液进行测定
b.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
c.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
d.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏大
e.滴定结束后若仰视观察滴定管中液面刻度,则测定结果偏小
(5)若称取一定量的NaOH固体(含少量KOH)配制标准溶液并用来滴定上述盐酸,则对测定结果产生的影响是___ (填“偏高”、“偏低”或“无影响”)。
(6)测定甲醛的一种方法:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠。
①将5.00mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.000mol/L的硫酸测定,至中点时耗用硫酸24.80mL,甲醛水溶液的浓度为__ mol/L。
②上述测定中,若滴定管规格为50mL,甲醛水溶液取样不能超过___ mL。
(1)滴定前,下列操作的正确顺序是
A.用0.1000mol/LNaOH溶液润洗
B.盛装0.1000mol/LNaOH溶液
C.查漏、清洗
D.读数、记录
E.排尽滴定管尖嘴的气泡并调整液面
(2)滴定时,左手挤压玻璃球,右手不断摇动锥形瓶,眼睛
(3)判断到达滴定终点的实验现象是
(4)下列说法正确的是
a.滴定管用蒸馏水洗涤后,装入NaOH溶液进行测定
b.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
c.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
d.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏大
e.滴定结束后若仰视观察滴定管中液面刻度,则测定结果偏小
(5)若称取一定量的NaOH固体(含少量KOH)配制标准溶液并用来滴定上述盐酸,则对测定结果产生的影响是
(6)测定甲醛的一种方法:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠。
①将5.00mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.000mol/L的硫酸测定,至中点时耗用硫酸24.80mL,甲醛水溶液的浓度为
②上述测定中,若滴定管规格为50mL,甲醛水溶液取样不能超过
您最近一年使用:0次
名校
解题方法
4 . 用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,指示剂为甲基橙,试根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有__________ 、__________ 。
(2)取10.00mL待测液,用__________ 式滴定管量取。
用0.2010 mol/L标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定到终点。
(3)根据下列数据,c(NaOH)=__________
滴定终点的现象__________ 。
(4)以标准的盐酸溶液滴定未知的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”、“偏小”“无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视__________
②未用标准液润洗滴定管__________
③用待测液润洗锥形瓶__________
④不小心将标准液滴在锥形瓶外面__________
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁。__________
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
(2)取10.00mL待测液,用
用0.2010 mol/L标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定到终点。
(3)根据下列数据,c(NaOH)=
滴定终点的现象
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
①读数:滴定前平视,滴定后俯视
②未用标准液润洗滴定管
③用待测液润洗锥形瓶
④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁。
您最近一年使用:0次
名校
解题方法
5 . 将1.00mol•L-1NaOH溶液滴入20.00mL1.00mol•L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示:
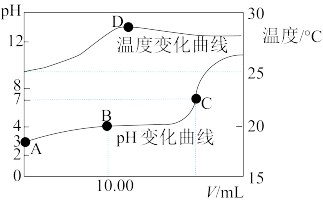
(1)计算室温时20.00mL1.00mol•L-1的一元酸HA的电离度α=________
(2)图中B点所示的溶液中所含各离子浓度由大到小的顺序是_________
(3)下列说法正确的是_______ (填相应序号).
A.由图中可知NaOH和HA反应的 H>0
H>0
B.图中C点所加NaOH溶液的体积V=20.00mL
C.图中C点时溶液的KW略大于1×10-14mol•L-1,溶液中c(H+)=1×10-7mol•L-1
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
(4)常温下在20mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示,回答下列问题:
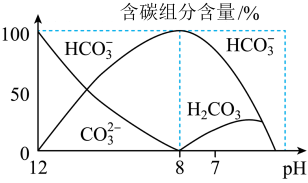
①在同一溶液中,H2CO3、HCO3-、CO32-_________ (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为_______ ,溶液中各种离子的物质的量浓度的大小关系为______________ ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol•L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=____

(1)计算室温时20.00mL1.00mol•L-1的一元酸HA的电离度α=
(2)图中B点所示的溶液中所含各离子浓度由大到小的顺序是
(3)下列说法正确的是
A.由图中可知NaOH和HA反应的
 H>0
H>0B.图中C点所加NaOH溶液的体积V=20.00mL
C.图中C点时溶液的KW略大于1×10-14mol•L-1,溶液中c(H+)=1×10-7mol•L-1
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
(4)常温下在20mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示,回答下列问题:

①在同一溶液中,H2CO3、HCO3-、CO32-
②当pH=7时,溶液中含碳元素的主要微粒为
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol•L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=
您最近一年使用:0次
名校
解题方法
6 . 某学生用0.2 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.酸式滴定管准确量取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、_______________ 、F(填序号)
(2)滴定结果如下:
根据以上数据可以计算出盐酸的物质的量浓度为_______________ mol·L-1. (计算结果小数点后保留两位有效数字)
(3)达到滴定终点的标志是________________________________
(4)以下操作造成测定结果偏高的原因可能是___________________ 。
A. 取待测液时,未用待测夜润洗酸式滴定管
B. 滴定前读数时,俯视滴定管的刻度,其它操作均正确
C. 滴定管滴定前无气泡,滴定后有气泡
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
A.酸式滴定管准确量取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、
(2)滴定结果如下:
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 20.20mL | 38.80mL |
(3)达到滴定终点的标志是
(4)以下操作造成测定结果偏高的原因可能是
A. 取待测液时,未用待测夜润洗酸式滴定管
B. 滴定前读数时,俯视滴定管的刻度,其它操作均正确
C. 滴定管滴定前无气泡,滴定后有气泡
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
您最近一年使用:0次
2020-03-04更新
|
83次组卷
|
2卷引用:新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题
名校
7 . 某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是___ (填编号)。若测定结果偏高其原因可能是__ (填字母)。
A.配制标准溶液的固体NaOH中混有Na2O杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是___ 。
(3)如图是某次滴定时滴定管中的液面,其读数为___ mL。

(4)根据下列数据,请计算待测盐酸的浓度:___ mol•L-1。
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是
A.配制标准溶液的固体NaOH中混有Na2O杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是
(3)如图是某次滴定时滴定管中的液面,其读数为

(4)根据下列数据,请计算待测盐酸的浓度:
| 滴定次数 | 待测体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
您最近一年使用:0次
名校
8 . 现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
I.实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_______________ 作指示剂。
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为____________ mL。
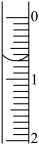
(4)滴定。当____________ 时,停止滴定,并记录NaOH溶液的最终读数.再重复滴定3次。
Ⅱ.实验记录
Ⅲ.数据处理:
(5)某同学在处理数据时计算得:平均消耗的NaOH溶液的体积 V=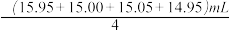 =15.24mL。指出他的计算的不合理之处:
=15.24mL。指出他的计算的不合理之处:____________________________________ 。按正确数据处理,可得市售白醋总酸量=____________ g/100mL。(结果保留四位有效数字)
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)____________ 。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
I.实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为

(4)滴定。当
Ⅱ.实验记录
| 实验数据(mL) 滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理:
(5)某同学在处理数据时计算得:平均消耗的NaOH溶液的体积 V=
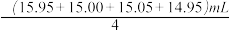 =15.24mL。指出他的计算的不合理之处:
=15.24mL。指出他的计算的不合理之处:(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
您最近一年使用:0次
名校
9 . 硫酰氯(SO2Cl2)熔点-54.1℃,沸点在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。

(1)SO2Cl2中的S的化合价为_______________ ,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为_______________ 。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(部分夹持装置未画出)。
①仪器A的名称为_______________ ,装置乙中装入的试剂是_______________ ,装置B的作用是_______________ 。
②装置丙分液漏斗中盛装的最佳试剂是_______________ (选填编号)。
A.蒸馏水B.l0.0mol·L-1浓盐酸
C.浓氢氧化钠溶液D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL0.50000mol·L-1NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L-1标准HCl滴定至终点,重复实验三次取平均值,消耗HCl l0.00mL。达到滴定终点的现象为_______________ ,产品的纯度为_______________ 。

(1)SO2Cl2中的S的化合价为
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(部分夹持装置未画出)。
①仪器A的名称为
②装置丙分液漏斗中盛装的最佳试剂是
A.蒸馏水B.l0.0mol·L-1浓盐酸
C.浓氢氧化钠溶液D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL0.50000mol·L-1NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L-1标准HCl滴定至终点,重复实验三次取平均值,消耗HCl l0.00mL。达到滴定终点的现象为
您最近一年使用:0次
2019-08-15更新
|
116次组卷
|
2卷引用:新疆乌鲁木齐市2019届高三第三次毕业诊断及模拟测试理综化学试题
名校
10 . 用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
(1)准确配制0.20mol·L-1的氢氧化钠溶液250mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有____________________
(2)根据以上数据可以计算出盐酸的物质的量浓度为_____________ mol·L-1.
(3)用0.20mol·L-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视_______________ ,直到滴定终点。
(4)达到滴定终点的标志是_______________________________________________________
(5)以下操作造成测定结果偏高的原因可能是__________________ 。
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
(2)根据以上数据可以计算出盐酸的物质的量浓度为
(3)用0.20mol·L-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视
(4)达到滴定终点的标志是
(5)以下操作造成测定结果偏高的原因可能是
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
您最近一年使用:0次



