9-10高一下·江西·期末
名校
解题方法
1 . 将V1 mL1.00mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL,下列叙述正确的是( )


| A.做该实验时环境温度为22℃ |
| B.该实验表明化学能可能转化为热能 |
| C.NaOH溶液的浓度约为1.00mol·L-1 |
| D.该实验表明有水生成的反应都是放热反应 |
您最近一年使用:0次
2020-03-19更新
|
1964次组卷
|
75卷引用:2010年云南省玉溪一中高二下学期期末考试化学试题
(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题2015-2016学年云南省昆明三中高二下期中化学试卷(已下线)09~10年江西白鹭洲中学高一下学期期末试题化学卷(已下线)2010年黑龙江牡丹江一中高二上学期期中考试化学试卷(已下线)2011-2012年广东东莞南城中学高二上学期期中考试化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一下学期期初考试化学试卷(已下线)2011-2012学年浙江省杭州地区七校高二下学期期中联考化学试卷(已下线)2012-2013学年黑龙江省庆安三中高二上学期期中考试化学试卷(已下线)2012-2013学年重庆市第七中学高二上学期期中考试化学试卷(已下线)2012年苏教版高中化学选修6 6.1食醋总酸含量的测定练习卷(已下线)2014年高二化学人教版选修四 2中和反应反应热的测定练习卷(已下线)2015安徽望江中学同步课时练(人教选修4)1.1中和反应反应热的测定(已下线)2014-2015学年河南省南阳市新野三中上学期10月月考高二化学试卷2015-2016学年山西省右玉一中高二上学期第一次月考化学试卷2015-2016学年福建省师大附中高二上期末理化学试卷2015-2016学年浙江省安吉县上墅私立高中高一下期中化学试卷2015-2016学年山东省泰安市高一下学期期末考试化学试卷2017届河北省邯郸一中等五校高三上学期第一次模拟化学试卷2016-2017学年河北省辛集中学高一下学期第二次月考化学试卷湖北省沙市中学2017-2018学年高二上学期第二次双周考化学试题山西省实验中学2017-2018学年高二上学期10月月考化学试题江西省九江市2017-2018学年高二上学期第一次阶段联考化学试题西藏日喀则市第二高级中学2017-2018学年高二上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题A内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B广东省中山市2017-2018学年高二上学期期末考试化学试题安徽省淮北市第一中学2017-2018学年高一下学期期中考试化学试题山西省忻州第一中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】广东省汕头市金山中学2018-2019学年高二上学期10月月考化学试题湖南省娄底市第四中学2018-2019学年高二上学期10月月考化学试题【全国百强校】山西省忻州市第一中学2018-2019学年高二上学期第一次月考化学试题湖北省荆州中学2018-2019学年高一下学期5月月考化学试题湖南省永州市东安县第一中学2019-2020学年高二上学期第一次月考化学试题甘肃省张掖市临泽县第一中学2019-2020学年高二上学期9月月考化学试题贵州省思南中学2019-2020学年高二9月月考化学试题浙江省浙东北联盟(ZDB)2019-2020学年高二上学期期中考试化学试题人教版高中化学必修二第二单元《化学反应与能量》测试卷甘肃省酒泉市敦煌中学2020届高三上学期第二次调研考试化学试题2020届高三化学知识点强化训练—中和热四川省南充市阆中中学2020届高三化学选择题专项训练(22)山西省太原市山西省实验中学2019-2020学年高二上学期10月月考化学试题安徽省安庆市怀宁县怀宁中学2019-2020学年高一下学期期中考试化学试题(已下线)1.1.1 化学反应的反应热 内能变化 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1山东省滕州市第一中学2020-2021学年高二9月开学收心考试化学试题(已下线)1.1.2+热化学方程式-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)高一必修第二册(人教2019版)第六章 第一节 化学反应与能量变化 课时1 化学反应与能量变化鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第1节 化学反应的热效应 课时1 化学反应的反应热、内能变化与焓变陕西省西安市第八十九中学2018-2019学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 第一节 反应热 课时1 反应热 焓变(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)云南省丽江市第一高级中学2021-2022学年高二上学期元月考化学试题河北省衡水市第十四中学2020-2021学年高二上学期期末考试化学试题宁夏大学附属中学2020-2021学年高二下学期第一次月考化学试题选择性必修1(SJ)专题1第一单元课时3 反应热的测定(已下线)1.1.2 反应热的测量与计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)辽宁省大连市第一中学2021-2022学年高二上学期学情反馈(一)化学试题浙江省金华市第八中学2021-2022学年高二上学期9月月考化学试题浙江省磐安县第二中学2021-2022学年高二10月份竞赛化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题湖南大学附属中学2021-2022学年高二上学期期中考试化学试题安徽省南陵中学2021-2022学年高二上学期9月月考化学试题(已下线)1.2.1 反应热的测量和热化学方程式-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第15讲 化学反应的热效应 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)1.1.2 反应热(二)-同步学习必备知识天津市天津中学2022-2023学年高二上学期期中测试化学试题河北省唐山市迁西县职业技术教育中心2021-2022学年高二(普职融通部)上学期9月月考化学试题安徽省庐江县2021-2022学年高二上学期期末考试化学试题四川省宜宾市叙州区第一中学校2022-2023学年高二下学期开学考试化学试题安徽省安庆市怀宁县第二中学2022-2023学年高二上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期中考试化学(选考)试题5.3.1 化学变化中的能量变化(第1课时)-【帮课堂】高一化学同步精品讲义(沪科版2020必修第二册)宁夏六盘山高级中学2023-2024学年高二上学期第一次月考化学试题陕西省西安中学2023-2024学年高二上学期11月期中考试化学试题陕西省西安市 周至县第四中学2023-2024学年高二上学期10月份月考化学试题浙江省杭州市源清中学2023-2024学年高二上学期期末考试化学试题
名校
2 . 用0.10mol/LNaHSO4滴定50mL0.100mol/LBa(OH)2溶液的滴定曲线如图所示。下列有关描述错误的是( )
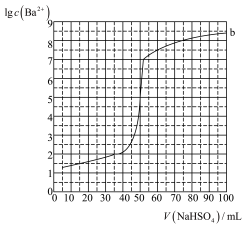

| A.根据曲线数据可知Ksp(BaSO4)的数量级为10-10 |
| B.室温下,a点的pH=14 |
| C.b点溶质为Na2SO4 |
| D.相同实验条件下,若改为0.140mol/LBa(OH)2,滴定反应终点移到c点 |
您最近一年使用:0次
3 . 化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
(1)上述实验①、②是探究__________ 对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__________ ;乙是实验需要测量的物理量,则表格中“乙”应填写__________ 。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________________ 。
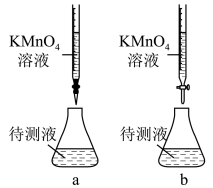
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是___________ (选填 a、b)。
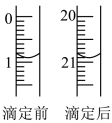
(4)由图可知消耗KMnO4溶液体积为________________ mL。
(5)滴定过程中眼睛应注视______ 。
(6)通过上述数据,求得x=_______ 。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果_____________ (偏大、偏小或没有影响) 。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
| 物理量 | V(0.20mol∙L-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol∙L-1KMnO4溶液)/mL | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 25 | |
| ③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①、②是探究
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是

(4)由图可知消耗KMnO4溶液体积为

(5)滴定过程中眼睛应注视
(6)通过上述数据,求得x=
您最近一年使用:0次
2020-02-11更新
|
62次组卷
|
2卷引用:云南省绥江县第三中学2019-2020学年高二上学期期末考试化学试题
名校
解题方法
4 . 下列关于酸碱中和滴定的叙述中,正确的是( )
| A.进行酸碱中和滴定实验时,盛装待测液的锥形瓶使用前应先用待测液润洗 |
| B.滴定前应排除尖嘴部分的气泡 |
| C.滴定过程中两眼应注视滴定管内液面变化 |
| D.锥形瓶内溶液颜色突变说明到达滴定终点 |
您最近一年使用:0次
2020-02-06更新
|
148次组卷
|
3卷引用:云南省丽江市宁蒗县第一中学2019—2020学年高二上学期期末考试化学试题
云南省丽江市宁蒗县第一中学2019—2020学年高二上学期期末考试化学试题(已下线)3.2.2 酸碱中和滴定(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)甘肃省武威第十八中学2020-2021学年高二上学期期末考试化学试题
名校
解题方法
5 . 25℃时,进行下图所示滴定并得到对应曲线。下列说法错误的是


| A.Ka2(H2C2O4)=10-4.19 |
B.直线Ⅰ中X=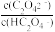 |
| C.在NaHC2O4溶液中c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-) |
| D.Ⅰ、Ⅱ两条直线的斜率均为1 |
您最近一年使用:0次
2020-01-12更新
|
773次组卷
|
3卷引用:广东省惠州市2020届高三第三次调研考试理综化学试题
名校
6 . 滴定法是一种重要的定量分析方法,应用范围很广。
(1)下图是用0.100 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
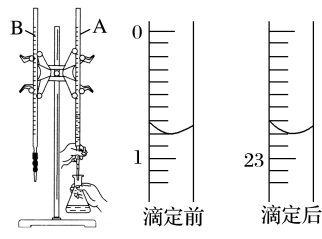
请回答下列问题:
①仪器A的名称是____________ 。
②盐酸的体积读数:滴定后读数为________ mL。
(2)玉溪市场上销售的“白象牌”食用精制盐包装袋上有如下部分说明:
某学生拟测定食用精制盐的碘(KIO3)含量,其步骤:
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全(I2+2S2O32-===2I-+S4O62-)。
①c中指示剂是_______________ ,判断c中恰好完全反应所依据的现象是___________ 。
②写出步骤b的离子方程式_____________________ 。
③b中反应所产生的I2的物质的量是________ mol。
④根据以上实验和包装袋说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_______ mg·kg-1。
⑤若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果________ (填“偏高”“偏低”或“不变”)。
(1)下图是用0.100 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。

请回答下列问题:
①仪器A的名称是
②盐酸的体积读数:滴定后读数为
(2)玉溪市场上销售的“白象牌”食用精制盐包装袋上有如下部分说明:
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50 mg·kg-1 |
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全(I2+2S2O32-===2I-+S4O62-)。
①c中指示剂是
②写出步骤b的离子方程式
③b中反应所产生的I2的物质的量是
④根据以上实验和包装袋说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)
⑤若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果
您最近一年使用:0次
7 . 用AG表示溶液的酸度,其表达式为AG=lg[ ],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
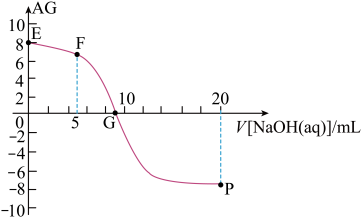
 ],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
| A.溶液pH和AG的关系式为AG=14-2pH |
| B.对G点溶液,c(Na+) = c(X-) |
| C.298K时HX的电离常数Ka≈1.0×10-5 |
| D.溶液中水电离的c(OH-) F点<P点 |
您最近一年使用:0次
2019-12-04更新
|
469次组卷
|
3卷引用:云南省曲靖市陆良县2020届高三上学期第二次适应性考试化学试题
名校
解题方法
8 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。查阅资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。②Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成 KC1O3。
(1)用K2FeO4处理生活用水既可以消毒又可以沉降,其原理是K2FeO4与水反应生成Fe(OH)3胶体,写出该反应的离子方程式:____________________________ 。
(2)实验室常利用氯气制备NaClO后与NaOH、Fe(NO3)3反应制备K2FeO4根据反应原理,仅根据下列仪器,请你组装合理、简洁的实验装置,所用的装置的接口连接顺序:___________________________ 。

(3)写出装置A中发生的离子方程式:______________________ 。
(4)三颈烧瓶用冰水浴的原因是_________________ ,A处盛放KC1O3的仪器名称 ___________ 。
(5)将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,其原因是________________________________________________________ 。
(6)高铁酸钾纯度检测:称取3.0 g制备的K2FeO4粗晶体溶于适量KOH溶液中,加入足量的KCrO2充分反应(此时Cr元素全部以CrO42-形式存在),过滤,滤液在100 mL容量瓶中定容。取10.00 mL加入稀硫酸酸化,再用 0.10 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点(此时Cr元素全部以Cr3+形式存在),重复滴定3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4样品的纯度为_________ 。
(1)用K2FeO4处理生活用水既可以消毒又可以沉降,其原理是K2FeO4与水反应生成Fe(OH)3胶体,写出该反应的离子方程式:
(2)实验室常利用氯气制备NaClO后与NaOH、Fe(NO3)3反应制备K2FeO4根据反应原理,仅根据下列仪器,请你组装合理、简洁的实验装置,所用的装置的接口连接顺序:

(3)写出装置A中发生的离子方程式:
(4)三颈烧瓶用冰水浴的原因是
(5)将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,其原因是
(6)高铁酸钾纯度检测:称取3.0 g制备的K2FeO4粗晶体溶于适量KOH溶液中,加入足量的KCrO2充分反应(此时Cr元素全部以CrO42-形式存在),过滤,滤液在100 mL容量瓶中定容。取10.00 mL加入稀硫酸酸化,再用 0.10 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点(此时Cr元素全部以Cr3+形式存在),重复滴定3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4样品的纯度为
您最近一年使用:0次
2019-12-04更新
|
285次组卷
|
2卷引用:云南省曲靖市陆良县2020届高三上学期第二次适应性考试化学试题
名校
9 . 某研究小组将V1mL 1.0 mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度________ (填“高于”、“低于”或“等于”)22℃,判断的依据是_______ 。
(2)由题干及图形可知:V1∶V2=________ 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为______ mol·L-1。
(3)实验时将酸碱在简易量热计中混合,并用_______ 搅拌,使溶液混合均匀。经计算此反应共放出Q kJ的热量,请写出表示中和热的热化学方程式:________ 。
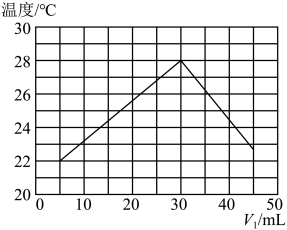
(1)研究小组做该实验时环境温度
(2)由题干及图形可知:V1∶V2=
(3)实验时将酸碱在简易量热计中混合,并用

您最近一年使用:0次
2019-11-27更新
|
165次组卷
|
4卷引用:云南省曲靖市会泽县茚旺高级中学2020届高三上学期11月月考化学试题
云南省曲靖市会泽县茚旺高级中学2020届高三上学期11月月考化学试题湖南省永州市宁远县第一中学2019-2020学年高二上学期期中考试化学试题河南省鹤壁市高级中学2018-2019学年高一下学期第一次段考化学试题(已下线)1.1.2 反应热的测量和计算(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)
10 . 用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作不 正确的是
| A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 |
| B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C.滴定时,眼睛观察锥形瓶中溶液颜色的变化 |
| D.读数时,视线与滴定管内液体的凹液面最低处保持水平 |
您最近一年使用:0次
2019-11-05更新
|
188次组卷
|
2卷引用:云南省玉溪市江川区二中2019-2020学年高二上学期期末考试化学试题



