解题方法
1 . I.实验室利用如图装置进行中和热的测定,回答问题:

(1)从实验装置上看,图中尚缺少的玻璃用品是_______ ,缺少用品不能改为金属(如铜),其原因是_______ 。
Ⅱ.实验室用0.100mol•L﹣1NaOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准NaOH溶液注入碱式滴定管至0刻度以上2~3cm
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
(2)正确操作步骤的顺序是_______ 。(用序号字母填写)
(3)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的_______ 操作。(填“甲”、“乙”、“丙”)。

(4)用0.1000mol/L的NaOH标准溶液未知浓度盐酸,滴定时左手_______ ,右手_______ ,两眼_______ ,直到滴定终点。
(5)若用酚酞作指示剂,判断到达滴定终点的实验现象是_______ 。
(6)下列操作会导致实验结果偏低的是_______。(填标号)
(7)某学生进行3次实验得到相关数据如表所示。
则盐酸的物质的量浓度为_______ mol•L﹣1(保留四位小数)。

(1)从实验装置上看,图中尚缺少的玻璃用品是
Ⅱ.实验室用0.100mol•L﹣1NaOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准NaOH溶液注入碱式滴定管至0刻度以上2~3cm
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
(2)正确操作步骤的顺序是
(3)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的

(4)用0.1000mol/L的NaOH标准溶液未知浓度盐酸,滴定时左手
(5)若用酚酞作指示剂,判断到达滴定终点的实验现象是
(6)下列操作会导致实验结果偏低的是_______。(填标号)
| A.碱式滴定管未用标准NaOH溶液润洗 |
| B.盛装未知液的锥形瓶用蒸馏水洗后再用未知液润洗 |
| C.滴定终点读数时,仰视滴定管的刻度 |
| D.滴定过程中振荡锥形瓶,液体不慎溅出 |
| 滴定次数 | 待测盐酸 的体积/mL | 消耗0.1000mol•L﹣1NaOH溶液的体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
您最近一年使用:0次
解题方法
2 . 25℃下,某同学按图1所示,边用磁力搅拌器搅拌边向20.00mL浓度为 的
的 溶液中逐滴加入0.1000 mol∙L−1的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是
溶液中逐滴加入0.1000 mol∙L−1的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是

 的
的 溶液中逐滴加入0.1000 mol∙L−1的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是
溶液中逐滴加入0.1000 mol∙L−1的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是
| A.选择酚酞指示反应终点,误差比甲基橙的小 |
| B.N点溶液中:c(Na+)>c(CH3COO-) >c(OH-) >c(H+) |
| C.M点溶液中:c(CH3COOH) >c(Na+)>c(CH3COO-) |
| D.水的电离程度:N>M>P |
您最近一年使用:0次
名校
3 . 室温下,向20.00mL0.1000mol•L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与pH随加如稀硫酸体积的变化如图所示。下列说法正确的是
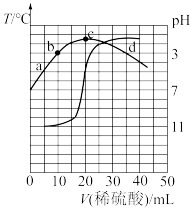

| A.稀硫酸的浓度为0.1000mol•L-1 |
| B.室温下MOH的电离平衡常数Kb=1.0×10-6 |
| C.b点对应的溶液中:2c(OH-)+c(MOH)=c(M+)+2c(H+) |
D.当pH=7时,溶液中存在c(H+)=c(OH-)<c(M+)<c(SO ) ) |
您最近一年使用:0次
2021-12-16更新
|
573次组卷
|
4卷引用:云南省师范大学附属中学2021-2022学年上学期高三高考适应性月考卷(五)理科综合化学试题
名校
解题方法
4 . 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
步骤一:配制 标准溶液。
标准溶液。
步骤二:取 待测稀盐酸放入锥形瓶中,并滴加
待测稀盐酸放入锥形瓶中,并滴加 滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作
滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作 次,记录数据如下。
次,记录数据如下。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器除烧杯、玻璃棒外还有______ 、_____ 。
(2)如何准确判断滴定终点____ 。
(3)如图某次实验的滴定管中的液面,其读数为_______  。
。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有_______ (填字母序号)。
A.配制标准溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(5)排去碱式滴定管中气泡的方法应采用图的__________ 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(6)从实验所得数据计算,盐酸溶液的浓度为________  。(结果保留到小数点后两位)
。(结果保留到小数点后两位)
步骤一:配制
 标准溶液。
标准溶液。步骤二:取
 待测稀盐酸放入锥形瓶中,并滴加
待测稀盐酸放入锥形瓶中,并滴加 滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作
滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作 次,记录数据如下。
次,记录数据如下。实验编号 | 盐酸溶液 | 滴定管起始读数 | 滴定管滴定终点读数 |
1 | 20.00 | 0.00 | 22.58 |
2 | 20.00 | 0.00 | 22.60 |
3 | 20.00 | 0.00 | 22.62 |
(1)步骤一中要用到的玻璃仪器除烧杯、玻璃棒外还有
(2)如何准确判断滴定终点
(3)如图某次实验的滴定管中的液面,其读数为
 。
。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有
A.配制标准溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(5)排去碱式滴定管中气泡的方法应采用图的

(6)从实验所得数据计算,盐酸溶液的浓度为
 。(结果保留到小数点后两位)
。(结果保留到小数点后两位)
您最近一年使用:0次
2021-11-10更新
|
158次组卷
|
3卷引用:云南省弥勒市第一中学2021-2022学年高二上学期第三次月考化学试题
名校
5 . 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度产生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。现利用盐酸滴定某溶液中碳酸钠的含量,其电位滴定曲线如图所示。下列说法错误的是
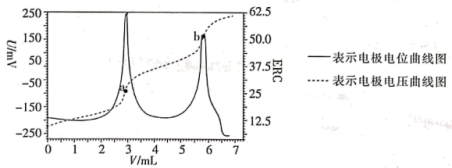

| A.根据图象可知,该滴定过程中不需滴加指示剂 |
B.a点溶液中存在: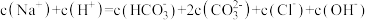 |
| C.b点溶液中溶质为NaCl,此时溶液一定呈中性 |
| D.从a点到b点的过程中,水的电离程度逐渐减小 |
您最近一年使用:0次
2021-07-15更新
|
658次组卷
|
5卷引用:云南省部分名校2020-2021学年高二下学期期末联考化学试题
云南省部分名校2020-2021学年高二下学期期末联考化学试题河南省2020-2021学年高二下学期期末考试化学试题贵州省黔西南州2020-2021学年高二下学期期末检测理科化学试题(已下线)必考点07 盐类的水解-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)四川省宜宾市第四中学校2022-2023学年高二下学期6月期末化学试题
名校
6 . 25℃时,用0.1mol·L−1NaOH溶液滴定20mL0.1mol·L−1HX溶液,溶液的pH随加入的NaOH溶液体积的变化如图所示。下列说法错误的是
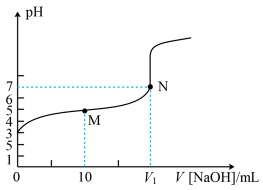

| A.HX的Ka约为1×10−5 |
| B.V1 < 20 |
| C.M点溶液中c(HX)+c(H+)= c(OH-)+c(X−) |
| D.V(NaOH)=20mL时,溶液中c(Na+)>c(X−)>c(OH−)>c(H+) |
您最近一年使用:0次
2021-07-14更新
|
379次组卷
|
2卷引用:云南省云天化中学2022届高三摸底测试化学试题
名校
7 . 中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
Ⅰ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)_______ ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_______ 。
(2)滴定时,用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视_______ ,直到滴定终点。
(3)如图是某次滴定时的滴定管中的液面,其读数为_______ mL。

Ⅱ.维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,下面是测定实验分析报告。(请填写空白)
测定目的:测定××牌软包装橙汁中维生素C的含量。
测定原理:C6H8O6+I2→C6H6O6+2H++2I-(待测橙汁中其他物质不与I2反应)
(1)实验用品及试剂:指示剂_______ (填名称),浓度为7.50×10-3mol·L-1的I2标准溶液、蒸馏水等。
(2)实验过程:洗涤仪器,检查滴定管是否漏液,装好标准碘溶液待用。用酸式滴定管向锥形瓶中加入25.00mL待测橙汁,滴入2滴指示剂。进行滴定,滴定至终点时的现象是_______ 。
(3)数据记录与处理:重复上述实验2-3次后,平均消耗I2标准溶液的体积为15.00mL,则此橙汁中维生素C的含量是_______ g·L-1(保留2位小数)。
(4)下列操作,可能引起所测维生素C的含量偏高的是_______ 。
①用蒸馏水冲洗锥形瓶
②在滴定过程中不慎将数滴I2标准溶液滴在锥形瓶外
③读数时,滴定前仰视,滴定后俯视
Ⅰ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)
(2)滴定时,用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视
(3)如图是某次滴定时的滴定管中的液面,其读数为

Ⅱ.维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,下面是测定实验分析报告。(请填写空白)
测定目的:测定××牌软包装橙汁中维生素C的含量。
测定原理:C6H8O6+I2→C6H6O6+2H++2I-(待测橙汁中其他物质不与I2反应)
(1)实验用品及试剂:指示剂
(2)实验过程:洗涤仪器,检查滴定管是否漏液,装好标准碘溶液待用。用酸式滴定管向锥形瓶中加入25.00mL待测橙汁,滴入2滴指示剂。进行滴定,滴定至终点时的现象是
(3)数据记录与处理:重复上述实验2-3次后,平均消耗I2标准溶液的体积为15.00mL,则此橙汁中维生素C的含量是
(4)下列操作,可能引起所测维生素C的含量偏高的是
①用蒸馏水冲洗锥形瓶
②在滴定过程中不慎将数滴I2标准溶液滴在锥形瓶外
③读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
2021-04-21更新
|
124次组卷
|
2卷引用:云南省玉溪市一中2020-2021学年高二下学期4月月考化学试题
解题方法
8 . 酸碱中和滴定是重要的定量实验,准确量取25.00mL某待测浓度的盐酸于锥形瓶中,用0.1000mol/L的氢氧化钠标准溶液滴定。下列说法正确的是( )
| A.锥形瓶用蒸馏水洗涤以后,再用待测液进行润洗 |
| B.使用酚酞为指示剂,当锥形瓶中的溶液由红色变为无色时停止滴定 |
| C.滴定达到终点时,俯视刻度线进行读数,则测定结果偏低 |
| D.实验结束,某同学记录的氢氧化钠溶液的体积为21.6mL |
您最近一年使用:0次
2020-08-19更新
|
157次组卷
|
6卷引用:云南省曲靖市马龙二中2020-2021学年高二5月月考化学试题
云南省曲靖市马龙二中2020-2021学年高二5月月考化学试题云南省保山市中小学2019-2020学年高二下学期期末教育教学质量监测化学试题河北省邯郸市大名一中、磁县一中,邯山区一中,永年一中等六校2020-2021学年高二上学期期中考试化学试题 (已下线)3.2.2 pH的计算及应用(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)练习10 pH的应用-酸碱中和滴定-2020-2021学年【补习教材·寒假作业】高二化学(人教版)(已下线)练习12 酸碱中和滴定-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)
名校
9 . 下列有关叙述中正确的是( )
| A.滴定管下端连有橡皮管的为酸式滴定管 |
| B.在滴定时,左手操作锥形瓶,右手操作滴定管开关 |
| C.滴定前应首先排除尖嘴部分的气泡 |
| D.滴定过程中两眼应注视滴定管内液面的变化 |
您最近一年使用:0次
2018-12-12更新
|
859次组卷
|
14卷引用:云南省玉溪市江川区第二中学2021-2022学年高二上学期12月考试化学试题
云南省玉溪市江川区第二中学2021-2022学年高二上学期12月考试化学试题云南省昭通市水富县第二中学2019-2020学年高二上学期期末考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)宁夏回族自治区吴忠中学2018-2019学年高二上学期期末模拟化学试题吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题新疆吾尔自治区沙雅县第一中学2019-2020学年高二下学期期末考试化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第4节 离子反应 课时2 离子反应的应用——酸碱中和滴定海南省万宁市民族中学2019-2020学年度高二上学期期末考试化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)作业(十六) 酸碱中和滴定甘肃省天水市秦安县第一中学2022-2023学年高二上学期期末考试化学试题
真题
名校
10 . 298 K时,在20.0 mL 0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
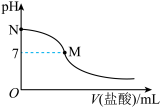

| A.该滴定过程应该选择酚酞作为指示剂 |
| B.M点对应的盐酸体积为20.0 mL |
| C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-) |
| D.N点处的溶液中pH<12 |
您最近一年使用:0次
2016-06-10更新
|
9706次组卷
|
56卷引用:云南省弥勒市第一中学2021-2022学年高二上学期第三次月考化学试题
云南省弥勒市第一中学2021-2022学年高二上学期第三次月考化学试题云南省普洱市西盟佤族自治县第一中学2021-2022学年高二上学期12月月考化学试题云南省曲靖市宣威市第九中学2019-2020学年高二上学期第二次段考化学试题福建省莆田锦江中学2020-2021学年高二上学期期末考试化学试题黑龙江省佳木斯一中2021-2022学年高二上学期第二次月考化学试题河北省石家庄市藁城区第一中学2021-2022学年高二上学期12月月考化学试题云南省普洱市第一中学2021-2022学年高三下学期3月份考试理综化学试题广东省深圳市第七高级中学2021-2022学年高三上学期第四次月考(12月)化学试题 2015-2016学年河南省南阳一中高二下期末模拟化学试卷2016年全国普通高等学校招生统一考试化学(新课标1卷精编版)2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷福建省龙海市程溪中学2016-2017学年高二下学期期末考试化学试题河南省驻马店市2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习专题八对接高考精练--水的电离和溶液的酸碱性江苏省泰州中学2018届高三10月月考化学试题广东省中山市第一中学2017-2018学年高二上学期第二次统测化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二12月月考化学试题(B卷)内蒙古巴彦淖尔市第一中学2017-2018学年高二12月月考化学试题(A卷)江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题江西省上饶县中学2017-2018学年高二上学期补考化学试题(已下线)解密11 弱电解质的电离和溶液的酸碱性——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】四川省成都市七中实验学校2019届高三上学期10月月考化学试题河南省安阳市第三十六中学2018-2019学年高二上学期期中考试化学试题湖南省邵东县创新实验学校2019届高三上学期第五次月考化学试题2016年全国普通高等学校招生统一考试化学(全国1卷参考版)广东省深圳外国语学校2019届高三第一次月考理综化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题河北安平中学2019-2020学年高二上学期第二次月考化学试题安徽省肥东县第二中学2019-2020学年高二上学期期中考试化学试题吉林省延边第二中学2019-2020学年高二上学期期中考化学(理)试题湖北省沙市中学2019-2020学年高二上学期期中考试化学(选考)试题(已下线)专题8.2 水的电离和溶液的pH(练)-《2020年高考一轮复习讲练测》湖北省黄冈市浠水实验高中2019—2020学年高二上学期12月月考化学试题福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题备考突破2020高三化学专题强化集训——三大守恒原理的应用夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——与pH相关的计算综合(强化练习)备考突破2020高三化学专题强化集训——电解质溶液中的曲线问题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定【懂做原理题】2020届高三化学选修4二轮专题练——弱电解质的电离 【精编24题】湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题5 滴定曲线复习题陕西省西安中学2019-2020学年高二上学期期末考试化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题1 弱电解质的电离复习题贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训湖南省娄底市2019-2020学年高二下学期期末考试化学试题山西省运城市新绛中学2021届高三上学期8月月考化学试题(已下线)易错18 电解质溶液图像-备战2021年高考化学一轮复习易错题(已下线)易错15 酸碱中和滴定及应用-备战2021年高考化学一轮复习易错题河北省石家庄市藁城区第一中学2019-2020学年高二上学期第二次月考化学试题广东省珠海市第二中学2020-2021学年高二上学期10月月考化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)【教材实验热点】15 酸碱中和滴定广西壮族自治区玉林市第一中学2022-2023学年高二上学期期末考试化学试题河南省新教材2022-2023学年高二上学期第三次阶段性模拟测试化学试题广东省华南师范大学附属中学2022-2023学年高二上学期1月期末化学试题




