2020·浙江·模拟预测
1 . 室温下,向20.00mL0.1000mol•L-1盐酸中滴加0.1000mol•L-1NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7。下列说法不正确的是
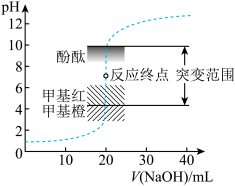
| A.NaOH与盐酸恰好完全反应时,pH=7 |
| B.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
| C.选择甲基红指示反应终点,误差比甲基橙的大 |
| D.V(NaOH)=30.00mL时,pH≈12.3 |
您最近一年使用:0次
2023-10-21更新
|
877次组卷
|
51卷引用:山东省济南市大学城实验高级中学2021届高三1月阶段性考试化学试题
山东省济南市大学城实验高级中学2021届高三1月阶段性考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)广西贵港市覃塘区覃塘高级中学2020-2021学年高二下学期3月月考化学试题浙江省杭州市长征中学2020-2021学年高二下学期第二学期阶段性练习化学试题选择性必修1(SJ)专题3专题培优专练选择性必修1 专题3素养检测(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题3.2.2 酸碱中和滴定和pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)湖北省麻城市实验高级中学2021-2022学年高二上学期9月月考化学(B卷)试卷内蒙古鄂尔多斯市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)3.2.2 酸碱中和滴定和pH的计算-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题14.水溶液中的离子平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)安徽师范大学附属中学2021-2022学年高二上学期期中考查化学试题浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高二上学期期中联考化学试题(已下线)专题25 水的电离和溶液的酸碱性(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题广东省化州市第一中学2019-2020学年高二4月线上统一测试化学试题江苏省启东中学2020-2021学年高二上学期第一次月考化学试题湖南省怀化市2020-2021学年高二上学期10月联考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题4 滴定终点专练(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)陕西省汉中中学2021-2022学年高二上学期第四次月考化学试题(已下线)第24讲 水的电离和溶液的pH(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省株洲市五雅中学2022-2023学年高二上学期11月期中考试化学试题 广西钦州市2022-2023学年高二上学期第2次教学质量监测化学试卷(已下线)题型133 酸碱中和滴定实验及误差分析(已下线)第八章 水溶液中的离子反应与平衡 第48练 酸碱中和反应及中和滴定上海市华东政法大学附属中学2022-2023学年高二下学期期中考试(等级考)化学试题(已下线)第12讲 酸碱中和滴定和氧化还原反应滴定-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)作业(十六) 酸碱中和滴定(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 酸碱中和滴定河北省衡水市第二中学2023-2024学年高三上学期学科素养评估(三调)化学试题【定心卷】3.2.3 酸碱中和滴定随堂练习-人教版2023-2024学年选择性必修1江苏省无锡市锡东高级中学2023-2024学年高二下学期期中考试化学试题天津市和平区2023-2024学年高三下学期第二次质量调查化学试卷
名校
解题方法
2 . 重铬酸铵[(NH4)2Cr2O7]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室中将NH3通入重铬酸(H2Cr2O7)溶液制备(NH4)2Cr2O7的装置如图所示(夹持装置略)。回答下列问题:

已知:Cr2O +H2O
+H2O 2CrO
2CrO +2H+。
+2H+。
(1)仪器a的名称是_______ ,b 处的作用为_______ ;实验时控制三颈烧瓶内溶液pH约为4,pH不宜过大的原因是_______ ;A 装置的作用为_______ 。
(2)利用甲醛法测定市售(NH4)2Cr2O7的质量分数(杂质不参与反应),实验步骤如下:
①称取产物m g,配成500mL溶液,用_______ (填“酸式”或“碱式”)滴定管 移取25.00 mL 样品溶液于250mL锥形瓶中。加入BaCl2溶液使Cr2O 完全沉淀,反应原理为2Ba2++Cr2O
完全沉淀,反应原理为2Ba2++Cr2O +H2O=2BaCrO4↓+2H+。若滴定管规格为50.00 mL,样品溶液起始读数为5.00 mL,此时滴定管中样品溶液的实际体积为
+H2O=2BaCrO4↓+2H+。若滴定管规格为50.00 mL,样品溶液起始读数为5.00 mL,此时滴定管中样品溶液的实际体积为_______ (填标号)。
A.5.00 mL B.45.00 mL C.大于45.00 mL D.小于5.00 mL
②向锥形瓶中加入足量的甲醛溶液,反应原理为4NH +6HCHO=3H++6H2O+(CH2)6N4H+[与NaOH反应时,1mol(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用cmol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为VmL。滴定终点的现象为
+6HCHO=3H++6H2O+(CH2)6N4H+[与NaOH反应时,1mol(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用cmol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为VmL。滴定终点的现象为_______ ;所得产物中(NH4)2Cr2O7(摩尔质量为Mg·mol-1)的质量分数为_______ %;若滴定终点时仰视读数,则测定的质量分数将_______ (填“偏大”“偏小”或“不变”)。

已知:Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+。
+2H+。(1)仪器a的名称是
(2)利用甲醛法测定市售(NH4)2Cr2O7的质量分数(杂质不参与反应),实验步骤如下:
①称取产物m g,配成500mL溶液,用
 完全沉淀,反应原理为2Ba2++Cr2O
完全沉淀,反应原理为2Ba2++Cr2O +H2O=2BaCrO4↓+2H+。若滴定管规格为50.00 mL,样品溶液起始读数为5.00 mL,此时滴定管中样品溶液的实际体积为
+H2O=2BaCrO4↓+2H+。若滴定管规格为50.00 mL,样品溶液起始读数为5.00 mL,此时滴定管中样品溶液的实际体积为A.5.00 mL B.45.00 mL C.大于45.00 mL D.小于5.00 mL
②向锥形瓶中加入足量的甲醛溶液,反应原理为4NH
 +6HCHO=3H++6H2O+(CH2)6N4H+[与NaOH反应时,1mol(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用cmol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为VmL。滴定终点的现象为
+6HCHO=3H++6H2O+(CH2)6N4H+[与NaOH反应时,1mol(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用cmol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为VmL。滴定终点的现象为
您最近一年使用:0次
2022-01-13更新
|
786次组卷
|
4卷引用:山东省济南市2021-2022学年上学期高三上学期1月学情检测化学试题
名校
解题方法
3 . 某同学用0.1000 NaOH溶液滴定未知浓度的盐酸,操作如下:①用蒸馏水洗涤碱式滴定管后,注入NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线以下,并记录读数;④用量筒量取20.00mL盐酸,转移至锥形瓶中,加入几滴酚酞溶液;⑤向其中滴加NaOH溶液并不断摇动锥形瓶,眼睛时刻注视滴定管中的液面变化:⑥当看到滴入半滴NaOH溶液后,溶液变成红色即停止滴定,记录读数。实验中存在的错误有几处?
NaOH溶液滴定未知浓度的盐酸,操作如下:①用蒸馏水洗涤碱式滴定管后,注入NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线以下,并记录读数;④用量筒量取20.00mL盐酸,转移至锥形瓶中,加入几滴酚酞溶液;⑤向其中滴加NaOH溶液并不断摇动锥形瓶,眼睛时刻注视滴定管中的液面变化:⑥当看到滴入半滴NaOH溶液后,溶液变成红色即停止滴定,记录读数。实验中存在的错误有几处?
 NaOH溶液滴定未知浓度的盐酸,操作如下:①用蒸馏水洗涤碱式滴定管后,注入NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线以下,并记录读数;④用量筒量取20.00mL盐酸,转移至锥形瓶中,加入几滴酚酞溶液;⑤向其中滴加NaOH溶液并不断摇动锥形瓶,眼睛时刻注视滴定管中的液面变化:⑥当看到滴入半滴NaOH溶液后,溶液变成红色即停止滴定,记录读数。实验中存在的错误有几处?
NaOH溶液滴定未知浓度的盐酸,操作如下:①用蒸馏水洗涤碱式滴定管后,注入NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线以下,并记录读数;④用量筒量取20.00mL盐酸,转移至锥形瓶中,加入几滴酚酞溶液;⑤向其中滴加NaOH溶液并不断摇动锥形瓶,眼睛时刻注视滴定管中的液面变化:⑥当看到滴入半滴NaOH溶液后,溶液变成红色即停止滴定,记录读数。实验中存在的错误有几处?| A.3 | B.4 | C.5 | D.6 |
您最近一年使用:0次
2021-12-03更新
|
545次组卷
|
5卷引用:山东省日照市五莲县2021-2022学年高二上学期期中考试化学试题
名校
解题方法
4 . 室温下,向10mL HA溶液中滴加
HA溶液中滴加 的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知:
的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知: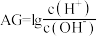 。
。

下列说法错误的是
 HA溶液中滴加
HA溶液中滴加 的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知:
的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知: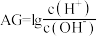 。
。
下列说法错误的是
| A.在a、b、c、d点对应的溶液中,c点时水的电离程度最大 |
B.b点对应的溶液中: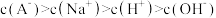 |
C.d点对应的溶液中: |
D.室温下,HA的电离常数 约为1.0 约为1.0 10-4 10-4 |
您最近一年使用:0次
2021-12-02更新
|
1004次组卷
|
6卷引用:山东省2021-2022学年高二12月“山东学情”联考(鲁科版)化学试题
山东省2021-2022学年高二12月“山东学情”联考(鲁科版)化学试题广东省2021-2022学年高三11月联考化学试题河南省名校联盟2021-2022学年高三上学期11月联考化学试题湖北省公安县等六县2021-2022学年高三上学期质检考试化学试题广东省惠州市惠阳高级中学实验学校2021-2022学年高三上学期月考化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)
5 . 常温下,用0.1mol·L-1NaOH溶液分别滴定20.00mL起始浓度也均为0.1mol·L-1的HM和HN溶液(酸性:HM>HN),滴定曲线如图所示。已知当Ka≤10-5时,可以认为弱酸达电离平衡时的浓度近似等于起始浓度;1g5=0.7。

(1)曲线Ⅱ对应的酸为___________ ,弱酸HM的电离常数为___________ 。
(2)在B1和B2点对应的溶液中,应满足的关系为c(HM)-c(HN)=___________ 。c(Na+)、c(M-)和c(N-)离子浓度有小到大的顺序为___________ 。
(3)当溶液pH=7时,两曲线对应溶液中水电离出的c(H+)关系为c(H+)I___________ c(H+)II (填“>”“<”或“=”),曲线Ⅱ中加入NaOH物质的量与剩余酸的物质的量之比为___________ 。
(4)滴定终点C1和C2的纵坐标数值分别为___________ 、___________ 。

(1)曲线Ⅱ对应的酸为
(2)在B1和B2点对应的溶液中,应满足的关系为c(HM)-c(HN)=
(3)当溶液pH=7时,两曲线对应溶液中水电离出的c(H+)关系为c(H+)I
(4)滴定终点C1和C2的纵坐标数值分别为
您最近一年使用:0次
名校
解题方法
6 . I.25℃时,几种酸的电离平衡常数如下表所示。
(1)下列事实能说明亚硫酸的酸性强于碳酸的是___________。
(2)室温下,向10mI,pH=3的醋酸溶液中加入水稀释后,下列说法正确的是___________。
(3)同浓度的CH3COO-、HCO 、CO
、CO 、C1O-结合H+的能力由强到弱的顺序为
、C1O-结合H+的能力由强到弱的顺序为___________ 。
(4)将少量CO2气体通入NaClO溶液中,反应的离子方程式为___________ 。
II.常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则:

(5)表示 的是曲线
的是曲线___________ (填“I”或“II”);
(6)亚磷酸(H3PO3)的Ka1=___________ mol·L-1
| H2CO3 | H2SO3 | HClO | CH3COOH |
| Ka1=4.4x10-7 | Ka1=1.3x10-2 | Ka=4.7x10-8 | Ka=1.8x10-5 |
| Ka2=4.7x10-11 | Ka2=6.3x10-8 |
| A.饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH |
| B.亚硫酸能使酸性高锰酸钾溶液褪色,而碳酸不能 |
| C.同温下,等浓度的亚硫酸氢钠溶液和碳酸氢钠溶液,碳酸氢钠溶液的碱性强 |
| D.将过量二氧化硫气体通入碳酸氢钠溶液中,逸出的气体能使澄清石灰水变浑浊 |
| A.溶液中导电粒子的数目减少 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mL pH=11的NaOH溶液,混合液pH=7 |
 、CO
、CO 、C1O-结合H+的能力由强到弱的顺序为
、C1O-结合H+的能力由强到弱的顺序为(4)将少量CO2气体通入NaClO溶液中,反应的离子方程式为
II.常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则:

(5)表示
 的是曲线
的是曲线(6)亚磷酸(H3PO3)的Ka1=
您最近一年使用:0次
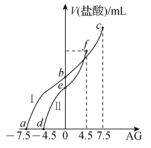
7 . 室温下,用0.1mol·L-1的盐酸分别滴定20mL0.1mol·L-1两种y元弱碱,AG与所加盐酸的体积(V)关系如图所示。已知:AG=lg 。
。
下列说法错误的是
 。
。
下列说法错误的是
| A.曲线I对应碱的碱性强于等浓度曲线II对应碱的碱性 |
| B.溶液中弱碱阳离子的浓度b点和e点相同 |
| C.由e点到f点的过程中水的电离程度逐渐减小 |
| D.Kb(II)约为10-8.5mol·L-1 |
您最近一年使用:0次
解题方法
8 . 实验室用0.01mol·L-1KOH标准溶液测定一元弱酸叠氮酸(HN3)的浓度。下列叙述错误的是
| A.可选用酚酞做指示剂 |
| B.开始平视,滴定终点仰视,测定结果偏低 |
C.KN3溶液呈碱性,其原因是: +H2O⇌HN3+OH- +H2O⇌HN3+OH- |
D.滴定终点的溶液中:c(K+)=c( )+c(HN3)-c(H+) )+c(HN3)-c(H+) |
您最近一年使用:0次
名校
9 . 如图是用EDTA(Na2H2Y)标准溶液滴定法测定油菜样品中Ca2+含量的流程。下列说法正确的是(已知:Ca2++H2Y2-=CaY2-+2H+)

| A.稀硝酸的作用是溶解,操作1是过滤 |
| B.配制溶液用到的玻璃仪器有容量瓶、烧杯、玻璃棒 |
| C.滴定过程中眼睛要注视滴定管内液面的变化 |
| D.平行滴定三次,平均消耗23.30mLEDTA溶液,则测得Ca2+含量为0.155% |
您最近一年使用:0次
2021-05-28更新
|
460次组卷
|
5卷引用:山东省青岛市2021届高三5月自主检测化学试题
山东省青岛市2021届高三5月自主检测化学试题(已下线)单项选择题1-5河北省保定市唐县第一中学2021-2022学年高二下学期期中考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第48练 酸碱中和反应及中和滴定(已下线)题型44 配位滴定
10 . 实验室制备氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}的实验步骤如图:

i.向V2O5中加入足量盐酸酸化的N2H4·2HCl溶液,微沸数分钟。
ii.向制得的VOCl2溶液中缓慢加入足量NH4HCO3溶液,有气泡产生并析出紫红色晶体。
iii.反应结束后抽滤,用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,静置一段时间后得到产品。
请回答下列问题:
(1)步骤i中的还原剂是___ (填化学式)。
(2)已知VO2+能被O2氧化,步骤ii可在如图装置中进行(夹持仪器略去),利用A中反应产生的气体将C中空气排净。
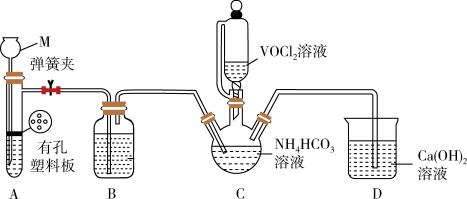
①仪器M的名称是___ 。
②装置B的作用是___ 。
(3)步骤ii中洗涤操作选择饱和NH4HCO3的原因是___ ,用无水乙醇洗涤的目的是___ 。
(4)蓝色VO2+的水合配离子的结构如图。向该水合配离子的溶液中加入NaOH至pH=12时,该水合配离子全部转化为褐色的[VO(OH)3]-,写出转化过程的离子方程式___ 。
(5)称量mg产品,用KMnO4溶液氧化,再除去多余的KMnO4(方法略),最后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(滴定过程只发生反应VO +Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为VmL,产品中钒的质量分数为
+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为VmL,产品中钒的质量分数为___ %(用含有m、c、V的式子表示)。
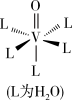

i.向V2O5中加入足量盐酸酸化的N2H4·2HCl溶液,微沸数分钟。
ii.向制得的VOCl2溶液中缓慢加入足量NH4HCO3溶液,有气泡产生并析出紫红色晶体。
iii.反应结束后抽滤,用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,静置一段时间后得到产品。
请回答下列问题:
(1)步骤i中的还原剂是
(2)已知VO2+能被O2氧化,步骤ii可在如图装置中进行(夹持仪器略去),利用A中反应产生的气体将C中空气排净。

①仪器M的名称是
②装置B的作用是
(3)步骤ii中洗涤操作选择饱和NH4HCO3的原因是
(4)蓝色VO2+的水合配离子的结构如图。向该水合配离子的溶液中加入NaOH至pH=12时,该水合配离子全部转化为褐色的[VO(OH)3]-,写出转化过程的离子方程式
(5)称量mg产品,用KMnO4溶液氧化,再除去多余的KMnO4(方法略),最后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(滴定过程只发生反应VO
 +Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为VmL,产品中钒的质量分数为
+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为VmL,产品中钒的质量分数为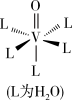
您最近一年使用:0次



