1 . 某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0 mL于锥形瓶,加入10.0 mL KI溶液(足量),发生反应为(Cl2+2I-=I2+2Cl-),滴入指示剂2~3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1的Na2S2O3标准液,调整液面。记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6(Na2S4O6溶液为无色)。
试回答下列问题:
(1)步骤①加入的指示剂是_______ 。
(2)步骤③当待测液由_______ 色变为_______ 色且30 s不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为_______ 。
(3)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度_______ (填“偏大”“偏小”或“相等”)。
(4)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度_______ (填“偏大”“偏小”或“相等”)。
①取废水样10.0 mL于锥形瓶,加入10.0 mL KI溶液(足量),发生反应为(Cl2+2I-=I2+2Cl-),滴入指示剂2~3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1的Na2S2O3标准液,调整液面。记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6(Na2S4O6溶液为无色)。
试回答下列问题:
(1)步骤①加入的指示剂是
(2)步骤③当待测液由
(3)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度
(4)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度
您最近一年使用:0次
解题方法
2 . 根据信息回答下列问题:
(1)25℃时,将0.02mol/L的Ba(OH)2溶液与物质的量浓度相同的NaHSO4溶液等体积混合,所得的溶液的pH=_______ 。
(2)25℃时,有0.1mol·L-1的四种溶液:①HCl②Na2CO3③CH3COOH④NaOH。上述四种溶液中,其中水的电离程度最大的是_______ (填序号,下同),溶液的pH值由大到小的顺序是_______ 。
(3)向碳酸钠溶液中加入明矾会产生沉淀和气体,反应的离子方程式为:_______ 。
(4)25℃某浓度的NaHCO3溶液的pH=9,则此时溶液中c(CO ):c(HCO
):c(HCO )=
)=_______ 。(已知H2CO3的电离常数:K1=4.4×10-7,K2=4.7×10-11.)
(5)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL。选择酚酞作指示剂,用标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如图所示,回答下列问题:

①滴定达到终点时的现象是_______ 。
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为_______ mL。

③若通过实验测得稀释后白醋的浓度为0.0600mol·L-1,则该白醋_______ (填“符合”或“不符合”)国家标准。
(1)25℃时,将0.02mol/L的Ba(OH)2溶液与物质的量浓度相同的NaHSO4溶液等体积混合,所得的溶液的pH=
(2)25℃时,有0.1mol·L-1的四种溶液:①HCl②Na2CO3③CH3COOH④NaOH。上述四种溶液中,其中水的电离程度最大的是
(3)向碳酸钠溶液中加入明矾会产生沉淀和气体,反应的离子方程式为:
(4)25℃某浓度的NaHCO3溶液的pH=9,则此时溶液中c(CO
 ):c(HCO
):c(HCO )=
)=(5)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL。选择酚酞作指示剂,用标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如图所示,回答下列问题:

①滴定达到终点时的现象是
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为

③若通过实验测得稀释后白醋的浓度为0.0600mol·L-1,则该白醋
您最近一年使用:0次
名校
3 . 草酸晶体的组成可表示为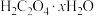 ,通过下列实验测定x值,步骤如下:
,通过下列实验测定x值,步骤如下:
①称取6.30g草酸晶体配成100mL水溶液。
②取25.00mL所配草酸溶液置于锥形瓶中,加入适量稀硫酸,用 溶液进行滴定,到达滴定终点时,消耗
溶液进行滴定,到达滴定终点时,消耗 溶液10.02mL。
溶液10.02mL。
③重复②步骤2次,消耗 溶液的体积分别为11.02mL和9.98mL。
溶液的体积分别为11.02mL和9.98mL。
(1)步骤①配制草酸溶液时,需用的玻璃仪器:烧杯、玻璃棒和___________ ;
(2)观察下图, 标准溶液应放入
标准溶液应放入___________ 滴定管中。(填“甲”或“乙”)判断到达滴定终点的实验现象是___________ ;

(3)其它操作正确的情况下,以下操作会引起误差的是___________。
(4)根据以上实验数据计算可知x=___________ 。
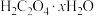 ,通过下列实验测定x值,步骤如下:
,通过下列实验测定x值,步骤如下:①称取6.30g草酸晶体配成100mL水溶液。
②取25.00mL所配草酸溶液置于锥形瓶中,加入适量稀硫酸,用
 溶液进行滴定,到达滴定终点时,消耗
溶液进行滴定,到达滴定终点时,消耗 溶液10.02mL。
溶液10.02mL。③重复②步骤2次,消耗
 溶液的体积分别为11.02mL和9.98mL。
溶液的体积分别为11.02mL和9.98mL。(1)步骤①配制草酸溶液时,需用的玻璃仪器:烧杯、玻璃棒和
(2)观察下图,
 标准溶液应放入
标准溶液应放入
(3)其它操作正确的情况下,以下操作会引起误差的是___________。
A.滴定管水洗后用 溶液润洗 溶液润洗 |
| B.锥形瓶用蒸馏水洗净之后,未用草酸溶液润洗 |
| C.开始滴定时滴定管尖嘴处有气泡,滴定结束气泡消失 |
| D.滴定终点读数时,俯视滴定管的刻度 |
您最近一年使用:0次
名校
解题方法
4 . 用 溶液滴定未知浓度的盐酸溶液,在滴定过程中,若出现下列情况会使测定结果偏低的是
溶液滴定未知浓度的盐酸溶液,在滴定过程中,若出现下列情况会使测定结果偏低的是
 溶液滴定未知浓度的盐酸溶液,在滴定过程中,若出现下列情况会使测定结果偏低的是
溶液滴定未知浓度的盐酸溶液,在滴定过程中,若出现下列情况会使测定结果偏低的是| A.滴定达到滴定终点时,仰视读数 |
| B.在振荡锥形瓶时不慎将瓶内待测液溅出 |
| C.若在滴定过程中不慎将数滴碱液滴锥形瓶外 |
| D.用蒸馏水洗涤碱式滴定管后立即使用,没有用碱液润洗 |
您最近一年使用:0次
2021高三·全国·专题练习
名校
5 . 用中和滴定法测定某烧碱样品的纯度,假设烧碱样品中的杂质(可溶于水)与酸不反应,试根据实验回答下列问题:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除烧杯、玻璃棒外,还必须用到的仪器有___ 、____ 。
(2)取10.00mL待测液,用___ (填“酸式”或“碱式”)滴定管量取。
(3)用0.2010mol·L-1的标准盐酸滴定待测烧碱溶液(用酚酞作指示剂),滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到___ ,即达到滴定终点。
(4)根据表中数据,可计算出烧碱的纯度为___ (用百分数表示,结果保留小数点后一位小数)。
(5)排去碱式滴定管中的气泡应采用操作___ (填“甲”“乙”或“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(6)在该滴定实验中,下列操作(其他操作正确)会造成测定结果偏高的是___ (填序号)。
A.滴定终点读数时俯视读数
B.酸式滴定管水洗后未用标准盐酸润洗
C.锥形瓶水洗后未干燥
D.锥形瓶用蒸馏水洗后又用待测液润洗
E.滴定到指示剂刚变色,摇动锥形瓶后颜色恢复,没再继续滴定
F.酸式滴定管尖嘴部分有气泡,滴定后气泡消失
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除烧杯、玻璃棒外,还必须用到的仪器有
(2)取10.00mL待测液,用
(3)用0.2010mol·L-1的标准盐酸滴定待测烧碱溶液(用酚酞作指示剂),滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到
(4)根据表中数据,可计算出烧碱的纯度为
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |

(6)在该滴定实验中,下列操作(其他操作正确)会造成测定结果偏高的是
A.滴定终点读数时俯视读数
B.酸式滴定管水洗后未用标准盐酸润洗
C.锥形瓶水洗后未干燥
D.锥形瓶用蒸馏水洗后又用待测液润洗
E.滴定到指示剂刚变色,摇动锥形瓶后颜色恢复,没再继续滴定
F.酸式滴定管尖嘴部分有气泡,滴定后气泡消失
您最近一年使用:0次
2021高三·全国·专题练习
名校
解题方法
6 . 已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法正确的是


A.a点所得溶液中:2c(HSO )+c(SO )+c(SO )=0.1mol/L )=0.1mol/L |
B.b点所得溶液中:c(H+)+c(SO )=c(OH-)+c(H2SO3) )=c(OH-)+c(H2SO3) |
C.c点所得溶液中:c(Na+)>3c(HSO ) ) |
D.d点所得溶液中:c(Na+)>c(OH-)>c(SO ) ) |
您最近一年使用:0次
2021-09-05更新
|
827次组卷
|
4卷引用:江西省丰城市第九中学2021-2022学年高二上学期第二次月考(日新班)化学试题
江西省丰城市第九中学2021-2022学年高二上学期第二次月考(日新班)化学试题(已下线)课时44 滴定曲线、分布系数曲线的分析-2022年高考化学一轮复习小题多维练(全国通用)河北省石家庄市第二中学润德学校2021-2022学年高二上学期10月月考化学试题河北省石家庄市第二中学2021-2022学年高二上学期期末考试化学试题
名校
7 . t℃时,向20.00mL0.1mol/L二元弱酸H2X溶液中滴入0.1mol/LNaOH溶液,溶液中由水电离出的c水(OH-)的负对数[−lgc水(OH-)]与所加NaOH溶液体积的关系如图所示。下列说法中不正确的是


| A.水的电离程度:P>N=Q>M |
| B.P点溶液中:c(OH-)−c(H+)=c(HX-)+2c(H2X) |
| C.溶液中 c(H2X)/c(X2-):Q>P>N>M |
| D.M点溶液中:c(Na+)>c(HX-)>c(X2-)>c(H2X) |
您最近一年使用:0次
2021-07-13更新
|
336次组卷
|
2卷引用:江西省景德镇一中2020-2021学年高一下学期期末考试化学(2班)试题
8 . 化学中常用AG表示溶液的酸度(AG=lg 。室温下,向20.00mL0.1000ml·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是
。室温下,向20.00mL0.1000ml·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是
 。室温下,向20.00mL0.1000ml·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是
。室温下,向20.00mL0.1000ml·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是
| A.b、c、d三点对应的溶液中,水的电离程度大小为b=d>c |
| B.b点对应的溶液中:c(M+)-c(MOH)=2c(OH-)-2c(H+) |
C.当AG=0时,溶液中存在c(SO )>c(M+)>c(H+)=c(OH-) )>c(M+)>c(H+)=c(OH-) |
| D.室温下M+的水解常数Kh=10×10-5 |
您最近一年使用:0次
名校
解题方法
9 . 【1】在某温度(T℃)的水溶液中,c(H+)=10xmol/L,c(OH-)=10ymol/L,x与y关系如图所示。
(1)该温度下,水的离子积为___________ ,T℃___________ 25℃(填“大于”“小于”或“等于”)。
(2)将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为___________ 。(已知lg2=0.3)
(3)在此温度下,将pH=13的NaOH溶液VaL与pH=1的硫酸溶液VbL混合。若所得混合液的pH=2,则Va:Vb=___________ 。
【2】As2O3俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病。测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数实验过程如下:
①称取0.2g粗产品完全溶解于适量的NaOH溶液后,配制成含AsO 、AsO
、AsO 的混合溶液100mL。
的混合溶液100mL。
②分别移取25.00mL上述溶液于锥形瓶中,用0.02500mol/L的I2标准溶液进行滴定(在碱性环境中I2可将AsO 氧化为AsO
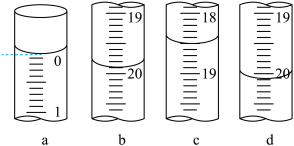
氧化为AsO ,指示剂为淀粉)。每次滴定开始时液面读数如图a所示,3次滴定结束时,I2标准溶液液面读数如图b~d所示。
,指示剂为淀粉)。每次滴定开始时液面读数如图a所示,3次滴定结束时,I2标准溶液液面读数如图b~d所示。
回答下列问题:
(1)配制成含AsO 、AsO
、AsO 的混合溶液时用到的定量仪器为
的混合溶液时用到的定量仪器为___________ 。
(2)滴定时将I2标准溶液装在如图中的___________ (填“甲”或“乙”)滴定管中。

(3)滴定终点的现象是___________ 。
(4)碱性环境中I2将AsO 氧化为AsO
氧化为AsO 的离子方程式是
的离子方程式是___________ 。
(5)粗产品中As2O3的质量分数为___________ 。若测定结果偏高,其原因可能是___________ (填字母)。
A.滴定管用蒸馏水洗净后未用标准溶液润洗
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水清洗后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液

(1)该温度下,水的离子积为
(2)将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为
(3)在此温度下,将pH=13的NaOH溶液VaL与pH=1的硫酸溶液VbL混合。若所得混合液的pH=2,则Va:Vb=
【2】As2O3俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病。测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数实验过程如下:
①称取0.2g粗产品完全溶解于适量的NaOH溶液后,配制成含AsO
 、AsO
、AsO 的混合溶液100mL。
的混合溶液100mL。②分别移取25.00mL上述溶液于锥形瓶中,用0.02500mol/L的I2标准溶液进行滴定(在碱性环境中I2可将AsO
 氧化为AsO
氧化为AsO ,指示剂为淀粉)。每次滴定开始时液面读数如图a所示,3次滴定结束时,I2标准溶液液面读数如图b~d所示。
,指示剂为淀粉)。每次滴定开始时液面读数如图a所示,3次滴定结束时,I2标准溶液液面读数如图b~d所示。回答下列问题:

(1)配制成含AsO
 、AsO
、AsO 的混合溶液时用到的定量仪器为
的混合溶液时用到的定量仪器为(2)滴定时将I2标准溶液装在如图中的

(3)滴定终点的现象是
(4)碱性环境中I2将AsO
 氧化为AsO
氧化为AsO 的离子方程式是
的离子方程式是(5)粗产品中As2O3的质量分数为
A.滴定管用蒸馏水洗净后未用标准溶液润洗
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水清洗后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
您最近一年使用:0次
2021-05-12更新
|
400次组卷
|
2卷引用:江西省吉安市安福二中、吉安县三中、井大附中三校2021-2022学年高二上学期12月联考化学试题
10 . 25°C时,以甲基橙为指示剂用0.1000 mol·L-1的NaOH溶液滴定二元酸H2X溶液。溶液的pH及溶液中H2X、 HX-及X2-的物质的量液度变化如图所示,下列说法错误的是
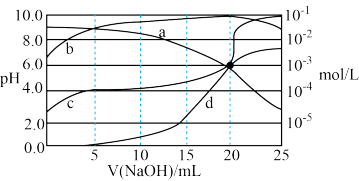

| A.a曲线表示c(H2X) ,d曲线表示c(X2-) |
| B.H2X的电离平衡常数Ka1 =1×10-4 |
C.V (NaOH) =5mL时,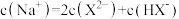 |
| D.滴定终点时:2c(H2X) +c(H+)= c(OH-)-c(HX-) |
您最近一年使用:0次



