名校
1 . 酸碱中和滴定是我们常用的一种定量分析方法。
Ⅰ.为测定某盐酸的浓度,用已知浓度的氢氧化钠溶液滴定。
(1)酸式滴定管排气泡的方法是____ 。
(2)用氢氧化钠标准溶液滴定,直至____ ,即为滴定终点。
(3)下列操作造成滴定结果偏高的是____ 。
a.滴定过程中向锥形瓶中加入少量蒸馏水
b.其他操作均正确,滴定终点读数时俯视滴定管的刻度
c.未用用氢氧化钠标准溶液润洗碱式滴定管
d.滴定终点读数时发现滴定管尖嘴处悬挂一滴液体
e.未用待测盐酸润洗酸式滴定管
(4)KMnO4常用于氧化还原滴定。滴定时应将KMnO4加入____ 滴定管中(填“酸式”或“碱式”)。
(5)高锰酸钾纯度的测定:称取3.16g高锰酸钾样品,溶解后定容于100ml容量瓶中,摇匀。取浓度为0.2000mol/L的H2C2O4标准溶液25.00mL,加入稀硫酸酸化,用高锰酸钾溶液平行滴定三次,平均消耗的体积为20.00mL,该样品的纯度为____ 。(已知2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)
Ⅱ.中和热的测定
(6)某实验小组用0.55mol/L的NaOH溶液和0.25mol/L的H2SO4的溶液进行中和热的测定。取50mLNaOH溶液和50mLH2SO4溶液在____ 中(填仪器名称)进行实验。数据如表:
近似认为50mL0.55mol/LNaOH溶液和50mL0.25mol/LH2SO4溶液的密度都是1g/mL,中和后生成溶液的比热容C=4.18J/(g∙℃),则测得中和热△H=___ kJ/mol(精确到小数点后一位)。
Ⅰ.为测定某盐酸的浓度,用已知浓度的氢氧化钠溶液滴定。
(1)酸式滴定管排气泡的方法是
(2)用氢氧化钠标准溶液滴定,直至
(3)下列操作造成滴定结果偏高的是
a.滴定过程中向锥形瓶中加入少量蒸馏水
b.其他操作均正确,滴定终点读数时俯视滴定管的刻度
c.未用用氢氧化钠标准溶液润洗碱式滴定管
d.滴定终点读数时发现滴定管尖嘴处悬挂一滴液体
e.未用待测盐酸润洗酸式滴定管
(4)KMnO4常用于氧化还原滴定。滴定时应将KMnO4加入
(5)高锰酸钾纯度的测定:称取3.16g高锰酸钾样品,溶解后定容于100ml容量瓶中,摇匀。取浓度为0.2000mol/L的H2C2O4标准溶液25.00mL,加入稀硫酸酸化,用高锰酸钾溶液平行滴定三次,平均消耗的体积为20.00mL,该样品的纯度为
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)Ⅱ.中和热的测定
(6)某实验小组用0.55mol/L的NaOH溶液和0.25mol/L的H2SO4的溶液进行中和热的测定。取50mLNaOH溶液和50mLH2SO4溶液在
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 25.2 | 25.0 | 25.1 | 28.5 |
| 2 | 26.2 | 26.4 | 26.3 | 32.5 |
| 3 | 25.3 | 25.3 | 25.3 | 28.8 |
| 4 | 26.1 | 26.5 | 26.3 | 29.6 |
您最近一年使用:0次
名校
解题方法
2 . I.用酸碱中和滴定法测定某烧碱的纯度。
(1)滴定管的使用:图1是一支50ml的滴定管滴定后的液面的示数,读数为_______ ;

(2)配制待测液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。
①滴定时,先向锥形瓶中加2~3滴甲基橙作为指示剂;滴定过程中操作错误的有_______
a.滴定时眼睛应注视标准液的体积变化
b.锥形瓶中指示剂变色后立即读数
c.盛装标准液的滴定管,用蒸馏水洗过后,还需要用待测液润洗2~3次
d.滴定时可用蒸馏水将锥形瓶内壁上的待测液冲下
②0.2000mol/l的盐酸标准液滴定烧碱的有关数据记录如表:
纯度计算:烧碱样品的纯度为_______ 。(保留小数点后两位)
II.滴定实验是化学学科中最重要的定量实验之一。葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O5作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案:

往实验中加入盐酸的目的是将Na2S2O5转化成SO2;滴定过程中发生的反应是:SO2+I2+2H2O=2HI+H2SO4。
(3)该滴定过程的指示剂是_______ ,滴定终点的现象为_______ 。
(4)实验消耗标准I2溶液50.00ml,所测样品中抗氧化剂的残留量(以游离SO2计算)为_______ g/L。(结果保留小数点后两位)
(5)下列情形会造成测定结果偏高的有_______(填序号)。
(6)析中,沉淀滴定也是常见的方法。以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+与CrO 反应生成砖红色沉淀指示滴定终点。当溶液中Cl-恰好沉淀完全时,c(CrO
反应生成砖红色沉淀指示滴定终点。当溶液中Cl-恰好沉淀完全时,c(CrO )=
)=_______ mol/L。(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10;离子浓度小于10-5mol/L时认为沉淀完全)
(1)滴定管的使用:图1是一支50ml的滴定管滴定后的液面的示数,读数为

(2)配制待测液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。
①滴定时,先向锥形瓶中加2~3滴甲基橙作为指示剂;滴定过程中操作错误的有
a.滴定时眼睛应注视标准液的体积变化
b.锥形瓶中指示剂变色后立即读数
c.盛装标准液的滴定管,用蒸馏水洗过后,还需要用待测液润洗2~3次
d.滴定时可用蒸馏水将锥形瓶内壁上的待测液冲下
②0.2000mol/l的盐酸标准液滴定烧碱的有关数据记录如表:
| 滴定序号 | 待测液体积(mL) | 消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.60 |
| 2 | 20.00 | 3.00 | 22.90 |
| 3 | 20.00 | 0.00 | 22.10 |
II.滴定实验是化学学科中最重要的定量实验之一。葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O5作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案:

往实验中加入盐酸的目的是将Na2S2O5转化成SO2;滴定过程中发生的反应是:SO2+I2+2H2O=2HI+H2SO4。
(3)该滴定过程的指示剂是
(4)实验消耗标准I2溶液50.00ml,所测样品中抗氧化剂的残留量(以游离SO2计算)为
(5)下列情形会造成测定结果偏高的有_______(填序号)。
| A.滴定持续时间稍长,溶液中部分HI被空气氧化 |
| B.盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗 |
| C.滴定前平视,滴定后俯视 |
| D.滴定前滴定管尖嘴有气泡滴定后气泡消失 |
 反应生成砖红色沉淀指示滴定终点。当溶液中Cl-恰好沉淀完全时,c(CrO
反应生成砖红色沉淀指示滴定终点。当溶液中Cl-恰好沉淀完全时,c(CrO )=
)=
您最近一年使用:0次
名校
3 . 用酸碱中和滴定法测定某烧碱的纯度。
Ⅰ.配制待测液:将1.70 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液。
Ⅱ.滴定
(1)盛装0.2000mol/L盐酸标准液应该用___________ 式滴定管。
(2)滴定时,应先向锥形瓶中加2~3滴___________ 作为指示剂;滴定过程中当___________ 时为滴定终点。
(3)有关数据记录如下:
NaOH溶液的浓度为___________ mol/L,烧碱样品的纯度为___________ 。
(4)若在实验过程中存在下列操作,则会使测定的结果偏小的是___________ 。
①若用蒸馏水冲洗锥形瓶
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外
③若刚见到指示剂局部的颜色有变化就停止滴定
④读数时,若滴定前仰视读数,滴定后俯视读数
(5)已知常温下:
①Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11;
②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。

①比较H2R、HR-、H2CO3三者的酸性强弱___________ 。
②NaHR溶液中存在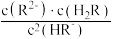 =
=___________ 。
Ⅰ.配制待测液:将1.70 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液。
Ⅱ.滴定
(1)盛装0.2000mol/L盐酸标准液应该用
(2)滴定时,应先向锥形瓶中加2~3滴
(3)有关数据记录如下:
| 滴定序号 | 待测液体积 (mL) | 消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
(4)若在实验过程中存在下列操作,则会使测定的结果偏小的是
①若用蒸馏水冲洗锥形瓶
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外
③若刚见到指示剂局部的颜色有变化就停止滴定
④读数时,若滴定前仰视读数,滴定后俯视读数
(5)已知常温下:
①Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11;
②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。

①比较H2R、HR-、H2CO3三者的酸性强弱
②NaHR溶液中存在
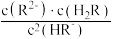 =
=
您最近一年使用:0次
名校
4 . 滴定是分析化学中重要的分析方法之一,酸碱中和滴定是最基本的滴定方法。根据其原理回答下列问题:
(1)某学生用0.1500 mol/L盐酸溶液滴定某未知浓度的 溶液。
溶液。
①实验除固定装置外还需要的玻璃仪器有:烧杯、碱式滴定管、酸式滴定管、_______ ;
②滴定管在使用之前应进行的操作是_______ ;
③滴定时右手_______ ,眼睛应注意观察_______ ;
④滴定结果如表所示:
计算该 溶液的物质的重浓度为
溶液的物质的重浓度为_______ mol/L(精确至0.0001)
(2)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035 g/mL。选择酚酞作指示剂,用0.0250 mol/L的标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如下图所示。

回答下列问题:
①滴定达到终点时的现象是_______ 。
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为_______ mL。

③通过实验测得稀释后白醋的物质的量浓度为_______ ,则该白醋_______ (“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是_______ (填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中振荡时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
F.用托盘天平称量NaOH固体(含KOH杂质)配制NaOH溶液
(1)某学生用0.1500 mol/L盐酸溶液滴定某未知浓度的
 溶液。
溶液。①实验除固定装置外还需要的玻璃仪器有:烧杯、碱式滴定管、酸式滴定管、
②滴定管在使用之前应进行的操作是
③滴定时右手
④滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.30 | 20.30 |
| 3 | 25.00 | 0.80 | 23.60 |
| 4 | 25.00 | 0.20 | 20.19 |
 溶液的物质的重浓度为
溶液的物质的重浓度为(2)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035 g/mL。选择酚酞作指示剂,用0.0250 mol/L的标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如下图所示。

回答下列问题:
①滴定达到终点时的现象是
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为

③通过实验测得稀释后白醋的物质的量浓度为
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中振荡时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
F.用托盘天平称量NaOH固体(含KOH杂质)配制NaOH溶液
您最近一年使用:0次
名校
5 . 已知CaCrO4微溶于水,某传统测定CaCrO4溶度积的实验如下:
①配制250mL待标定的K2CrO4溶液。
②标定测得K2CrO4溶液浓度为0.6025mol/L。
③按下表数据将0.2000mol/L CaCl2溶液、K2CrO4溶液及蒸馏水混匀,静置(溶液体积变化忽略不计)。
④取上层清液于锥形瓶中,加入H2SO4和H3PO4溶液酸化,溶液由黄色转变为橙色,加入指示剂,用0.2000mol/L (NH4)2Fe(SO4)2溶液滴定,数据记入如表。(表中溶液体积单位均为mL)
⑤滴定测出上层清液中的c(CrO ),进而计算出上层清液中的c(Ca2+),即得Ksp(CaCrO4)。
),进而计算出上层清液中的c(Ca2+),即得Ksp(CaCrO4)。
回答下列问题:
(1)步骤①中无需使用下列哪些仪器_______ 。(填标号)

(2)步骤④中所得橙色溶液中铬元素的主要存在形式为_______ (填化学式);滴定时还原产物为Cr3+,写出反应的离子方程式_______ 。
(3)根据第2组滴定数据,计算得上层清液中c(CrO )=
)=_______ mol·L-1。
(4)滴定时,有一组数据出现了明显异常,所测c(CrO )偏大,原因可能有_______。(填标号)
)偏大,原因可能有_______。(填标号)
(5)利用如表数据经计算绘制出如图点,请根据图点绘出溶度积曲线_______ 。
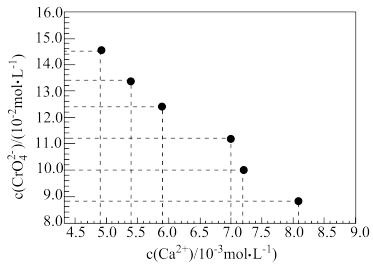
(6)请结合图线推测Ksp(CaCrO4)≈_______ 。(保留两位有效数字)
①配制250mL待标定的K2CrO4溶液。
②标定测得K2CrO4溶液浓度为0.6025mol/L。
③按下表数据将0.2000mol/L CaCl2溶液、K2CrO4溶液及蒸馏水混匀,静置(溶液体积变化忽略不计)。
④取上层清液于锥形瓶中,加入H2SO4和H3PO4溶液酸化,溶液由黄色转变为橙色,加入指示剂,用0.2000mol/L (NH4)2Fe(SO4)2溶液滴定,数据记入如表。(表中溶液体积单位均为mL)
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 |
| CaCl2(aq) | 25.00 | 25.00 | 25.00 | 25.00 | 25.00 | 25.00 |
| K2CrO4(aq) | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 |
| 蒸馏水 | 10.00 | 9.00 | 8.00 | 7.00 | 6.00 | 5.00 |
| 取上层清液 | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 |
| 耗(NH4)2Fe(SO4)2(aq) | 13.33 | 15.00 | 16.78 | 18.42 | 20.15 | 21.89 |
 ),进而计算出上层清液中的c(Ca2+),即得Ksp(CaCrO4)。
),进而计算出上层清液中的c(Ca2+),即得Ksp(CaCrO4)。回答下列问题:
(1)步骤①中无需使用下列哪些仪器

(2)步骤④中所得橙色溶液中铬元素的主要存在形式为
(3)根据第2组滴定数据,计算得上层清液中c(CrO
 )=
)=(4)滴定时,有一组数据出现了明显异常,所测c(CrO
 )偏大,原因可能有_______。(填标号)
)偏大,原因可能有_______。(填标号)| A.滴定终点读数时仰视刻度线 | B.达终点时滴定管尖嘴有标准液悬挂 |
| C.盛装待测液的锥形瓶未润洗 | D.摇动锥形瓶时有液体溅出 |

(6)请结合图线推测Ksp(CaCrO4)≈
您最近一年使用:0次
名校
6 . 常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如图。下列说法正确的是


| A.曲线I和曲线II分别代表的是CH3COOH和HCN |
| B.点③和点④所示溶液中由水电离出的c(H+): ③>④ |
C.点①和点②所示溶液中: |
D.在点②和③之间(不包括端点)存在关系: (A-代表溶液中的酸根离子) (A-代表溶液中的酸根离子) |
您最近一年使用:0次
2021-09-07更新
|
589次组卷
|
5卷引用:重庆市求精中学2021-2022学年高二上学期第二次月考化学试题
名校
解题方法
7 . 碱式氯化铜是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
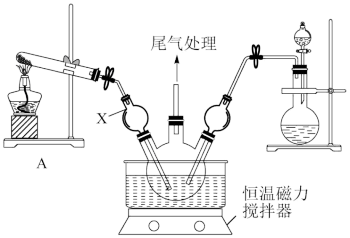
(1)仪器X的名称是___________ ,其主要作用有导气、___________ 。
(2)实验室利用装置A制NH3,发生反应的化学方程式为___________ 。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象有___________ 。
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29 g,加硝酸溶解,并加水定容至200 mL,得到待测液。
(4)铜的测定:取20.00 mL待测液,经测定Cu2+浓度为0.2 mol·L-1.则称取的样品中 n(Cu2+)=___________ mol。
(5)采用沉淀滴定法测定氯:用NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是一种难溶于水的白色固体),实验如下图:

①滴定时,应选用下列哪种物质作为指示剂___________ (填标号)。
a.FeSO4 b.Fe(NO3)3 c.FeCl3
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10.00 mL。则称取的样品中n(Cl-)=___________ mol。
(6)根据上述实验结果可推知无水碱式氯化铜的化学式为___________ 。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。

(1)仪器X的名称是
(2)实验室利用装置A制NH3,发生反应的化学方程式为
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象有
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29 g,加硝酸溶解,并加水定容至200 mL,得到待测液。
(4)铜的测定:取20.00 mL待测液,经测定Cu2+浓度为0.2 mol·L-1.则称取的样品中 n(Cu2+)=
(5)采用沉淀滴定法测定氯:用NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是一种难溶于水的白色固体),实验如下图:

①滴定时,应选用下列哪种物质作为指示剂
a.FeSO4 b.Fe(NO3)3 c.FeCl3
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10.00 mL。则称取的样品中n(Cl-)=
(6)根据上述实验结果可推知无水碱式氯化铜的化学式为
您最近一年使用:0次
2021-07-24更新
|
803次组卷
|
8卷引用:重庆育才中学高2021届高亖下学期二诊模拟考试化学试题
重庆育才中学高2021届高亖下学期二诊模拟考试化学试题重庆市第七中学校2022届高三第二次月考化学试题(已下线)理综化学-2021年秋季高三开学摸底考试卷03(课标全国专用)(已下线)第八单元 水溶液中的离子平衡(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)备战2022年高考化学精准检测卷【全国卷】01福建省泉州市安溪一中、泉州实验中学、养正中学2021-2022学年高三下学期期初联考化学试题吉林省四平市第一高级中学2022-2023学年高三上学期第三次月考化学试题(已下线)实验综合题
名校
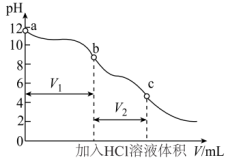
8 . 可用酚酞和甲基橙双指示剂法测定部分变质的烧碱中 的含量。先将部分变质的烧碱配制成一定浓度溶液并加入一种指示剂,用一定浓度的HCl溶液滴定至变色后,再加入另一种指示剂,继续用该HCl溶液滴定至变色,分别记录两个变色点加入HCl溶液体积进行计算。滴定过程中溶液pH的变化如图所示。下列说法错误的是
的含量。先将部分变质的烧碱配制成一定浓度溶液并加入一种指示剂,用一定浓度的HCl溶液滴定至变色后,再加入另一种指示剂,继续用该HCl溶液滴定至变色,分别记录两个变色点加入HCl溶液体积进行计算。滴定过程中溶液pH的变化如图所示。下列说法错误的是
 的含量。先将部分变质的烧碱配制成一定浓度溶液并加入一种指示剂,用一定浓度的HCl溶液滴定至变色后,再加入另一种指示剂,继续用该HCl溶液滴定至变色,分别记录两个变色点加入HCl溶液体积进行计算。滴定过程中溶液pH的变化如图所示。下列说法错误的是
的含量。先将部分变质的烧碱配制成一定浓度溶液并加入一种指示剂,用一定浓度的HCl溶液滴定至变色后,再加入另一种指示剂,继续用该HCl溶液滴定至变色,分别记录两个变色点加入HCl溶液体积进行计算。滴定过程中溶液pH的变化如图所示。下列说法错误的是
| A.指示剂的添加顺序为先加酚酞,后加甲基橙 |
B.b点时溶液中的溶质主要为NaCl和 |
C.若 ,则a点溶液中存在 ,则a点溶液中存在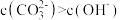 |
D.原固体混合物中碳酸钠的质量分数表示为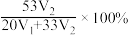 |
您最近一年使用:0次
2021-07-04更新
|
425次组卷
|
2卷引用:重庆市第七中学校2021-2022学年高二上学期期中考试化学试题
名校
9 . 下列与滴定实验有关的说法中正确的是
| A.用碱式滴定管准确量取20.00mL的高锰酸钾溶液 |
| B.NaOH标准液滴定盐酸,若滴定结束时俯视刻度,会导致测定结果偏高 |
| C.醋酸滴定未知浓度的NaOH溶液时,用甲基橙作指示剂,会导致测定结果偏高 |
D.用 滴定亚硫酸钠溶液时,当最后一滴高锰酸钾标准液滴入锥形瓶中,溶液颜色由无色变为粉红色时,即达滴定终点 滴定亚硫酸钠溶液时,当最后一滴高锰酸钾标准液滴入锥形瓶中,溶液颜色由无色变为粉红色时,即达滴定终点 |
您最近一年使用:0次
2021-05-02更新
|
298次组卷
|
5卷引用:重庆市缙云教育联盟2021-2022学年高三9月月度质量检测化学试题
10 . NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
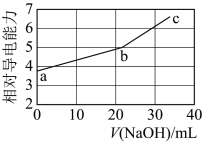

| A.混合溶液的导电能力与离子浓度和种类有关 |
| B.Na+与A2−的导电能力之和大于HA−的 |
| C.b点的混合溶液pH=7 |
| D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−) |
您最近一年使用:0次
2019-06-09更新
|
21039次组卷
|
67卷引用:重庆市育才中学2021届高三下学期入学考试化学试题
重庆市育才中学2021届高三下学期入学考试化学试题重庆育才中学2021-2022学年高二上学期第四次定时练习化学试题(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)天津市南开中学2021届高三上学期第五次月考化学试卷(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)选择性必修1(SJ)专题3专题培优专练(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第6讲 离子平衡坐标图像-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)山西省太原市第五中学2021-2022学年高二上学期12月月考化学试题2019年全国统一考试化学试题(新课标Ⅰ)(已下线)专题10 水溶液中的离子平衡——2019年高考真题和模拟题化学分项汇编安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题(已下线)专题8.1 弱电解质的电离平衡(讲)-《2020年高考一轮复习讲练测》2020届高考化学小题狂练(全国通用版)专练15 弱电解质的电离平衡和溶液酸碱性云南师范大学附属中学2019-2020学年高二上学期期中考试化学试题湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题江苏省海安高级中学2019-2020学年高二12月月考化学试题福建省莆田第二十五中学2020届高三上学期期末考试化学试题专题2.3 水溶液中的离子平衡(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升湖南省长沙市天心区雅礼中学2018-2019学年高二下学期期末考试化学试题湖南省长沙市雅礼中学2019-2020学年高二上学期期末考试化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训辽宁省本溪市2019-2020学年高二下学期寒假验收考试化学试题江苏省南通市2020届高三第二次模拟考试(5月) 化学 试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题北京市海淀区育英学校2020届高三三模化学试题天津市第一中学2020届高三下学期第五次月考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)3.3.2+影响盐类水解的主要因素和盐类水解的应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 高考帮(已下线)第03章 水溶液中的离子反应与平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关第25讲 弱电解质的电离平衡(精讲)-2021年高考化学一轮复习讲练测(已下线)【浙江新东方】【2020】【高三上】【一模】【HD-LP416】【化学】(已下线)【浙江新东方】112(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷30 水的电离与溶液的酸碱性——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷29 弱电解质的电离平衡——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷33 粒子浓度大小比较——2021年高考化学一轮复习小题必刷(通用版本)福建省连城县第一中学2021届高三上学期第二次月考化学试题(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习湖北省沙市中学2021-2022学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)浙江省绍兴市柯桥区2022届高考及选考科目5月适应性考试化学试题(已下线)专题10水溶液中的离子平衡-五年(2018~2022)高考真题汇编(全国卷)河北省秦皇岛市第一中学2021-2022学年高二下学期期末考试化学试题天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题(已下线)第21讲 电离平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省永州市宁远县第一中学2022-2023学年高二上学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第46讲 弱电解质的电离平衡(已下线)题型134 导电能力与酸碱中和滴定图像广东省汕头市金山中学2022-2023学年高二下学期期中考试化学试题(已下线)专题16 水溶液中的离子平衡(已下线)T11-电解质溶液(已下线)第31讲盐类的水解2018-2019学年度耀华实验学校第二学期高二实验化学期末试卷



