1 . 醋酸的电离方程式为CH3COOH(aq)⇌CH3COO-(aq)+H+(aq) ΔH>0,25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=1.75×10-5,是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是
| A.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)增大 |
| B.向该溶液中加少量CH3COONa固体,平衡逆向移动 |
| C.该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 |
| D.升高温度,c(H+)增大,Ka变大 |
您最近一年使用:0次
2021-10-18更新
|
1156次组卷
|
7卷引用:2020年北京高考化学真题变式题1-10
2020年北京高考化学真题变式题1-10吉林省长春北师大附属学校2021-2022学年高二上学期第一次月考化学试题(已下线)必考点05 电离平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)四川省绵阳南山中学2021-2022学年高二上学期12月月考化学试题河北省衡水市第十四中学(西校区)2021-2022学年高二上学期二调考试化学试题广东深圳市第二外国语学校2021-2022学年高二上学期期中测试化学试题广东省潮州湘桥区南春中学2021-2022学年高二上学期期中考试化学试题
2014·全国·一模
2 . 化学平衡常数(K)电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
| A.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大 |
| B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强 |
| C.向同浓度的碳酸钠和硫酸钠混合溶液中滴加氯化钡溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) |
| D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
您最近一年使用:0次
2020-11-15更新
|
324次组卷
|
8卷引用:2012届北京市清华附中高三考前适应性训练理综化学试卷
(已下线)2012届北京市清华附中高三考前适应性训练理综化学试卷(已下线)2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化2016-2017学年山东省寿光现代中学高二12月月考化学卷2天津市耀华中学2017-2018学年高二(上)化学期末试题湖南省长沙市长郡中学2018-2019学年高二上学期期末考试化学试题山东省邹城市第一中学2020-2021学年高二上学期期中质量检测化学试题山西省怀仁市第一中学云东校区2020-2021学年高二上学期第三次月考化学试题天津市第三中学2020-2021学年高二上学期12月月考化学试题
名校
3 . 室温时,向20mL0.1mol·L−1的两种酸HA、HB中分别滴加0.1mol·L−1NaOH溶液,其pH变化分别对应下图中的I、II。下列说法不正确的是


| A.向NaA溶液中滴加HB可产生HA |
| B.滴加NaOH溶液至pH=7时,两种溶液中c(A-)=c(B-) |
| C.a点,溶液中微粒浓度:c(A-)>c(Na+) |
| D.滴加20mLNaOH溶液时,I中H2O的电离程度大于II中 |
您最近一年使用:0次
2020-11-06更新
|
389次组卷
|
8卷引用:北京市西城区2020届高三一模化学试题
4 . 已知常温下,3种物质的电离平衡常数如下表:
下列说法不正确的是
| 物质 | HCOOH | CH3COOH | NH3·H2O |
| 电离平衡常数K | 1.77×10−4 | 1.75×10−5 | 1.76×10−5 |
| A.等物质的量浓度时,溶液pH:HCOONa<CH3COONa |
| B.pH均为3时,溶液浓度:c(HCOOH)>c(CH3COOH) |
| C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+) |
| D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7 |
您最近一年使用:0次
2020-05-11更新
|
304次组卷
|
5卷引用:北京市丰台区2020届高三第一次模拟考试化学试题
北京市丰台区2020届高三第一次模拟考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:化学平衡 离子平衡湖北省黄冈市麻城市实验高级中学2020届高三模拟(五)考试理综化学试题北京市通州区2021届高三上学期摸底考试化学试题天津市汇文中学2022-2023学年高二上学期第二次阶段性测试化学试题
解题方法
5 . 某同学探究温度对溶液pH值影响,加热一组试液并测量pH后得到如下数据(溶液浓度均为0.1mol/L):
下列说法正确的是
| 温度(℃) | 10 | 20 | 30 | 40 |
| 纯水 | 7.30 | 7.10 | 6.95 | 6.74 |
| NaOH溶液 | 13.50 | 13.11 | 12.87 | 12.50 |
| CH3COOH溶液 | 2.90 | 2.89 | 2.87 | 2.85 |
| CH3COONa溶液 | 9.19 | 9.00 | 8.76 | 8.62 |
| A.随温度升高,纯水中的kw逐渐减小 |
| B.随温度升高,NaOH溶液pH变化主要受水电离平衡变化影响 |
| C.随温度升高,CH3COOH的电离促进了水的电离 |
| D.随温度升高,CH3COONa溶液的pH减小,说明水解程度减小,c(CH3COO-)增大 |
您最近一年使用:0次
2020-03-28更新
|
183次组卷
|
3卷引用:北京市平谷区2020届高三第一次模拟考试化学试题
名校
6 . 常温下,将1.0L X mol/L CH3COOH溶液与0.1mol NaOH固体混合充分反应,再向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列说法正确的是
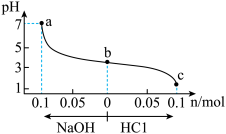

| A.X<0.1 |
| B.b→a过程中,水的电离程度逐渐增大 |
| C.Ka (CH3COOH) =10-8/(X-0.1) |
| D.b→c过程中,c(CH3COOH)/c(CH3COO)逐渐变小 |
您最近一年使用:0次
2020-01-29更新
|
415次组卷
|
4卷引用:福建省泉州市2020届高三第一次模拟考试化学试题
福建省泉州市2020届高三第一次模拟考试化学试题北京市十一学校2023-2024学年高三一模化学试题福建省泉州市2020届普通高中毕业班单科质量检查化学试题(已下线)考点11 弱电解质的电离及溶液pH-2020年高考化学命题预测与模拟试题分类精编
名校
7 . 已知:一元弱酸HA的电离平衡常数K =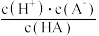 。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
下列说法正确的是
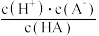 。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:| 化学式 | CH3COOH | HCN | H2CO3 |
| K | 1.75×10–5 | 4.9×10–10 | K1 = 4.4×10–7 K2 = 5.6×10–11 |
下列说法正确的是
| A.稀释CH3COOH溶液的过程中,n(CH3COO–)逐渐减小 |
B.NaHCO3溶液中:c(H2CO3) < c( ) < c(HCO3−) ) < c(HCO3−) |
| C.25℃时,相同物质的量浓度的NaCN溶液的碱性强于CH3COONa溶液 |
| D.向CH3COOH溶液或HCN溶液中加入Na2CO3溶液,均产生CO2 |
您最近一年使用:0次
2019-05-28更新
|
1104次组卷
|
5卷引用:【区级联考】北京市通州区2019届高三下学期第三次模拟考试理科综合化学试题
【区级联考】北京市通州区2019届高三下学期第三次模拟考试理科综合化学试题云南省昆明市官渡区第一中学2020届高三上学期期中考试理综化学试题广东省广州市天河区2022届高三一模化学试题北京市第五十五中学2022-2023学年高三上学期期中考试化学试题(已下线)押广东卷化学第8题 电解质溶液-备战2022年高考化学临考题号押题(广东卷)
名校
8 . 常温下,向50 mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下图所示。下列说法正确的是
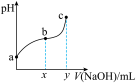
A.若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=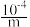 |
| B.若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH |
C.b~c段,随NaOH溶液的滴入,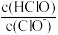 逐渐增大 逐渐增大 |
| D.若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO) |
您最近一年使用:0次
2019-05-10更新
|
1190次组卷
|
17卷引用:北京市2020届高三化学高考模拟试题(等级考试模拟试题)
北京市2020届高三化学高考模拟试题(等级考试模拟试题)北京市2020届高三高考模拟试题 (等级考试模拟试题)2017届江西省南昌市十所省重点中学命制高三第二次模拟突破冲刺(二)理综化学试卷【市级联考】广东省揭阳市2019届高三高考第一次模拟考试理科综合化学试题【市级联考】福建省莆田市2019届高三下学期(5月)第二次质量检测(A卷) 化学试题福建省泉州第十六中学2020届高三第五次能力测试理科综合化学试题天津市和平区2020届高三一模化学试题北京市第八十中学2023届高三下学期二模适应考试化学试题北京市第十四中学2023-2024学年高三下学期三模化学试题2017届湖北省八校高三上学期12月联考化学试卷河北省衡水中学2016-2017学年高一下学期三调考试化学试题(已下线)《考前20天终极攻略》-5月23日 溶液中的离子平衡夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——电解质溶液中的曲线问题(提升练习)安徽省肥东县高级中学2020届高三下学期3月线上调研考试理综化学试题湖南省邵东县第一中学2021届高三上学期第二次月考化学试题内蒙古赤峰第二实验中学2021届高三模拟考试(一)化学试题四川省成都市龙泉中学2020-2021学年高三下学期入学考试理综化学试题
9 . “绿水青山就是金山银山”。研究含氮和含硫化合物的性质在工业生产和环境保护中有重要意义。
(1)制备硫酸可以有如下两种途径:
2SO2(g)+O2(g)=2SO3(g)ΔH=-198 kJ· mol-1
SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=-41.8 kJ· mol-1
若CO的标准燃烧热为 283 kJ· mol-1,则1 mol NO2和1 mol CO反应生成CO2和NO的能量变化示意图中E2=________ kJ· mol-1。

(2)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,用NaOH溶液吸收SO2。当溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为_______________ 。
(3)连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为________________ ,连二亚硫酸根与HNO2(HNO2的电离常数为Ka=5.1×10-4)反应的离子方程式为________________________________ 。
(4)锅炉烟道气含CO、SO2,可通过如下反应回收硫:2CO(g)+SO2(g) S(l)+2CO2(g)。某温度下在2 L恒容密闭容器中通入2 mol SO2和一定量的CO发生反应,5 min后达到平衡,生成1 mol CO2。
S(l)+2CO2(g)。某温度下在2 L恒容密闭容器中通入2 mol SO2和一定量的CO发生反应,5 min后达到平衡,生成1 mol CO2。
①其他条件不变时,随着温度的升高,SO2的平衡转化率变化如图A,请解释其原因________________________________ 。(已知硫的沸点约是445°C)
②保持其他条件不变,第8分钟时,将容器体积迅速压缩至1 L,在10分钟时达到平衡,CO的物质的量变化了1 mol。请在图B中画出SO2浓度6~11分钟的变化曲线。______

(1)制备硫酸可以有如下两种途径:
2SO2(g)+O2(g)=2SO3(g)ΔH=-198 kJ· mol-1
SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=-41.8 kJ· mol-1
若CO的标准燃烧热为 283 kJ· mol-1,则1 mol NO2和1 mol CO反应生成CO2和NO的能量变化示意图中E2=

(2)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,用NaOH溶液吸收SO2。当溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为
(3)连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为
(4)锅炉烟道气含CO、SO2,可通过如下反应回收硫:2CO(g)+SO2(g)
 S(l)+2CO2(g)。某温度下在2 L恒容密闭容器中通入2 mol SO2和一定量的CO发生反应,5 min后达到平衡,生成1 mol CO2。
S(l)+2CO2(g)。某温度下在2 L恒容密闭容器中通入2 mol SO2和一定量的CO发生反应,5 min后达到平衡,生成1 mol CO2。①其他条件不变时,随着温度的升高,SO2的平衡转化率变化如图A,请解释其原因
②保持其他条件不变,第8分钟时,将容器体积迅速压缩至1 L,在10分钟时达到平衡,CO的物质的量变化了1 mol。请在图B中画出SO2浓度6~11分钟的变化曲线。

您最近一年使用:0次
名校
10 . 室温下,向10 mL pH=3的CH3COOH溶液中加入下列物质,对所得溶液的分析正确的是
| 加入的物质 | 对所得溶液的分析 | |
| A | 90 mLH2O | 由水电离出的c(H+)=10-10 mol·L-1 |
| B | 0.1 mol CH3COONa固体 | c(OH-)比原CH3COOH溶液中的大 |
| C | 10 mL pH=1 的H2SO4溶液 | CH3COOH的电离程度不变 |
| D | 10 mL pH=11的NaOH溶液 | c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-05-30更新
|
680次组卷
|
8卷引用:北京市通州区2018届高三二模理综化学试题
北京市通州区2018届高三二模理综化学试题安徽省皖中地区2019届高三入学摸底考试化学试题辽宁省葫芦岛市第六中学2019届高三上学期开学考试(8月)化学试题甘肃省甘谷县第一中学2019届高三上学期第一次检测考试化学试题吉林省吉化第一高级中学校2019-2020学年高二上学期期中考试化学试题(已下线)专题8.1 弱电解质的电离平衡(练)-《2020年高考一轮复习讲练测》(已下线)专题八 水溶液中的离子反应与平衡 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)第1讲 弱电解质的电离平衡



